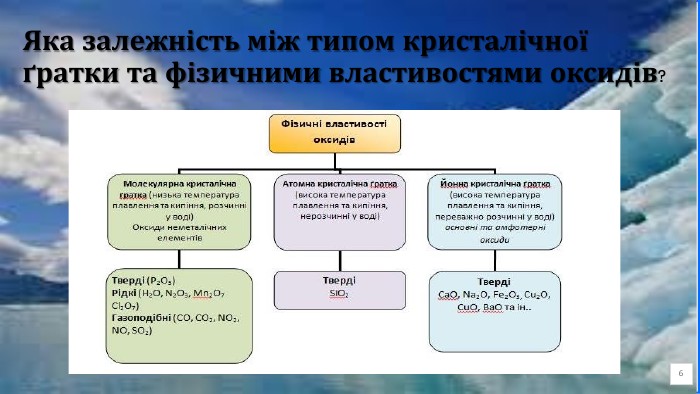
Фізичні властивості оксидів. Хімічні властивості оснόвних оксидів.
Про матеріал
ознайомити учнів з фізичними властивостями оксидів; розвивати вміння класифікувати складні неорганічні речовини, оксиди; за назвою речовини складати її формулу;
активізувати пізнавальну активність учнів, сприяти розвитку логічного мислення, формувати вміння використовувати придбані знання на практиці;
творче ставлення до справи, старанність, працьовитість, відповідальність за результати своєї роботи; комунікабельність, вміння працювати самостійно і в колективі.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку