Презентація "Розрахунки за хімічними рівняннями маси, об'єму, кількості речовини реагентів та продуктів реакцій"











![З рівняння реакції виходить, що внаслідок взаємодії з водою 1 моль Са. О можна добути 1 моль гашеного вапна Са(ОН)2, а якщо взяти не 1 моль, а 5 моль Са. О, то можна добути гашеного вапна Са(ОН)2 х моль. Тобто між величинами існує пряма пропорційна залежність. Отже, можемо скласти наступне співвідношення:з 1моль Са. О ----------- утворюється 1 моль Са(ОН)2з 5моль Са. О ----------- утворюється х моль Са(ОН)2x = (5 моль • 1моль) / (1 моль) = 5моль. Отже з 5 моль Са. О утворюється 5 моль Са(ОН)2. Наступний крок - це знаходження власне маси гашеного вапна Са(ОН)2 за формулою:m = v · M => m[Са(ОН)2] = v[Са(ОН)2] · M[Са(ОН)2] = 5 моль · 74 г/моль = 370г. Відповідь. Унаслідок взаємодії з водою кальцій оксиду кількістю речовини 5 моль, можна добути гашене вапно Са(ОН)2 масою 370 г (m(Са(ОН)2) = 370 г). З рівняння реакції виходить, що внаслідок взаємодії з водою 1 моль Са. О можна добути 1 моль гашеного вапна Са(ОН)2, а якщо взяти не 1 моль, а 5 моль Са. О, то можна добути гашеного вапна Са(ОН)2 х моль. Тобто між величинами існує пряма пропорційна залежність. Отже, можемо скласти наступне співвідношення:з 1моль Са. О ----------- утворюється 1 моль Са(ОН)2з 5моль Са. О ----------- утворюється х моль Са(ОН)2x = (5 моль • 1моль) / (1 моль) = 5моль. Отже з 5 моль Са. О утворюється 5 моль Са(ОН)2. Наступний крок - це знаходження власне маси гашеного вапна Са(ОН)2 за формулою:m = v · M => m[Са(ОН)2] = v[Са(ОН)2] · M[Са(ОН)2] = 5 моль · 74 г/моль = 370г. Відповідь. Унаслідок взаємодії з водою кальцій оксиду кількістю речовини 5 моль, можна добути гашене вапно Са(ОН)2 масою 370 г (m(Са(ОН)2) = 370 г).](/uploads/files/30279/384733/438759_images/12.jpg)








КІЛЬКІСНІ ВІДНОШЕННЯ РЕЧОВИН У ХІМІЧНІЙ РЕАКЦІЇ. Записуючи рівняння тієї чи іншої хімічної реакції, ви брали до уваги склад реагентів і продуктів реакції. Тобто зважали на якісну характеристику хімічного явища. Коефіцієнти перед формулами забезпечували відповідність ваших записів закону збереження маси речовин. Однак роль коефіцієнтів цим не вичерпується — у рівняннях реакцій вони відображають відношення кількості речовини реагентів і продуктів реакції. Розглянемо це на прикладі реакції фосфор(V) оксиду з гарячою водою. Р2 О5 + 3 Н2 О = 2 Н3 РО4
За рівнянням цієї реакції 1 моль фосфор(V) оксиду взаємодіє з 3 моль води, унаслідок чого утворюється 2 моль ортофосфатної кислоти. Тобто відношення молів реагентів і продукту реакції буде таким:1 : 3 : 2. Тому якщо для реакції буде взято 2 моль фосфор(V) оксиду, то, щоб це відношення не порушилося, води знадобиться 6 моль, а кислоти утвориться не 4, а 2 моль.
Скільки б молів обох реагентів не було взято для проведення цієї реакції, взаємодіятимуть вони у відношенні 1 : 3, а кількість речовини ортофосфатної кислоти буде вдвічі більша, ніж оксиду. Для того щоб обчислити за рівнянням реакції масу, об'єм чи кількість речовини будь-якого реагенту або будь-якого продукту реакції, достатньо відомостей про одну з речовин.
Алгоритм розрахунків за хімічним рівнянням:1) записують рівняння реакції;2) зрівнюють ліву та праву частини рівняння (розставляють коефіцієнти);3) розглядають кількісні відношення зазначених в умові задачі речовин за рівнянням реакції та під їхніми формулами записують кількість речовини, на яку вказують коефіцієнти;4) розглядають кількісні відношення зазначених в умові задачі речовин і над їхніми формулами записують кількість речовини, виходячи з умови задачі;5) обчислюють кількість речовини, а за потреби — її масу чи об'єм, скориставшись записами, зробленими над формулами в рівнянні реакції й дотримуючись кількісних відношень речовин;6) записують відповідь.
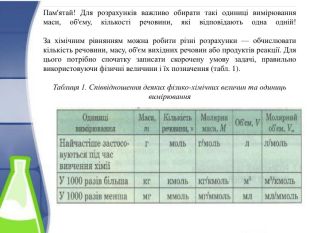
Пам'ятай! Для розрахунків важливо обирати такі одиниці вимірювання маси, об'єму, кількості речовини, які відповідають одна одній!За хімічним рівнянням можна робити різні розрахунки — обчислювати кількість речовини, масу, об'єм вихідних речовин або продуктів реакції. Для цього потрібно спочатку записати скорочену умову задачі, правильно використовуючи фізичні величини і їх позначення (табл. 1). Таблиця 1. Співвідношення деяких фізико-хімічних величин та одиниць вимірювання
ОБЧИСЛЕННЯ ЗА РІВНЯННЯМ РЕАКЦІЇ МАСИ РЕЧОВИНИ. Обчислити масу натрій гідроксиду, що утвориться внаслідок взаємодії натрій оксиду кількістю речовини 2 моль із достатньою кількістю води.1. Напишемо рівняння реакції. Na2 O + H2 O = 2 Na. OH2. Обчислимо кількість речовини натрій гідроксиду Na. OH, що утворився в результаті реакції. Згідно з рівнянням реакції та записами, зробленими на початку параграфа, співвідношення молів реагенту Na2 O і продукту реакції Na. OH становить 1:2. Тобто кількість речовини натрій гідроксиду вдвічі більша, ніж кількість речовини оксиду. Отже:v(Na. OH) = 2 · 2 = 4 (моль).3. Обчислимо масу натрій гідроксиду, що утворився:
Яку масу гашеного вапна Са(ОН)2 можна добути внаслідок взаємодії з водою кальцій оксиду кількістю речовини 5 моль?Дано: v(Са. О) = 5 моль|m(Са(ОН)2) — ?5 моль х г. Са. О + Н2 О = Са(ОН)2 Під формулами речовин запиши кількість речовини за рівнянням реакції (вона дорівнює коефіцієнту молекули):5 моль х. Са. О + Н2 О = Са(ОН)2_______________ __________________v = 1 моль v = 1 моль
З рівняння реакції виходить, що внаслідок взаємодії з водою 1 моль Са. О можна добути 1 моль гашеного вапна Са(ОН)2, а якщо взяти не 1 моль, а 5 моль Са. О, то можна добути гашеного вапна Са(ОН)2 х моль. Тобто між величинами існує пряма пропорційна залежність. Отже, можемо скласти наступне співвідношення:з 1моль Са. О ----------- утворюється 1 моль Са(ОН)2з 5моль Са. О ----------- утворюється х моль Са(ОН)2x = (5 моль • 1моль) / (1 моль) = 5моль. Отже з 5 моль Са. О утворюється 5 моль Са(ОН)2. Наступний крок - це знаходження власне маси гашеного вапна Са(ОН)2 за формулою:m = v · M => m[Са(ОН)2] = v[Са(ОН)2] · M[Са(ОН)2] = 5 моль · 74 г/моль = 370г. Відповідь. Унаслідок взаємодії з водою кальцій оксиду кількістю речовини 5 моль, можна добути гашене вапно Са(ОН)2 масою 370 г (m(Са(ОН)2) = 370 г).
Розрахунки кількість речовини за відомою масою речовини. Магній масою 3 г взаємодіє з киснем. Яка кількість речовини магній оксиду утвориться при цьому?Передусім запиши скорочену умову задачі та склади рівняння хімічної реакції з урахуванням закону збереження мас. Дано:m(Mg) = 3 гv(Mg. O) — ?Розв'язування:2 Mg + О2 = 2 Mg. O Прочитай ще раз умову задачі та підкресли відоме (що дано) і невідоме (що треба взнати). Над підкресленими формулами простав вихідні дані з умови задачі. З г х моль2 Mg + О2 = 2 Mg. O Під формулами речовин запиши кількість речовини за рівнянням реакції (вона дорівнює коефіцієнту молекули): З г х моль 2 Mg + О2 = 2 Mg. O v= 2 моль v = 2 моль
Оскільки відносно магнію виявились різні одиниці вимірювання (грами і молі), треба визначити, яку кількість речовини становлять 3 г магнію:v = m / M; M(Mg) = 24 г/моль;v(Mg) = (3 г) / (24 г/моль) = 0,125 моль. Рівняння реакції показує, якщо у взаємодію з киснем вступає 2 моль магнію, то утворюється 2 моль Mg. O. Отже, якщо в реакцію вступає 0,125 моль Mg, то й утворюється 0,125 моль Mg. O. Або складаємо наступне співвідношення:з 2моль Mg ----------- утворюється 2 моль Mg. Oз 0,125 моль Mg ----------- утворюється х моль Mg. Ox = (2 моль • 0,125моль) / (2 моль) = 0,125моль. Отже з 3г Mg утворюється 0,125моль Mg. O. Відповідь. Якщо з киснем взаємодіє магній масою 3 г, то утворюється магній оксид Mg. O кількістю речовини 0,125 моль (v(Mg. O) = 0,125 моль).
Розрахунки об'єму газу за відомою масою речовини. Який об'єм водну утвориться (н.у.) при взаємодії 5 г Кальцію з хлоридною кислотою?Передусім запиши скорочену умову задачі та склади рівняння хімічної реакції з урахуванням закону збереження мас. Дано:m(Са) = 5 г. V(H2) — ?Розв'язування: Ca + 2 HCl = Ca. Cl2 + H2 Прочитай ще раз умову задачі та підкресли відоме (що дано) і невідоме (що треба взнати). Над підкресленими формулами простав вихідні дані з умови задачі. 5 г х л. Ca + 2 HCl = Ca. Cl2 + H2 Під формулами речовин запиши кількість речовини за рівнянням реакції (вона дорівнює коефіцієнту молекули): 5 г х л. Ca + 2 HCl = Ca. Cl2 + H2v= 1 моль v = 1 моль
Оскільки відносно Кальцыю виявились різні одиниці вимірювання (грами і літри), треба визначити, яку кількість речовини становлять 5 г Кальцію:v = m / M; M(Са) = 40 г/моль;v(Са) = (5 г) / (40 г/моль) = 0,125 моль. Рівняння реакції показує, якщо у взаємодію з хлоридною кислотою вступає 1 моль магнію, то утворюється 1 моль водню Н2. Отже, якщо в реакцію вступає 0,125 моль Са, то й утворюється 0,125 моль Н2. Або складаємо наступне співвідношення:з 1моль Са ----------- утворюється 1 моль Н2з 0,125 моль Са ----------- утворюється х моль Н2x = (1 моль • 0,125моль) / (1 моль) = 0,125моль. Отже з 5г Са утворюється 0,125моль Н2. Тепер визначемо об'єм водню, що утворився в результаті реації. Скориистуємося формулою: V = v · Vm. Vm - за нормальних умов стала величина і дорівнює 22,4 л/моль. V(Н2) = v(Н2) · Vm. V(Н2) = 0,125 моль · 22,4 л/моль = 2,8л. Відповідь. Якщо з хлоридною кислотою взаємодіє Кальцій масою 5 г, то утворюється водень об'ємом 2,8 л (V(H2)=2,8л).
Задачі на самостійне розв’язування.1. Яка кількість речовини калій оксиду (K2 O) утвориться під час окиснення калію кількістю речовини 0,2 моль?2. Який об’єм кисню (н. у.) витратиться на спалювання вугілля (C) кількістю речовини 0,5 моль?3. Яку масу кальцій оксиду (Ca. O) можна добути окисненням кальцію масою 0,8 г?4. Який об’єм водню (н. у.) необхідний для відновлення міді масою 12,8 г з купрум(II) оксиду? Скільки грамів води виділиться у цьому процесі?5. Яку масу ферум(III) оксиду можна відновити воднем кількістю речовини 0,4 моль? Скільки грамів заліза утвориться у цьому процесі?6. Яка кількість речовини і маса цинк оксиду утвориться в результаті спалювання цинк сульфіду масою 9,7 г?
7. Обчисліть об'єм (н.у.) і кількість молекул водню, який прореагував з киснем масою 3,2 г.8. Обчисліть кількість речовини сульфур(VІ) оксиду та масу води, необхідних для добування сульфатної кислоти масою 78,4 г.9. Суміш силіцій(IV) оксиду й фосфор(V) оксиду масою 40 г обробили надлишком гарячої води. Маса одержаного продукту реакції дорівнювала 39,2 г. Визначте масу кожного оксиду в початковій суміші.10. У результаті реакції обміну між барій оксидом і сульфатною кислотою випав осад масою 46,6 г. Яку масу та кількість речовини барій оксиду взято? Скільки молекул міститься у цій порції оксиду?11. На суміш порошків магнію і магній оксиду масою 10 г подіяли розчином хлоридної кислоти, внаслідок чого виділився, газ об’єм якого 4,48 л (н. у.). Які маси магнію і магній оксиду були у вихідній суміші? Якій кількості речовини відповідають ці маси?
12. При згорянні простої речовини, утвореної двовалентним елементом масою 7,5 г, утворилось 10,5 г оксиду. Визначте цей елемент.13. Під час взаємодії з водою оксиду одновалентного металу масою 37,2 г добуто 48 г його гідроксиду. Визначте метал.14. Визначте метал, якщо 5,6 г його, реагуючи з хлоридною кислотою, утворює сіль масою 12,7 г (з загальною формулою ECl2), а реагуючи з хлором – хлорид масою 16,25 г з загальною формулою ECl3.15. У результаті згоряння металу масою 1,08 г, що розміщений у III групі періодичної системи елементів, утворився оксид масою 2,04 г. Визначте цей метал.


про публікацію авторської розробки
Додати розробку