Презентація "Розв'язування розрахункових задач з теми "Етанова кислота""
Про матеріал
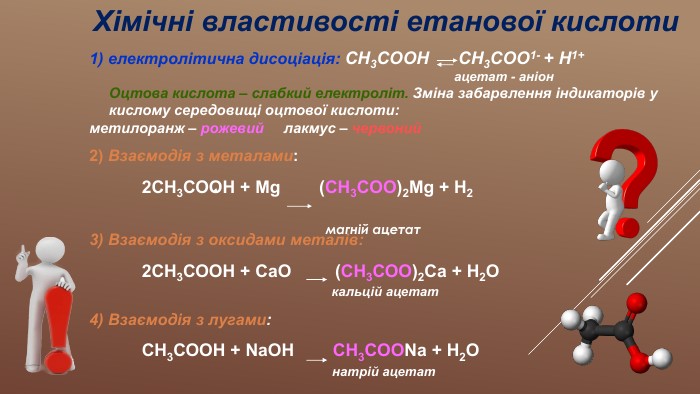
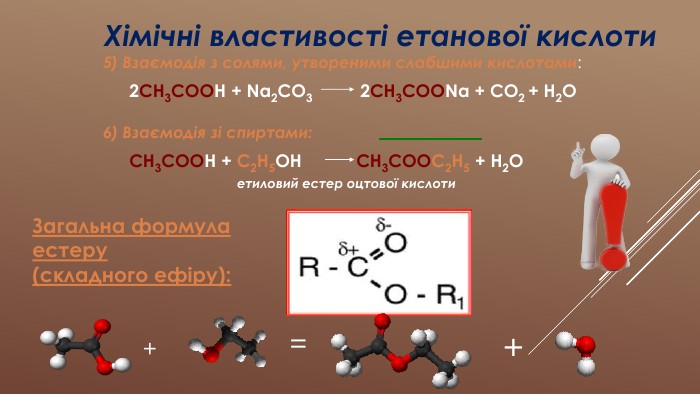
Презентація "Розв'язування розрахункових задач з теми "Етанова кислота"" містить задачі з розв'язками з використанням поняття "масова частка розчиненої речовини в розчині" на прикладах розчинів оцтової кислоти та її властивостей. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку