Презентація "Швидкість хімічної реакції"
Про матеріал
Презентація для уроку з теми "Швидкість хімічної реакції".В презентації подано приклади розв'язання задач з теми з урахуванням питань ЗНО Перегляд файлу
Зміст слайдів
ppt
До підручника
Хімія 9 клас (Гранкіна Т.М.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку




![Концентрація Величина, що показує вміст кількості речовини в одиниці об’єму називається концентрацією. С=n/ V де c – концентрація , n – кількість речовини [моль], V – об’єм [л]. Концентрація Величина, що показує вміст кількості речовини в одиниці об’єму називається концентрацією. С=n/ V де c – концентрація , n – кількість речовини [моль], V – об’єм [л].](/uploads/files/141640/384138/438228_images/4.jpg)
![Отже, швидкість реакції - це зміна концентрації одного з реагентів чи одного з продуктів реакції за одиницю часу при незмінному об’ємі системи. v =С2 –С1/t2-t1 =∆ C ⁄∆ t , де v – швидкість хімічної реакції , c1 та c2 – початкова та кінцева концентрація (відповідно) , t1 та t2 – початковий та кінцевий час (відповідно) – ∆ C зміна концентрації , ∆ t – проміжок часу [с]. Отже, швидкість реакції - це зміна концентрації одного з реагентів чи одного з продуктів реакції за одиницю часу при незмінному об’ємі системи. v =С2 –С1/t2-t1 =∆ C ⁄∆ t , де v – швидкість хімічної реакції , c1 та c2 – початкова та кінцева концентрація (відповідно) , t1 та t2 – початковий та кінцевий час (відповідно) – ∆ C зміна концентрації , ∆ t – проміжок часу [с].](/uploads/files/141640/384138/438228_images/5.jpg)
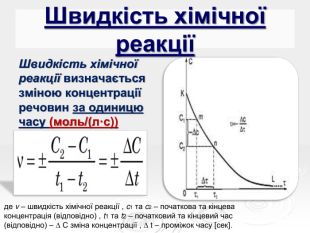
![Швидкість хімічної реакції Швидкість хімічної реакції визначається зміною концентрації речовин за одиницю часу (моль/(л·с)) де v – швидкість хімічної реакції , c1 та c2 – початкова та кінцева концентрація (відповідно) , t1 та t2 – початковий та кінцевий час (відповідно) – ∆ C зміна концентрації , ∆ t – проміжок часу [сек]. Швидкість хімічної реакції Швидкість хімічної реакції визначається зміною концентрації речовин за одиницю часу (моль/(л·с)) де v – швидкість хімічної реакції , c1 та c2 – початкова та кінцева концентрація (відповідно) , t1 та t2 – початковий та кінцевий час (відповідно) – ∆ C зміна концентрації , ∆ t – проміжок часу [сек].](/uploads/files/141640/384138/438228_images/6.jpg)







![Закон діючих мас 1867 рік Математична залежність швидкості від концентрації для реакції : А + Б = АБ має вигляд: , де V –швидкість реакции; K – константа швидкості; [А] и [Б] – концентрації речовин А и Б відповідно Норвезькі дослідники Гульдберг Като Максиміліан Вааге Петер Вааге Закон діючих мас 1867 рік Математична залежність швидкості від концентрації для реакції : А + Б = АБ має вигляд: , де V –швидкість реакции; K – константа швидкості; [А] и [Б] – концентрації речовин А и Б відповідно Норвезькі дослідники Гульдберг Като Максиміліан Вааге Петер Вааге](/uploads/files/141640/384138/438228_images/14.jpg)

![Дано [N2]2=2[N2]1 N2+ 3H2= 2NH3 [H2]2=2[H2]1 V1=[N2]*[H2](3)=XY(3) V2/V1-? V2=2X*(2Y)3=2X*8Y3= 16XY3 V2/V1=16XY3/XY3=16 разів Відповідь: швидкість зросте у 16 разів Дано [N2]2=2[N2]1 N2+ 3H2= 2NH3 [H2]2=2[H2]1 V1=[N2]*[H2](3)=XY(3) V2/V1-? V2=2X*(2Y)3=2X*8Y3= 16XY3 V2/V1=16XY3/XY3=16 разів Відповідь: швидкість зросте у 16 разів](/uploads/files/141640/384138/438228_images/16.jpg)