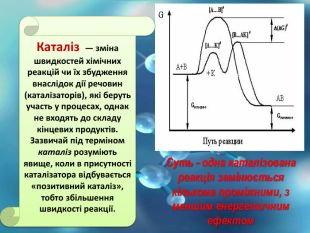
Швидкість хімічної реакції
Про матеріал
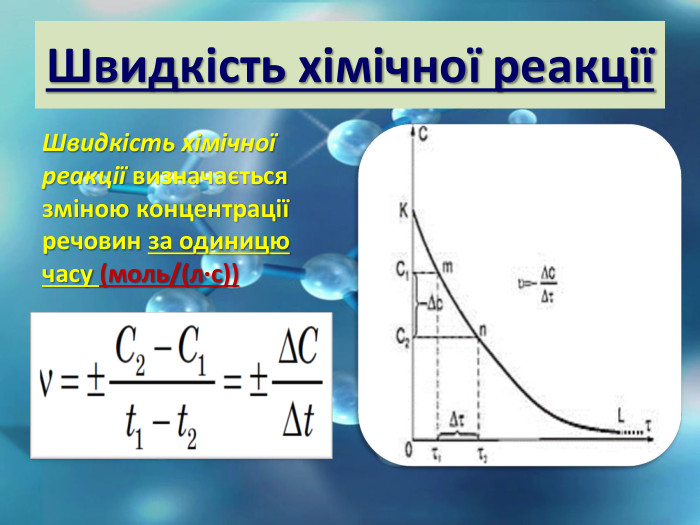
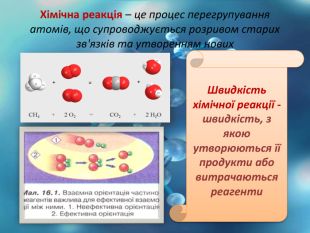
Швидкість хімічної реакції - це величина, що показує , як змінюється концентрація вихідних речовин або продуктів реакції.
В даній презентації викладено матеріал теми уроку "Швидкість хімічної реакції", 9кл. Перегляд файлу
Зміст слайдів
ppt
До підручника
Хімія 9 клас (Савчин М.М.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку