Презентація "Узагальнення знань з теми "Кількість речовини""
Про матеріал
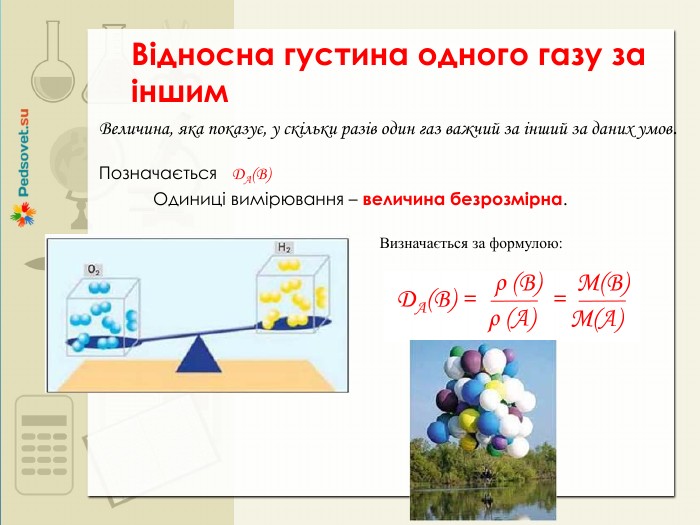
Презентація містить матеріал для повторення та узагальнення теми "Кількість речовини", тестові вправи та задачі. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую!
-
Чудова презентація! Дякую!
-
Дякую!!! Дуже класна презентація, списала)))))) собі))))


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку