Просторова будова молекули
8 клас
Тема уроку: Просторова будова молекули
Мета уроку: продовжувати формувати знання учнів про хімічний зв'язок; ознайомити з характеристикою ковалентного зв’язку та механізмом його утворення; розкрити значення поняття гібридизація; ознайомитися із різними методами знаходження можливості існування тої чи іншої молекули на прикладі методу валентних зв’язків та встановлення просторової будови молекули; розвивати вміння логічно мислити і здатність узагальнювати та наводити приклади, робити висновки, виробити вміння використовувати отримані знання на практиці.
Хід уроку.
І Організаційний етап.
Оголошення теми уроку та його мети і задач, плану уроку.
ІІ. Актуалізація опорних знань, мотивація навчальної діяльності.
Питання на обговорення в класі:
- Що таке хімічний зв'язок?
- Які типи хімічних зв’язків Вам відомі? Приклади ?
- Що таке ковалентний зв'язок?
- Що таке неполярний та полярний ковалентні звязки ?
- Що таке електронегативність?
Тести на картках (для декількох учнів).
- Розташувати молекули по стовпчикам за типом хімічного зв’язку: NaCl, H2SO4, H2O, H2,NH3, NH4Cl,H2O2
|
Ковалентний полярний |
Ковалентний неполярний |
йонний |
|
|
|
|
2. Розташуйте молекули зі збільшенням полярності зв’язку: H2O, NH3, PH3, SO2
4. Чому молекула NH3 розчиняється у воді, а молекула CH4 ні?
5. Порівняйте температури плавлення NaCl, H2O та Fe? Як природа хімічного зв’язку впливає на температуру плавлення?
6. Що таке правило Октета?
7. Напишіть електронну та графічну формулу для Na та S?
8. Яку валентність може мати Сульфур згідно електронної будови?
7. Що таке «збуджений стан»? Наведіть приклади.
ІІІ. Вивчення нового матеріалу.
Постановка проблемного питання.
І. З чим пов’язана просторова будова молекул?
Перше за все треба розібратись з механізмом ковалентного зв’язку. Оскільки основною ознакою ковалентного зв’язку є спільна електронна пара, яка належить обом хімічно сполученим атомам, оскільки перебування двох електронів у полії дії двох ядер енергетично вигідніше, ніж знаходження кожного електрона у полі свого ядра. Виникнення спільної електронної пари може проходити за різними механізмами: частіше -за обмінними, а інколи -за донорно-акцепторними.
При розгляді форми молекули зазвичай враховують кількість зв’язків та неподілених електронних пар центрального атому на зовнішньому енергетичному рівні. Неподілені електронні пари займають багато місця та відштовхують від себе зв’язки. Це наглядно видно на малюнку нижче, де в молекулі води 2 неподілені електронні пари, в молекулі амоніаку -одна, а молекулі метану-жодної:
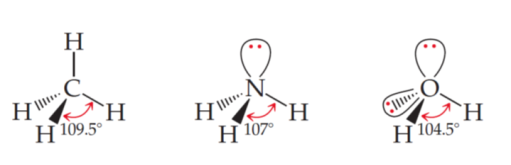
Отже, для встановлення просторової будови, будемо користуватись:
А-кількість зв’язків, В-кількість неподілених електронних пар
А+В-стеричне число.
Приклад 1 Молекула H2O
A=2, B=2 A+B=4 (тетраедер)
Положення атомів
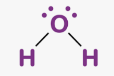
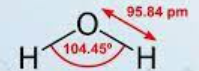
Форма: кутова
Приклад 2 Молекула SO2
A=2, B=1 A+B=3 (плоский трикутник)
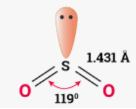
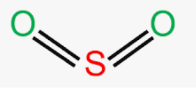
Форма : кутова
Приклад 3 Молекула MgCl2
A=2, B=0 A+B=2 (лінійна)
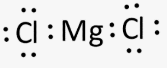
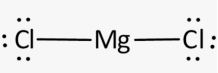
Форма : лінійна
ІІ. Також для пояснення просторової будови молекули введено поняття гібридизація. Так що таке гібридизація?
Гібридизація- це змішування орбіталей атомів при утворенні однакових зв’язків.
Атом С в молекулі метану CH4 утворює 4 однакових зв’язки. Для цього атом Карбону переходить від основного стану в «збуджений».

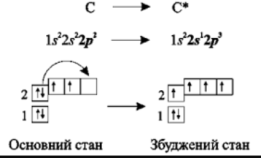
Одна 2S та три 2p орбіталі змішуються ( стають рівнозначемі, гібрідними), тому гібридизація цього атома Карбону -sp3. Отже, як ми бачимо, тип гібридизації центрального атому визначає просторову будову молекули:
|
Тип гібридизації |
Форма молекули |
приклади |
|
Sp |
Лінійна |
HCl |
|
Sp2 |
Трикутна |
SO3 |
|
Sp3 |
тетраедрична |
CH4 |
|
Sp3d |
Тригональна біпіраміда |
PCl5 |
Приклад 4 молекула ClF3
A=3, B=2 A+B=5 (тригональна біпираміда)
Cl:… 3S23P5→….3S23P43d1 отже Гібридизація Cl:sp3d1
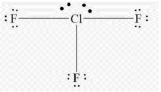
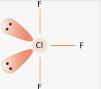
Форма: Т -подібна
Приклад 5 Молекула NH3
A=3, B=1 A+B=4 (тетраедер)
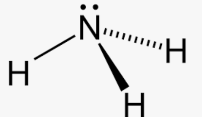
Форма: тригональна піраміда
Приклад 6 Молекула AlCl3
A=3, B=0 A+B=3 (плоский трикутник)
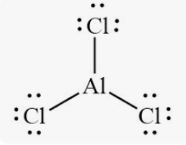
Форма : трикутник
Приклад 7 Молекула XeF4
A=4, B=2 A+B=6 (октаедер)
Xe:…5S25P6→…5S25P45d2 отже Гібридизація Xe: sp3d2
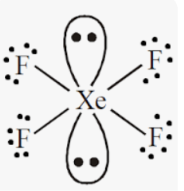
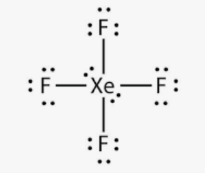
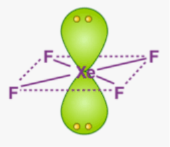
Форма : Квадрат
Приклад 8 молекула SF4
A=4, B=1 A+B=5 (тригональна бипіраміда)
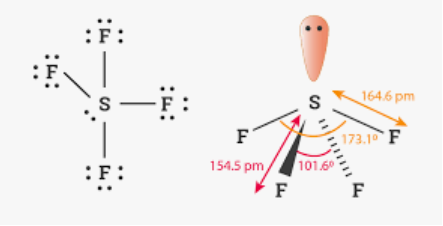
Форма: диформований тетраедер
Приклад 9 Молекула CH4
A=4, B=o A+B=4 (тетраедер)
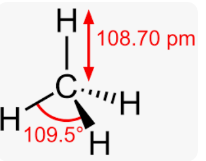
Форма : тетраедер
Приклад 10 молекула IF5
A=5, B=1 A+B=6 (октаедер)
I:…5S25P5→…5S25P35d2 отже Гібридизація I: sp3d2
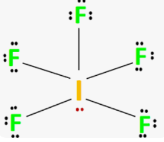
Форма : квадратна піраміда
Приклад 11 молекула PF5
A=5, B=0 A+B=5 (тригональна біпираміда)
P:…3S23P3→…3S13P33d1 отже Гібридизація P: sp3d
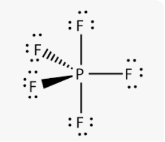
Форма: тригональна бипираміда
Приклад 12 Молекула SCL6
A=6, B=0 A+B=6 (октаедер)
S:…3S23P4→…3S13P33d2 отже Гібридизація S: sp3d2
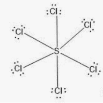
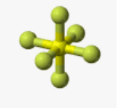
Форма : октаедер
|
Геометрія молекул |
Зв’язуючих ел. пар
|
Незв’язучих ел. пар |
Всього валентних пар |
Геометрія молекули |
|
лінійна |
2 |
0 |
2 |
Лінійна |
|
трикутник |
3 |
0 |
3 |
Трикутник |
|
2 |
1 |
3 |
Кутова |
|
|
тетраедер |
4 |
0 |
4 |
Тетраедер |
|
3 |
1 |
Трикутна |
||
|
2 |
2 |
кутова |
||
|
Тригональна біпіраміда |
5 |
0 |
5 |
Тригональна біпіраміда |
|
4 |
1 |
Диформований тетраедер, «гойдалка», дисфеноїд |
||
|
3 |
2 |
Т-подібна |
||
|
2 |
3 |
Лінійна |
||
|
октаедер |
6 |
0 |
6 |
Октаедер |
|
5 |
1 |
Квадратна біпіраміда |
||
|
4 |
2 |
Квадратна |
||
|
Пентагональна біпіраміда |
7 |
0 |
7 |
Пентагональна біпіраміда |
|
7 |
1 |
Квадратна біпіраміда |
||
|
7 |
2 |
Квадратна |
ІІ. Що таке σ-зв’язок та π-зв’язки і як вони впливають на просторову будову молекули?
Сигма-зв’язок (σ-зв’язок) — простий (одинарний) ковалентний зв’язок, що утворюється перекриванням електронних орбіталей по лінії, яка з’єднує атоми. Зв’язок характеризується осьовою симетрією:
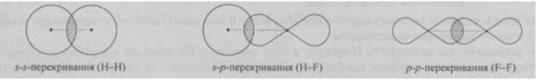
В утворенні σ-зв’язку можуть брати участь як звичайні, так і гібридизовані орбіталі.
2. Пі-зв’язок (π-зв’язок) -ковалентний зв’язок, що утворюється перекриванням електронних орбіталей які розміщені по різні боки від площини, яка з’єднує центри атомов.
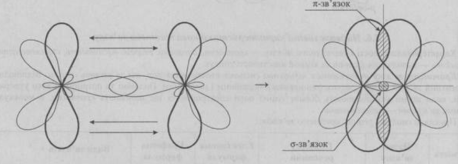
Узагальнення та систематизація знань.
- Як ви вважаєте яку просторову будову мають H2S, SO2,OF2,NCL3, BCl3?
- Який тип гібридизації центрального атома в молекулах NH3, PH3, BH3?
- Скільки σ- та π-зв’язків в молекулі?
4.Яка просторова будова правильна?
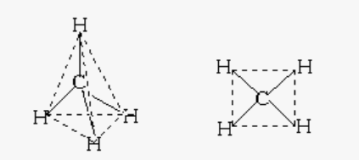
Підведення підсумків уроку.
V. Домашнє завдання:
1. Виконати індивідуальні задачі на картках.
Задача
- Покажіть розподілення валентних електронів по орбіталям для кожного атому в розглянутій молекулі;
- Визначити механізм утворення зв’язку;
- Визначити полярність зв’язку;
- Вкажіть чи має місце гібридизація;
- Покажіть геометричну структуру молекули
|
Номер варіанту |
задача |
|
1 |
H2S, TeF6, Li2, SiC |
|
2 |
GeH4, AsH3, HCl, LiH |
|
3 |
F2, LiCl, HBr, H2Te |
|
4 |
HF, AsF5, PF5, SnH4 |
Література
1 Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. Современный курс для поступающих в вузы. 17-е изд., перераб. и доп. - М.: 2020
2 Березан О. Хімія. Довідник школяра Підручники і посібники, 2021.- 560 с
3https://elearning.sumdu.edu.ua/free_content/lectured:c63732c3bf9b7070c82625f128c7980998d6c700/latest/39743/index.html
4. Ахметов Н.С. Общая и неорганическая химия. Учеб. для Вузов. - 4-е изд., испр. - М.: Высшая школа, 2001. - 743 с


про публікацію авторської розробки
Додати розробку
