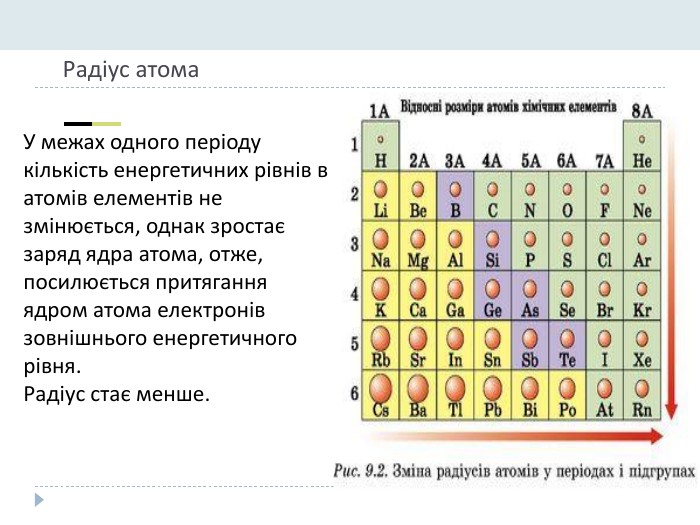
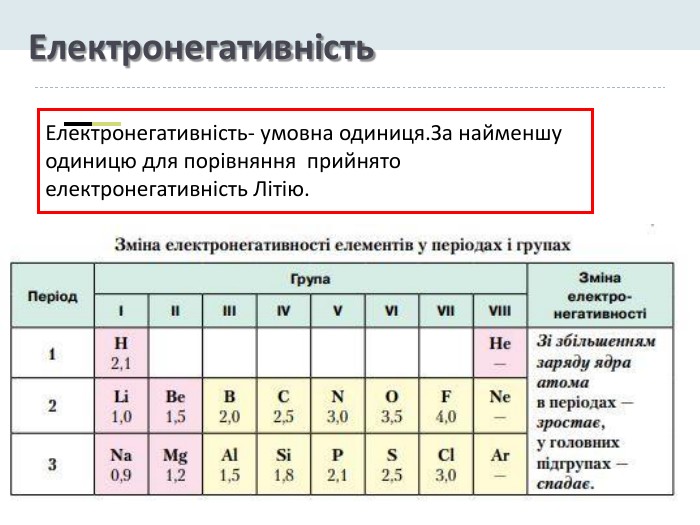
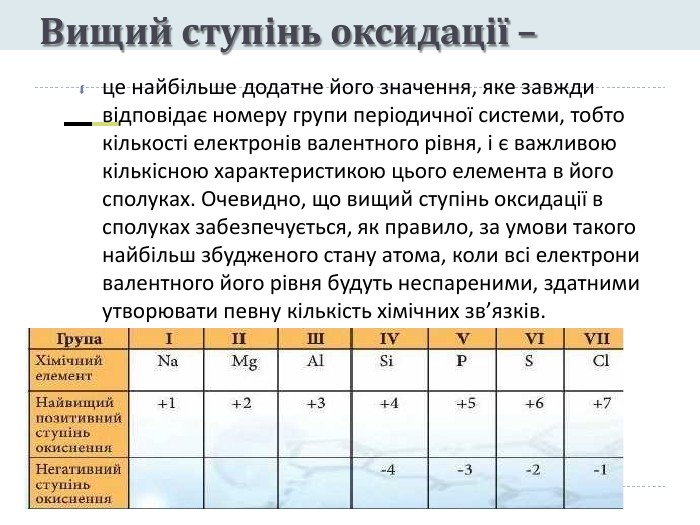
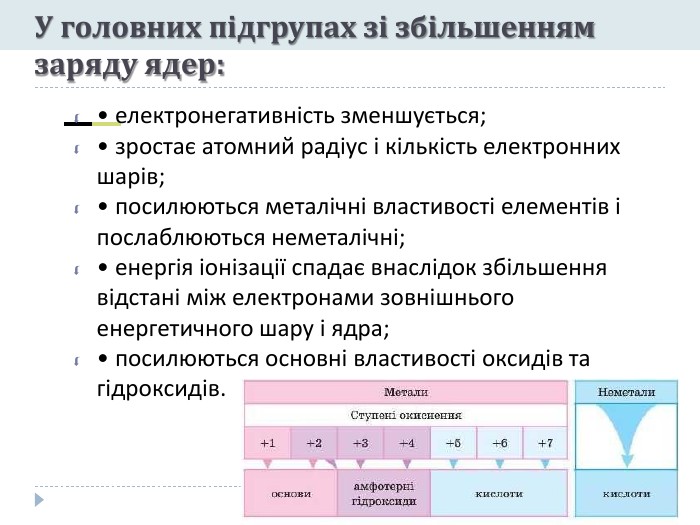
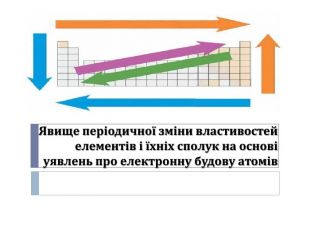
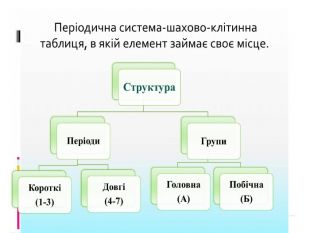
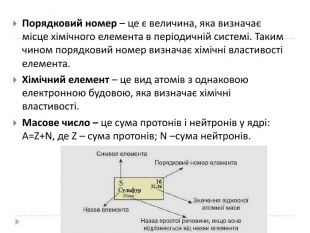
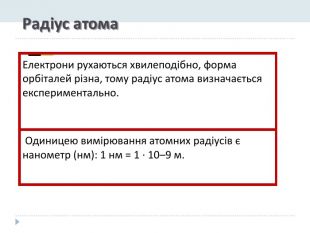
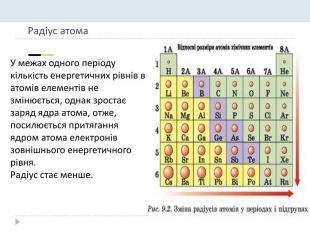
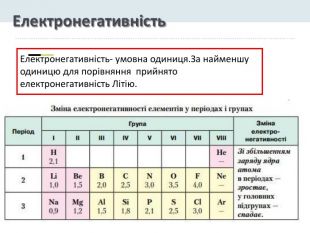
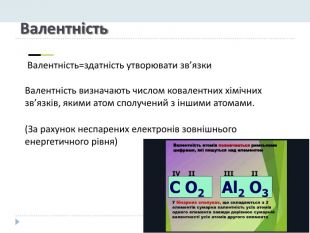
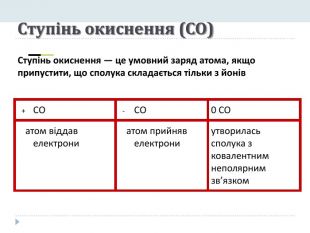
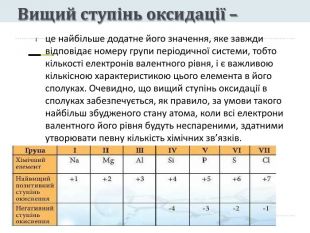
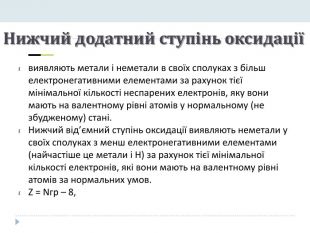
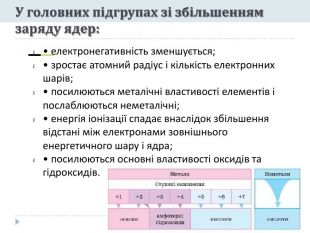
Презентація "Явище періодичної зміни властивостей елементів і їхніх сполук на основі уявлень про електронну будову атомів"
Про матеріал
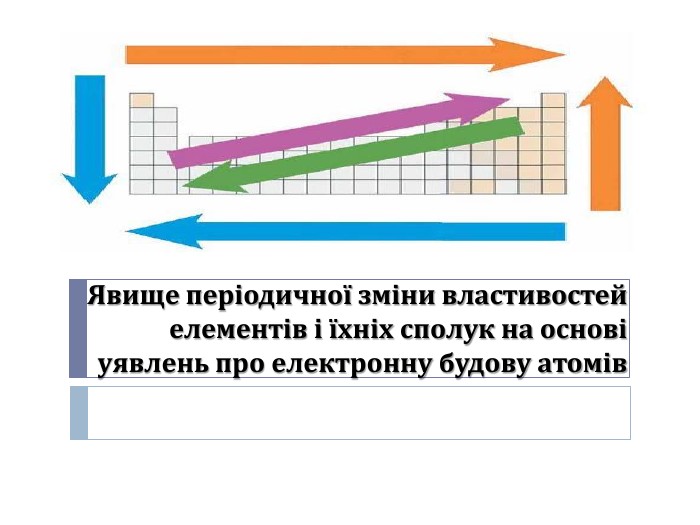
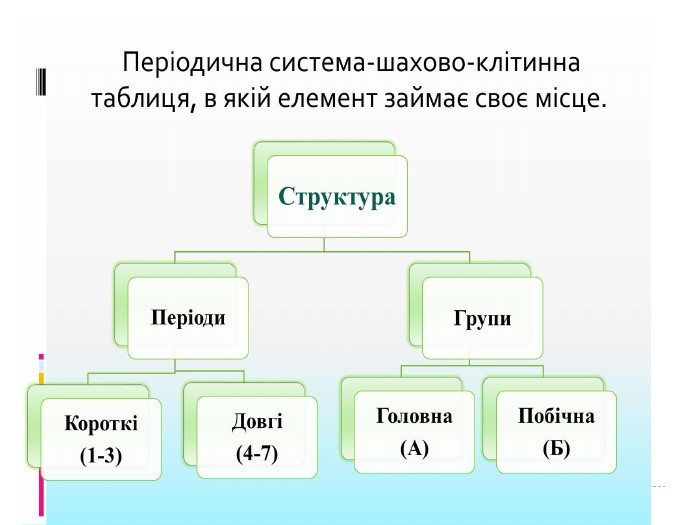
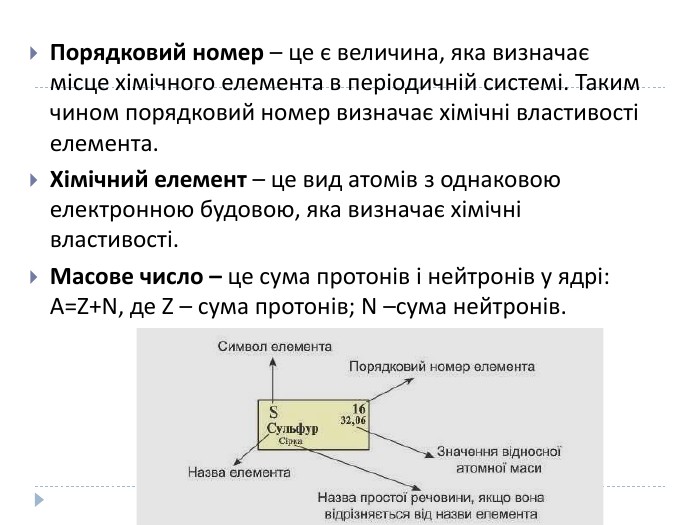
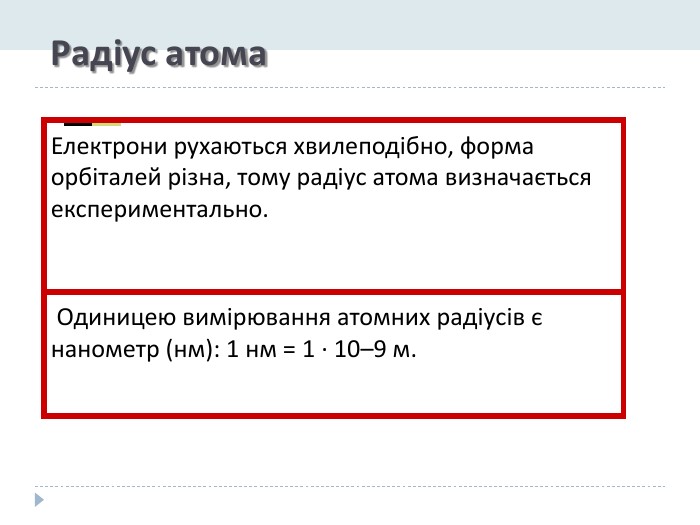
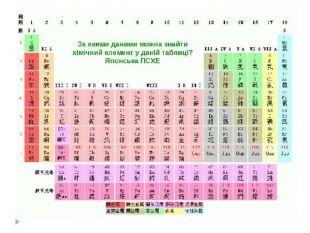
Розробка уроку-презентації з теми "Явище періодичної зміни властивостей елементів і їхніх сполук на основі уявлень про електронну будову атомів" для учнів 11 класу Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку