Урок з хімії на тему : "Кисень. Фізичні властивості кисню"
Про матеріал
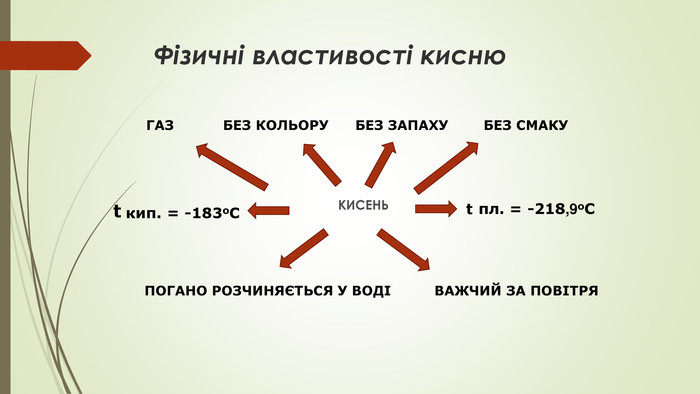
Оксиге́н або ки́сень (О) — хімічний елемент головної підгрупи 6 групи періодичної системи групи з атомним номером 8, простими речовинами якого є гази кисень (O2) та озон (O3). Термін «оксиген» в українській мові є неологізмом, запровадженим у 90-х роках ХХ ст. в рамках реформи хімічної термінології — до того часу єдиною назвою як хімічного елемента, так і найпоширенішої його простої речовини було слово «кисень». Проте, в наш час рекомендується використовувати слово «кисень» лише на позначення простої речовини, а «оксиген» — лише на позначення хімічного елемента.
Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку