Презентація з теми: "Етанова (оцтова) кислота"



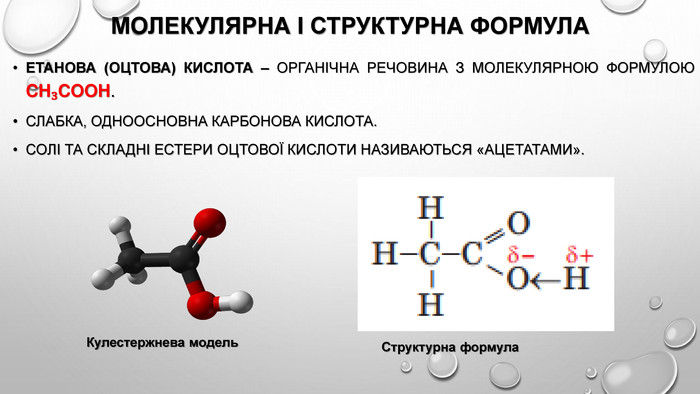



















Фізичні властивості Етанова (оцтова) кислота – безбарвна рідина, з характерним запахом, летка, кисла на смак. Змішується з багатьма розчинниками. Густина етанової кислоти за звичайних умов — 1,05 г/см3, вона трохи важча за воду;Температура плавлення становить 16,6 °С;Температура кипіння – 181,1 °С.
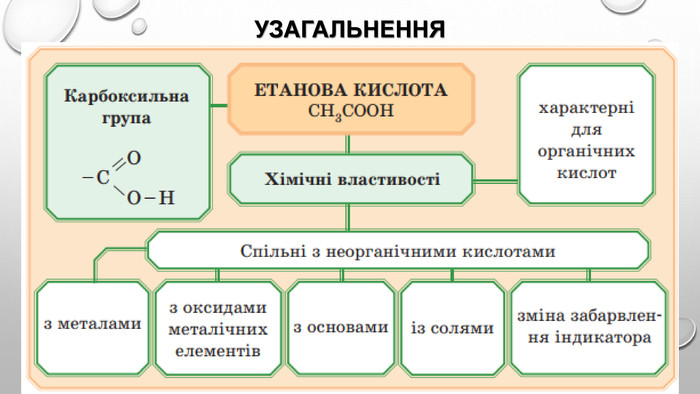
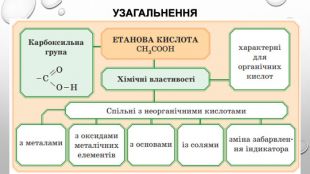
Хімічні властивості 1. Електролітична дисоціація: Оцтова кислота має всі властивості карбонових кислот. Зв'язок між Гідрогеном і Оксигеном, карбоксильної групи (–COOH) карбонової кислоти є сильно полярним, внаслідок чого ці сполуки здатні легко дисоціювати та проявляюти кислотні властивості.2. Дія на індикатори: Оцтова кислота – слабкий електроліт. Зміна забарвлення індикаторів у кислому середовищі оцтової кислоти: метилоранжевий - рожевий лакмус - червоний
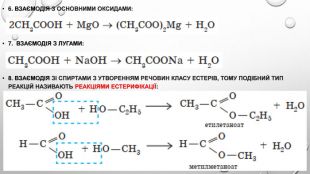
3. Взаємодія з металами: Зверніть увагу на особливість написання формул солей органічних кислот. Спочатку записують аніони, а потім — катіони: (CH3 COO)2 Zn. 4. Взаємодія з лугами: 5. Взаємодія з деякими солями слабких кислот: отже, етанова кислота сильніша за карбонатну, а тому руйнує карбонати.
Це цікаво. Карбонові кислоти доволі поширені в природі. Так, метанова (мурашина) кислота HCOOH виробляється залозами мурашок, бджіл, медуз, міститься в жалких (пляшкоподібних) клітинах кропиви, у хвої, фруктах. Мурахи стріляють кислотою в повітря, відлякуючи хижаків (таких як дятел чи сойка). Кислота при потраплянні на шкіру рук не викликає печіння, але має сильний запах, що нагадує оцтову есенцію.
Це цікаво. Етанова (оцтова) кислота міститься в кислому молоці. Бутанова (масляна) кислота з’являється в прогірклому вершковому маслі. Двохоснóвна щавлева кислота HOOC–COOH міститься в щавлі, ревені. Оксикарбонова (має, крім карбоксильної, ще й гідроксильну групу) молочна кислота СН3–СН(ОН)–СООН міститься в кислому молоці, сирі, квашеній капусті, силосі, з’являється у м’язах під час їх перевантаження (як продукт неповного окиснення). трьохоснóвна оксикарбонова лимонна кислота C6 H8 O7 міститься у хвої, багатьох фруктах і ягодах (більше у недозрілих). У Стародавньому Римі випарювали виноградний (іноді скислий) сік, отримуючи солодкий густий напій дефру́тум (са́пу). Оскільки тоді користувались свинцевими котлами, побічним продуктом був так званий свинцевий цукор — солодкийна смак, але дуже отруйний (як і всі сполуки Плюмбуму) плюмбум(ІІ) етаноат(CH3 COO)2 Pb. Так римські аристократи істотно вкорочували собі життя, ласуючи цим напоєм.
Узагальнення1. Які сполуки називають карбоновими кислотами? Чим молекула карбонової кислоти відрізняється від молекули спирту?2. Знайдіть формулу карбонової кислоти, якщо її молярна маса така сама, що й етанолу. Чи відповідає ця кислота визначенню карбонових кислот?3. Поясніть, як і завдяки чому молекула оцтової кислоти дисоціює у водному розчині.4. Чому оцтова кислота не виявляє основних властивостей, хоча її формула містить групу ОН, як і формула натрій гідроксиду?5. Складіть рівняння реакцій і дайте назви їхнім продуктам:6. Відносна формульна маса солі оцтової кислоти становить 142. Визначте формулу цієї солі й назвіть сполуку.
7. Наведіть по два молекулярні рівняння, які відповідають таким йонно-молекулярним рівнянням:8. Обчисліть масову частку оцтової кислоти в розчині, який утворився:а) при змішуванні однакових кількостей речовини кислоти і води;б) при додаванні 20 г кислоти до 200 г 20%-го її розчину;в) при додаванні 100 г води до 200 г 20%-го розчину кислоти. 9. Обчисліть масу розчину калій гідроксиду з масовою часткою лугу 32%, який витратили на нейтралізацію 50 г розчину оцтової кислоти з масовою часткою кислоти 12%. 10. Які маси оцтової есенції та води потрібно взяти для приготування 160 г столового оцту — розчину оцтової кислоти з масовою часткою кислоти 9%? Візьміть до уваги, що оцтова есенція є розчином, який містить 80% оцтової кислоти за масою. 11. Кальцій карбонат — основний компонент накипу в чайнику. Для очищення чайнику від накипу його залили столовим оцтом. Після закінчення хімічної реакції виділився газ об’ємом 336 мл. Обчисліть масу накипу, що була в чайнику.


про публікацію авторської розробки
Додати розробку























-

Юсин Надія Улянівна
31.03.2024 в 19:32
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Чоп Наталя
21.03.2024 в 08:13
Шикарна презентація! Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дунаєвська Тетяна Іванівна
10.05.2023 в 00:02
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Купріян Елеонора
08.03.2023 в 21:41
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дробот Олена Геннадіївна
13.02.2022 в 14:41
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 2 відгука