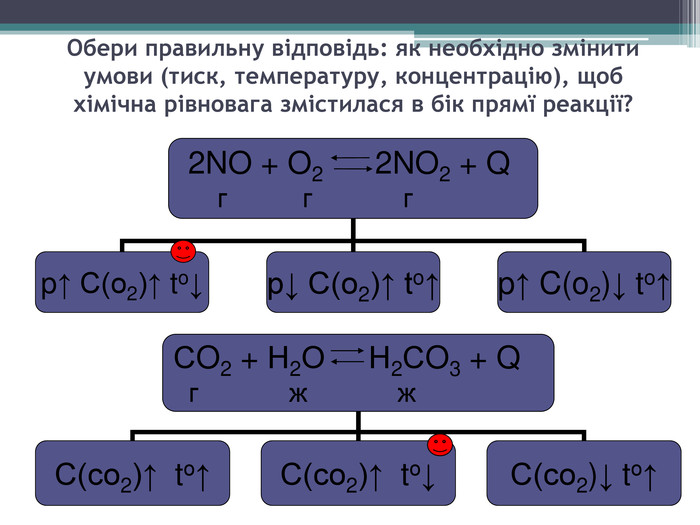
Презентація з теми: "Хімічна рівновага. Принцип Ле Шательє"
Про матеріал
Презентація у стислому вигляді розглядає основні поняття з теми. Має розділ актуалізації опорних знань, розділ пояснення нової теми та
розділ на закріплення - тренувальні вправи. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
ppt
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку













![Константа рівноваги (Kp) aA + bB dD + fF [D]d . [F]f Kp = ----------- [A]a . [B]b де: [A], [B], [D], [F] – рівноважні концентрації речовин, які беруть участь в реакції Константа рівноваги (Kp) aA + bB dD + fF [D]d . [F]f Kp = ----------- [A]a . [B]b де: [A], [B], [D], [F] – рівноважні концентрації речовин, які беруть участь в реакції](/uploads/files/150781/258547/280373_images/13.jpg)