Презентація з теми: "Кількість речовини"












































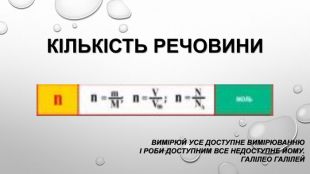
кількість речовини — фізична величина Майже все, що людина бачить навколо себе, вона намагається описати кількісними характеристиками. Так, коли ми витрачаємо воду, ми обчислюємо її об’єм: скільки літрів (або кубометрів) її витекло з крану. Купуючи цукерки, ми вказуємо продавцеві їхню масу: скільки грамів треба зважити. Але в певних випадках знання маси або об’єму буде недостатнім. Наприклад, нам потрібно купити стільки яблук, щоб вистачило на всіх учнів у школі. Досить складно на ринку перераховувати понад триста яблук. Значно простішим буде порахувати число ящиків яблук (за умови, що ми знаємо, скільки яблук міститься в одному ящику). Тобто в цьому випадку ми рахуємо не окремі частинки, а число груп (порцій) частинок. Для розуміння хімічних явищ і процесів не завжди потрібно знати масу чи об’єм речовини. Часто для визначення кількості речовини набагато важливіше знати число атомів чи молекул, наприклад, під час складання рівняння хімічних реакцій. Для визначення числа частинок використовують спеціальну фізичну величину — кількість речовини. Її позначають латинською буквою . Вона показує, скільки частинок (структурних одиниць) речовини міститься в тому чи іншому зразку. Для речовин молекулярної будови такими частинками є молекули, а для речовин немолекулярної будови такими частинками можуть бути атоми або йони.
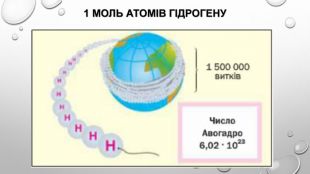
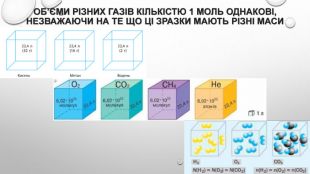
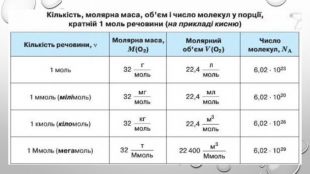
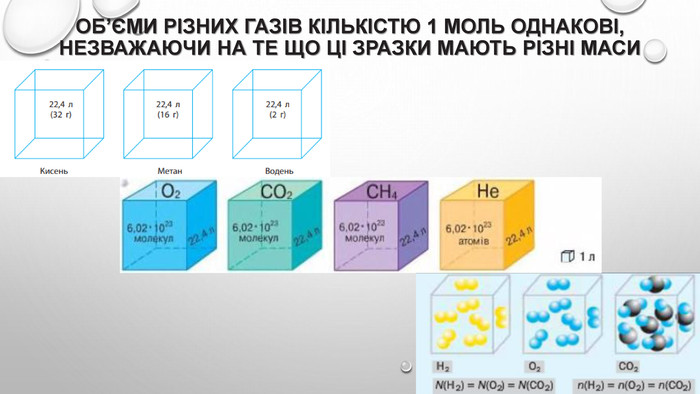
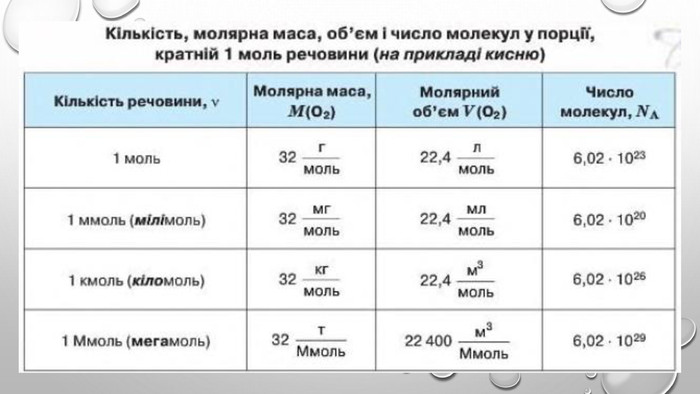
Моль — одиниця вимірювання кількості речовини Атоми й молекули дуже малі, тому недивно, що їх число в навколишньому світі величезне. Навіть у найменшому кристалі цукру число молекул перевищує мільярд мільярдів. Тому практично неможливо перераховувати окремі молекули. Для вимірювання кількості речовини використовують спеціальну одиницю — моль. До кількості речовини слід ставитися як до звичайного числа, що дозволяє виразити число атомів або молекул у певній порції речовини. У тому, що один моль речовини містить таке «екзотичне» число частинок, немає нічого незвичайного. Подібні числа (або порції) нам трапляються досить часто, і використовуємо ми їх для вимірювання маси, об’єму, часу й навіть грошей. Більшість з них є досить простими числами. Наприклад, одна тонна — це одна тисяча кілограмів, один кубічний метр — це одна тисяча літрів, одна година — це 60 хвилин, одна гривня — це сто копійок. Існують також величини вимірювання, що не кратні десяти: одна доба — це 24 години, одна дюжина — це 12 штук, один карат — це 0,2 грама. У кожної речовини є власні структурні одиниці. Наприклад, вугілля складається з атомів Карбону, а сірка — з молекул S8. Тому зразки різних речовин кількістю речовини 1 моль мають різні маси та об’єми.
Число авогадро Число називають числом Авогадро на честь італійського вченого Амедео Авогадро (1776-1856). Чому саме таке число було обране для визначення моля речовини? Справа в тому, що стільки атомів міститься у зразку вуглецю масою 12 г, що в сучасній науці використовують як стандарт для визначення атомної одиниці маси. Ураховуючи це, можна дати ще одне визначення моля:
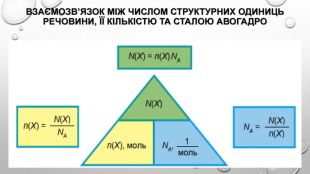
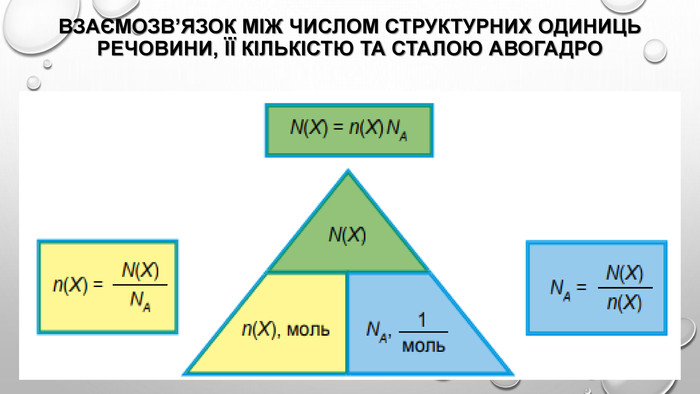
Розв’язання задач з використанням кількості речовини Знаючи сталу Авогадро, можна будь-яку кількість речовини виразити в молях. Якщо речовина містить N молекул (або структурних одиниць), то кількість речовини дорівнює: Навпаки, знаючи кількість речовини в молях, можна обчислити число частинок:
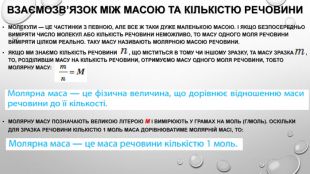
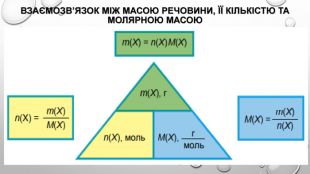
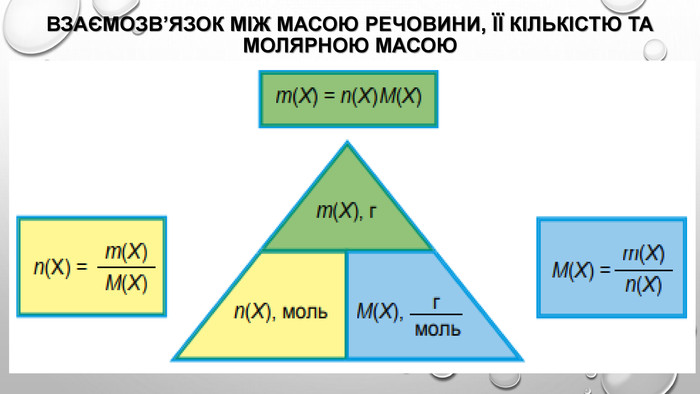
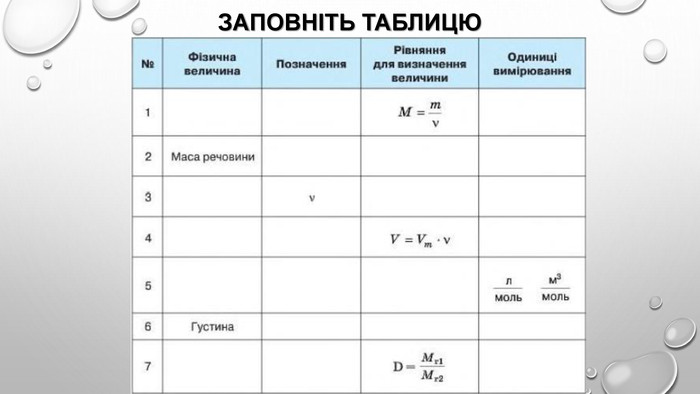
взаємозв’язок між масою та кількістю речовини Молекули — це частинки з певною, але все ж таки дуже маленькою масою. І якщо безпосередньо виміряти число молекул або кількість речовини неможливо, то масу одного моля речовини виміряти цілком реально. Таку масу називають молярною масою речовини. Якщо ми знаємо кількість речовини , що міститься в тому чи іншому зразку, та масу зразка , то, розділивши масу на кількість речовини, отримуємо масу одного моля речовини, тобто молярну масу: Молярну масу позначають великою літерою М і вимірюють у грамах на моль (г/моль). Оскільки для зразка речовини кількістю 1 моль маса дорівнюватиме молярній масі, то:
визначення молярної маси речовини Молярна маса М, виражена в г/моль, чисельно дорівнює відносній молекулярній масі . Для простих речовин атомної будови молярна маса чисельно дорівнює відносній атомній масі. Хоча молярна маса М і відносна молекулярна маса мають однакові чисельні значення, між ними є дві суттєві розбіжності:• молярна маса характеризує масу одного моля речовини, тоді як відносна молекулярна маса — масу однієї молекули;• молярна маса не є відносною величиною й, на відміну від відносної молекулярної маси, має одиницю вимірювання — г/моль. Різні речовини складаються з різних молекул, які мають різні маси. Отже, якщо взяти різні речовини в кількості 1 моль, легко помітити, що вони мають різну масу й займають різний об’єм.чим більша маса однієї молекули, тим більша молярна маса речовини.
Розрахунки з використанням молярної маси Для того щоб обчислити кількість речовини, достатньо знати масу m цієї речовини та її молярну масу М: За цією формулою можна обчислити масу речовини в грамах: Нарешті, якщо відомі й маса, і кількість речовини, то можна визначити її молярну масу: Усі ці формули використовують для хімічних розрахунків.
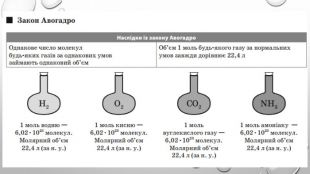
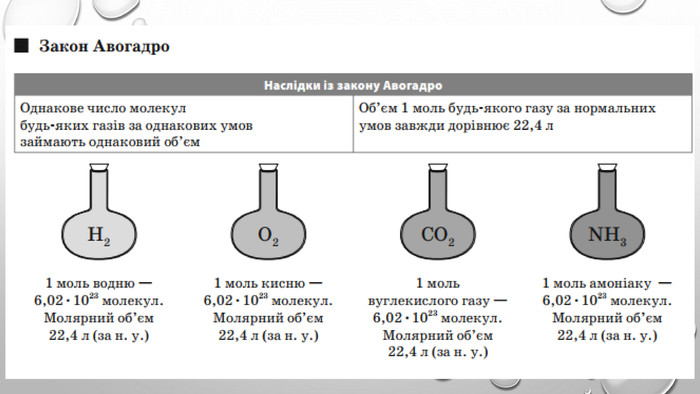
Закон авогадро У 1814 р., виконуючи численні хімічні експерименти з газуватими речовинами, італійський учений Амедео Авогадро дійшов висновку, який сьогодні називають законом Авогадро: На підставі чого можна зробити такий висновок? Здійснюючи реакцію між воднем і киснем, Авогадро помітив, що об’єм водню, який вступає в реакцію, завжди у два рази більший, ніж об’єм кисню. За рівнянням реакції: 2 H2 + O2 = 2 H2 O видно, що на одну молекулу кисню в реакції витрачається дві молекули водню. Якщо молекул водню реагує у два рази більше, ніж молекул кисню, і об’єм водню у два рази більший, ніж об’єм кисню, то в однакових об’ємах має міститися однакове число молекул.
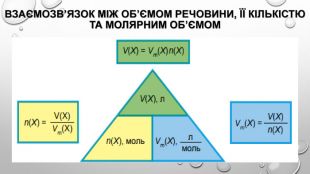
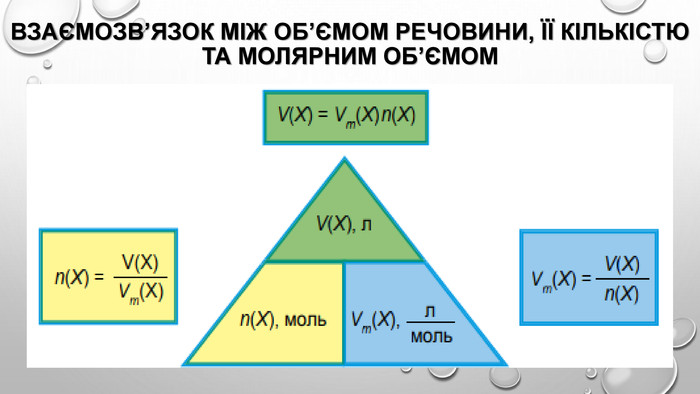
Молярний об’єм газів Знаючи, що один моль будь-якої речовини містить певне число молекул, можна зробити висновок про те, що всі гази кількістю 1 моль за однакових умов займають однаковий об’єм. За аналогією з молярною масою об’єм одного моля речовини називають молярним об’ємом. Молярний об’єм виражають у літрах на моль (л/моль). Значення молярного об’єму газу залежить від температури й тиску. У хімії прийнято наводити значення молярного об’єму за нормального атмосферного тиску (760 мм рт. ст. або 101 325 Па) й температури 0 °С — такі умови називають нормальними (скорочено н. у.). За нормальних умов молярний об’єм будь-якого газу дорівнює приблизно 22,4 л / моль. За кімнатної температури (25 °С) й атмосферного тиску (такі умови називають стандартними) молярний об’єм газів трохи більший: = 24,4 л / моль.
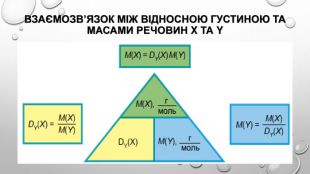
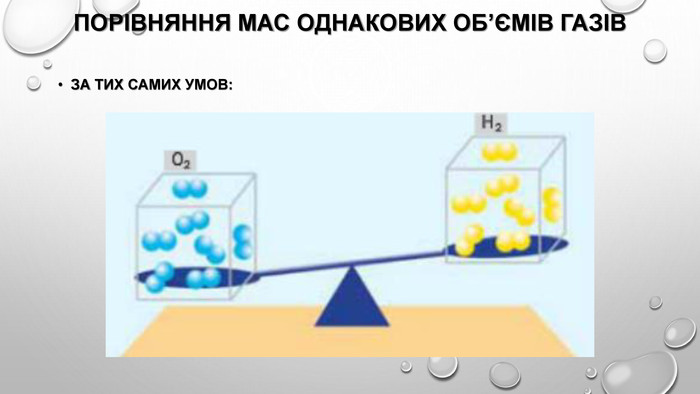
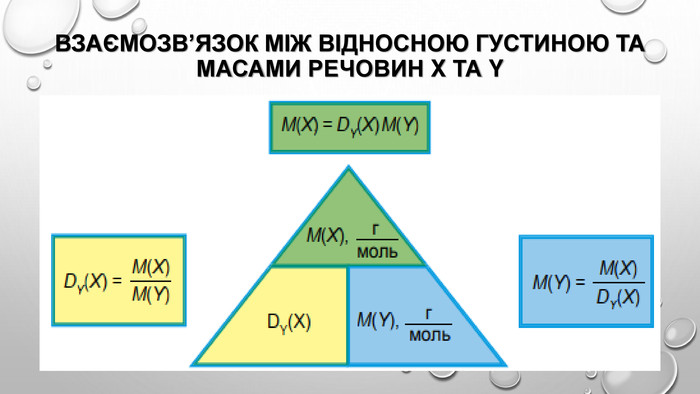
відносна густина газів Густина газів дуже невелика, тому вимірювати маси газуватих речовин дуже незручно. Набагато зручніше порівнювати густини газів, тобто визначати відношення їхніх густин. Цю величину називають відносною густиною газу В за газом А і позначають DA(B). Методику експериментального визначення відносної густини газів розробив французький хімік Жан Дюма (1800-1884) й за допомогою цього методу визначав молекулярні маси невідомих газуватих речовин. Це можливо завдяки тому, що відносна густина газів дорівнює як відношенню густин газуватих речовин, так і відношенню їхніх молярних мас:
Оскільки відносна густина є відношенням двох величин з однаковою розмірністю, то сама відносна густина є безрозмірною величиною. Для обчислення відносної густини газів за певним газом необхідно обчислити відношення молярних мас газів. Так, наприклад, відносна густина кисню за воднем дорівнюватиме: Відносну густину кисню за гелієм, азотом або повітрям обчислюють у такий самий спосіб. Для обчислення відносної густини за повітрям використовують середню молярну масу повітря, що дорівнює 29 г / моль.
Відносна густина показує, у скільки разів густина одного газу більша за густину іншого. Наприклад, якщо відносна густина вуглекислого газу за воднем дорівнює 22 (DH2 (CO2)) = 22 , це означає, що вуглекислий газ важчий за водень у 22 рази. А якщо відносна густина метану за киснем дорівнює 0,5 (DO2 (CH4)) = 0 5), це означає, що метан легший за кисень у два рази.
Розрахунки з використанням відносної густини газів З таблиці видно, що один газ важчий від іншого в стільки разів, у скільки важча його молярна маса. Відносну густину газу позначають літерою латинського алфавіту D («де»): За формулою визначення відносної густини можна отримати похідну:
-
 Велика Наталія Миколаївна 28.07.2023 в 11:15Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Велика Наталія Миколаївна 28.07.2023 в 11:15Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0 -
 Карук Виктория Сергіївна 15.01.2023 в 11:47Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Карук Виктория Сергіївна 15.01.2023 в 11:47Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0 -
 Воронівська Наталья Гуріївна 03.12.2022 в 19:45Дякую!Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Воронівська Наталья Гуріївна 03.12.2022 в 19:45Дякую!Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0


про публікацію авторської розробки
Додати розробку