Презентація "Загальна характеристика металів. Фізичні та хімічні властивості металів"





































Тема: Загальна характеристика металів за їх положенням у періодичній системі та будовою атома. Метали – прості речовини. Фізичні та хімічні властивості металів. Мета : Поглибити знання учнів про елементи – метали, їх положення в періодичній системі, особливості будови атомів , металічний зв'язок, про загальні хімічні властивості металів на основі ряду активності металів; виховувати самостійність та спостережливість учнів. розвивати навички складання рівнянь окисно – відновних реакцій та реакцій йонного обміну на прикладі хімічних властивостей металів; увагу та логічне мислення учнів;
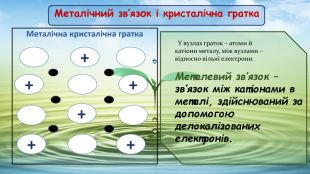
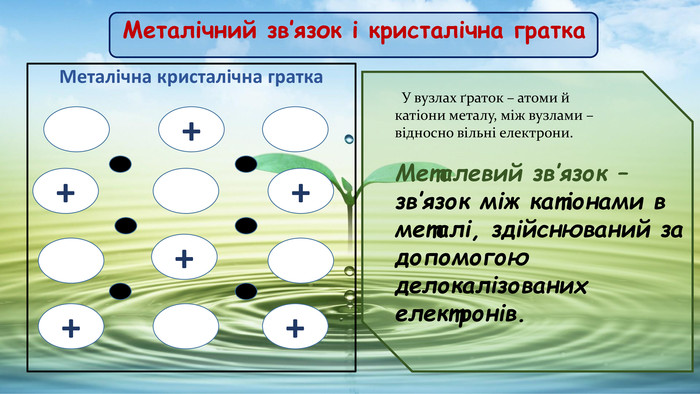
Обладнання : Періодична таблиця хімічних елементів Д.І. Менделєєва, ряд активності металів, таблиця розчинності, модель металічної кристалічної гратки, колекція металів. Тип уроку: Засвоєння нових знань. Базові поняття: Металічний зв'язок, металічна кристалічна гратка, електронегативність, ряд активності металів, електронегативність, окисник, відновник, електронний баланс
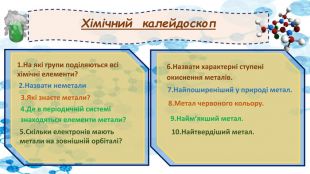
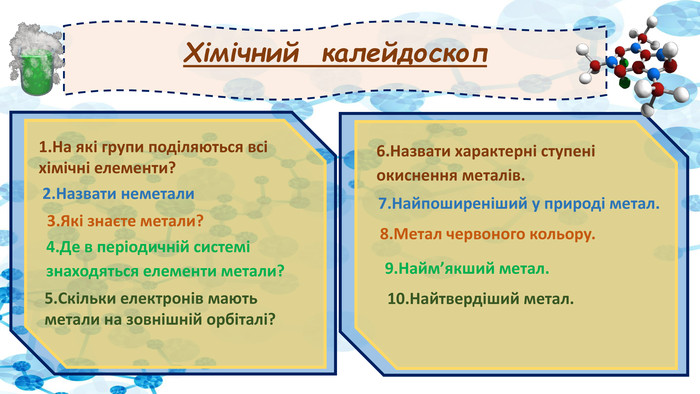
Хімічний калейдоскоп 1.На які групи поділяються всі хімічні елементи? 2.Назвати неметали 3.Які знаєте метали? 4.Де в періодичній системі знаходяться елементи метали? 5.Скільки електронів мають метали на зовнішній орбіталі? 6.Назвати характерні ступені окиснення металів. 7.Найпоширеніший у природі метал. 8.Метал червоного кольору. 9.Найм’якший метал. 10.Найтвердіший метал.
Всім відомо, без металу, Все на світі би стояло. Не літали літаки і космічні кораблі, Якщо б не було титану, - Цього міцного металу. Алюміній, цинк, синець, Всі потрібні людям. Що ж це буде на Землі, Якщо їх не буде? Посуд зник тоді б у нас Не було б у нас прикрас З золота і срібла, Всі машини би стояли Не робили прилади, А корозія б давно зруйнувала металічні вироби.
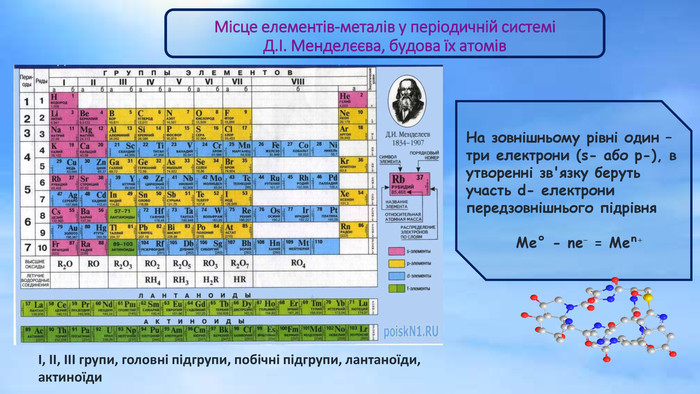
І, ІІ, ІІІ групи, головні підгрупи, побічні підгрупи, лантаноїди, актиноїди Місце елементів-металів у періодичній системі Д.І. Менделєєва, будова їх атомів На зовнішньому рівні один – три електрони (s- або p-), в утворенні зв'язку беруть участь d- електрони передзовнішнього підрівня Me° - ne⁻ = Meⁿ⁺
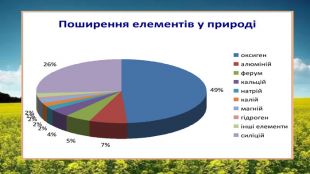
Благородних у вільному вигляді Ag, Pt, Au Середньої активності у вигляді оксидів і сульфідів Активних у вигляді солей Сульфідні руди: PbS, FeS2, MoS2, ZnS Хлоридні руди: NaCl, KCl, KCl∙NaCl∙MgCl2, KCl∙MgCl2∙6H2O Оксидні руди: Fe3O4, Al2O3, NiO, MoO3 Карбонатні руди: CaCO3, CaCO3∙MgCO3, FeCO3, Ca(HCO3)2 Знаходження металів у природі
Фізичні властивості металів. агрегатний стан ( тверді за н. у. , за винятком Hg); колір ( усі відтінки від світло- сірого до темно – сірого за винятком Аи і Си); тепло – і електропровідність ( за рахунок вільних електронів) збільшуються в ряду Hg, Рb, Fe, Zn, Мg, Al, Аи, Си, Аg; ковкість та пластичність ( найбільш пластичний метал – золото, найбільш крихкі – хром, манган, стибій) ; твердість; м'які ( лужні метали), тверді( хром) ; температура плавлення : легкоплавкі – Тпл ( Hg) = - 38, 87 0С, тугоплавкі – Тпл ( W) = 3370 0С. температура кипіння в металів висока.
Енергейзер Хімічний елемент - Мg 1. Якщо він метал - встаньте 2. Якщо він має порядковий номер - підніміть руки 3. Якщо він розміщений у малому періоді - опустіть руки 4. Якщо номер його групи ІІ - хлопніть 2 рази у долоні, 5.Якщо він розташований у головній підгрупі – сядьте Гра –естафета. Назвіть найменшу хімічно неподільну частинку речовини. (атом)
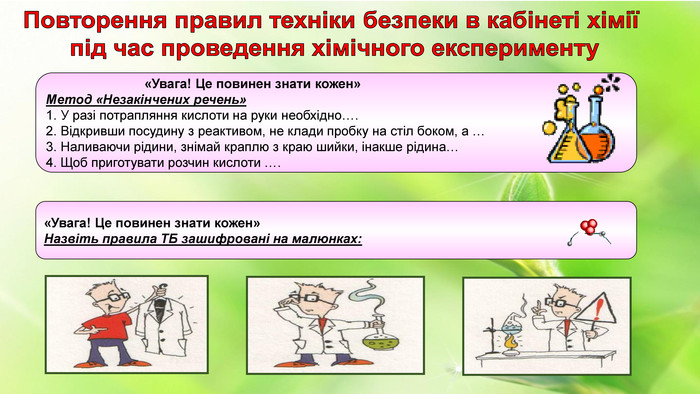
«Увага! Це повинен знати кожен» Метод «Незакінчених речень» 1. У разі потрапляння кислоти на руки необхідно…. 2. Відкривши посудину з реактивом, не клади пробку на стіл боком, а … 3. Наливаючи рідини, знімай краплю з краю шийки, інакше рідина… 4. Щоб приготувати розчин кислоти …. «Увага! Це повинен знати кожен» Назвіть правила ТБ зашифровані на малюнках:
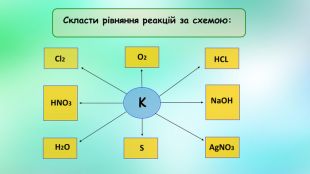
М.М.Бекетов ● Проблемне питання: Чому дівчати носять золоті чи срібні сережки виготовлені із золота чи срібла, а не з алюмінію чи заліза? 1865р. російський хімік М.М. Бекетов відкрив ряд активності металів (витискувальний ряд металів) K Na Mg Al Zn Fe Ni Sn Pb(H2)Cu Ag Hg Pt Au 2Al + 6HCl → 2AlCl3+ 3H2↑ Zn + 2HСl→ ZnCl2+ H2↑ Cu + HCl → Взаємодія між простою і складною речовинами внаслідок якої атоми простої речовини заміщують атоми у складній речовині називають реакцією заміщення.
Узагальнення та систематизація знань Підготовка до ЗНО І. Визначте правильні твердження 1. Протонне число калію 19 2. Протонне число натрію 23 3. Протонне число калію 39 4. Протонне число натрію 11 Варіанти відповідей А) 2,4 Б) 2,3 В) 3,4 Г) 1,4 ІІ. Визначте протонне число елемента, атом якого на зовнішній електронній оболонці містить 2 електрони А) 6 Б) 20 В) 13 Г) 16
Бліц – фініш 1. Перелічіть метали, що входять до складу організму людини. (Fe, Na, Ca. Zn та ін.) 2. Визначте зайвий елемент серед наведених: K, Al, Na, Ca. Поясніть. ( Al – метал має амфотерний характер, а інші – основний характер.) 3. Хто з видатних учених склав витискувальний ряд металів, який названо його іменем? (Бекетов) 4. Слово – срібло, а мовчання - … (золото) 5. Який елемент входить до складу гемоглобіну? (Ферум) 6. Яка речовина використовується і у літакобудуванні, і в обгортці шоколаду. (Алюміній) Бліц – фініш Бліц – фініш Бліц – фініш
Гра «Так чи ні» 1. Метали в періодичній системі містяться в лівій нижній частині. + 2. На зовнішньому енергетичному рівні металічних елементів містяться 4-6 електронів. – 3. Метали – тверді речовини. + 4. Причиною електро- і теплопровідності металів є наявність металічного хімічного зв’язку. + 5. Взаємодіючи з киснем, метали утворюють оксиди, пероксиди. + 6. Взаємодія металів із солями відбувається згідно з електрохімічним рядом напруг. +
-
 Велика Наталія Миколаївна 13.12.2022 в 19:57Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Велика Наталія Миколаївна 13.12.2022 в 19:57Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0 -
 Чуб Світлана 10.01.2022 в 16:24Урок дуже неестетично оформлений, у кричущому стилі, з недоречними анімаціями, які тільки захаращують слайди. Візьміть хоча б 1 урок дизайну в фахівцяЗагальна:3.0Структурованість3.0Оригінальність викладу2.0Відповідність темі4.0
Чуб Світлана 10.01.2022 в 16:24Урок дуже неестетично оформлений, у кричущому стилі, з недоречними анімаціями, які тільки захаращують слайди. Візьміть хоча б 1 урок дизайну в фахівцяЗагальна:3.0Структурованість3.0Оригінальність викладу2.0Відповідність темі4.0


про публікацію авторської розробки
Додати розробку