Презентація "Застосування та біологічна роль кисню. Колообіг Оксигену в природі. Озон. Проблема чистого повітря"
Про матеріал
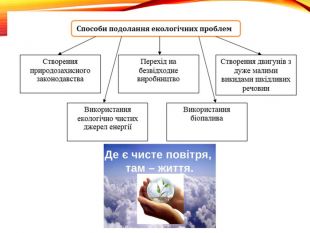
Презентація з теми: Застосування та біологічна роль кисню. Колообіг Оксигену в природі. Озон. Проблема чистого повітря. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку




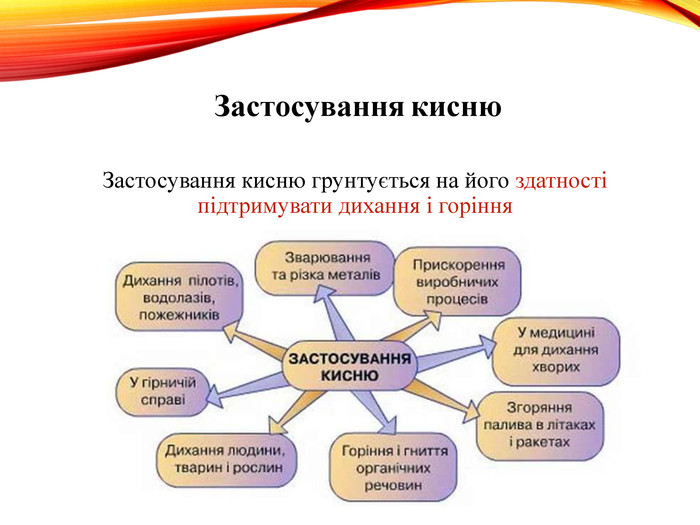
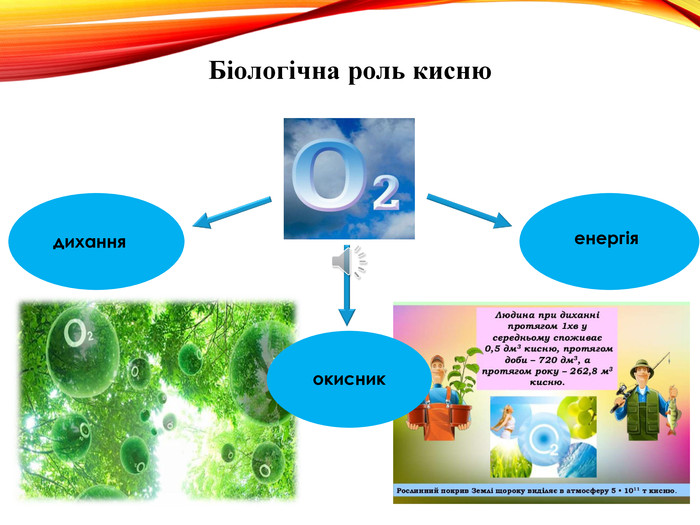
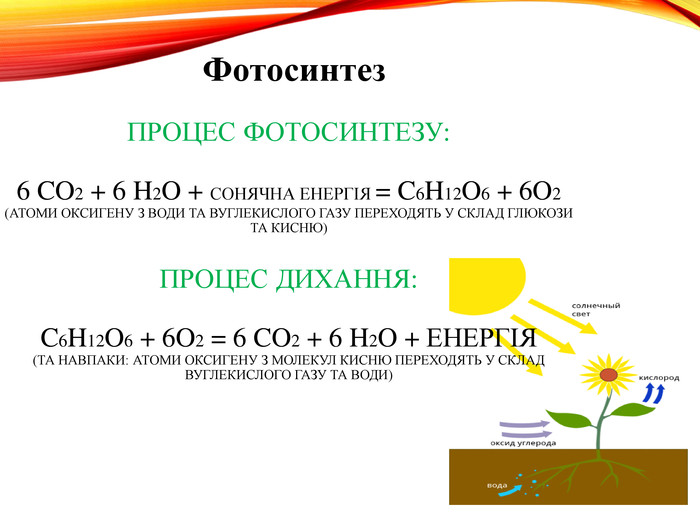
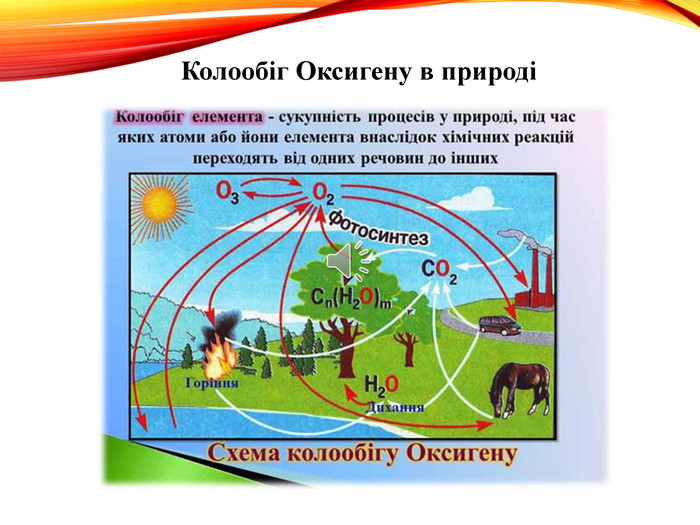





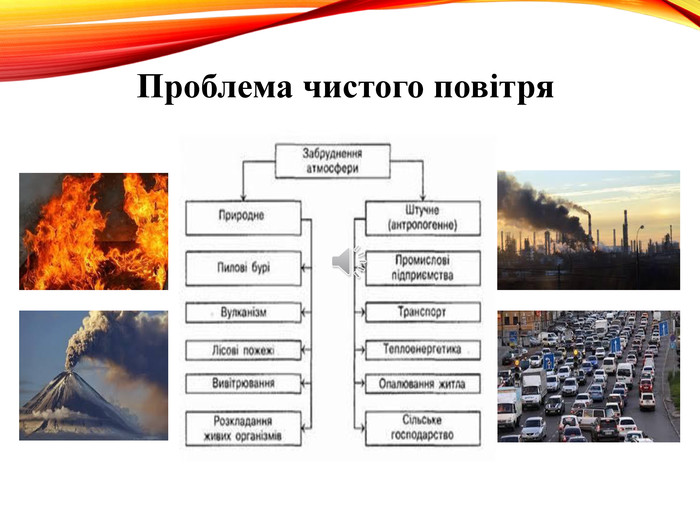
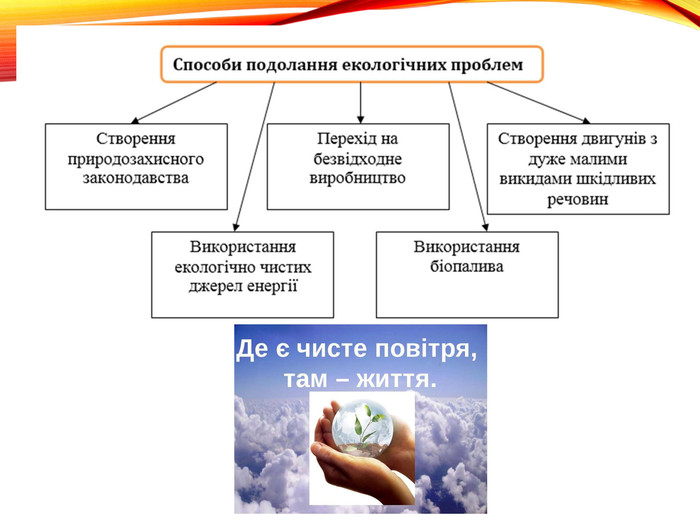





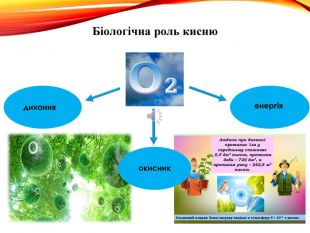

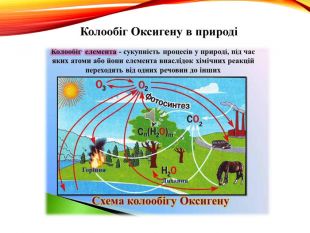







-

Поливана Діана
03.03.2024 в 12:40
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Воронівська Наталья Гуріївна
25.02.2023 в 16:11
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Костіна Неля Миколаївна
06.02.2023 в 10:33
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Самойдюк Наталія
15.03.2022 в 09:27
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Переверзєва Інна
10.02.2022 в 21:36
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Товстолес Лариса
03.02.2022 в 22:48
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 3 відгука