Презентація. Значення окисно-відновних реакцій у житті людини, природі й техніці.
Про матеріал
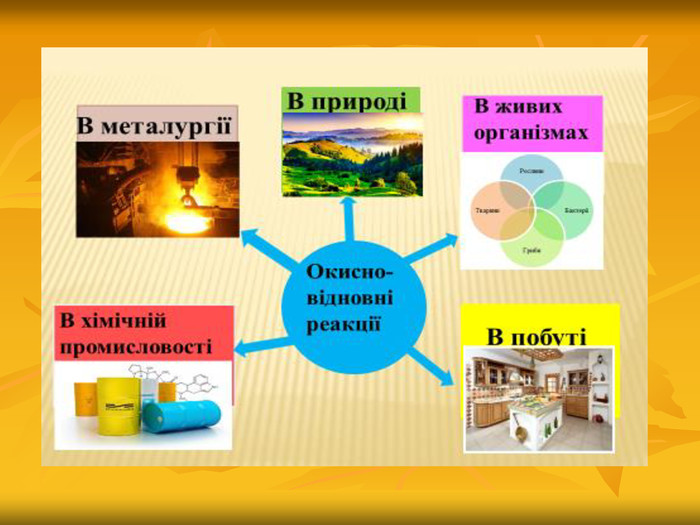
У презентації показано значення окисно-відновних рекцій у житті людини, природі, техніці. Наведенні приклади окисно-відновних рекцій які відбуваються у житті людини, природі, техніці.Використовуючи презентацію можна зробити урок цікавим, матеріал краще запам'ятовується. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку