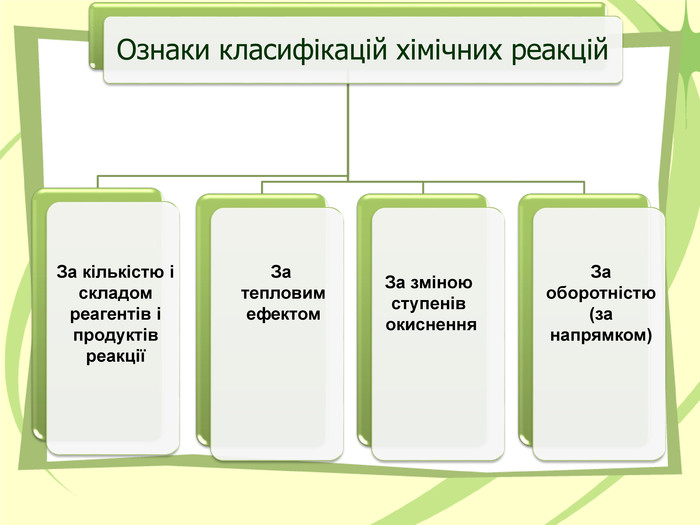
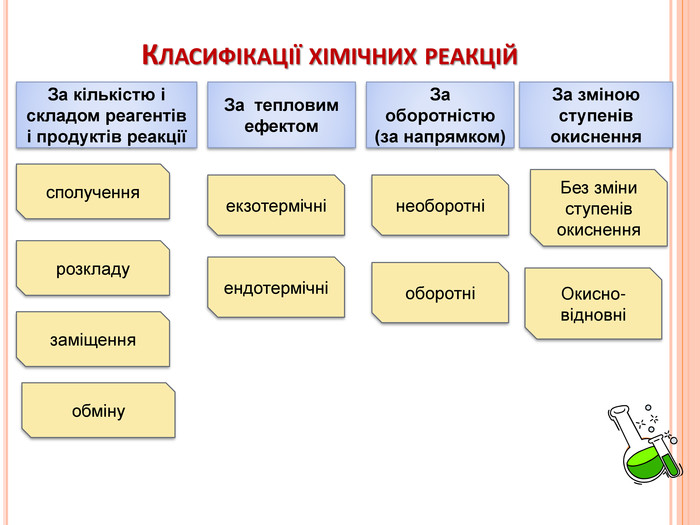
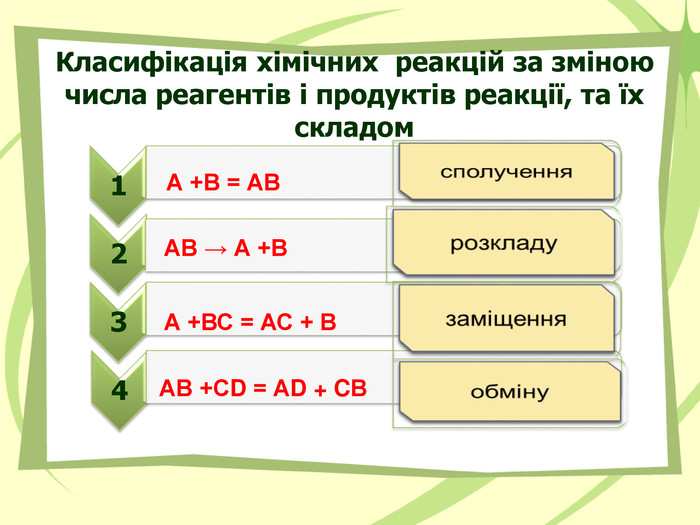
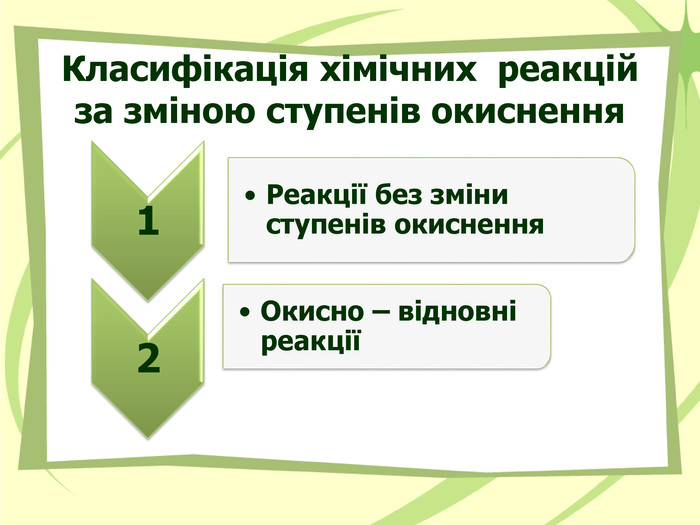
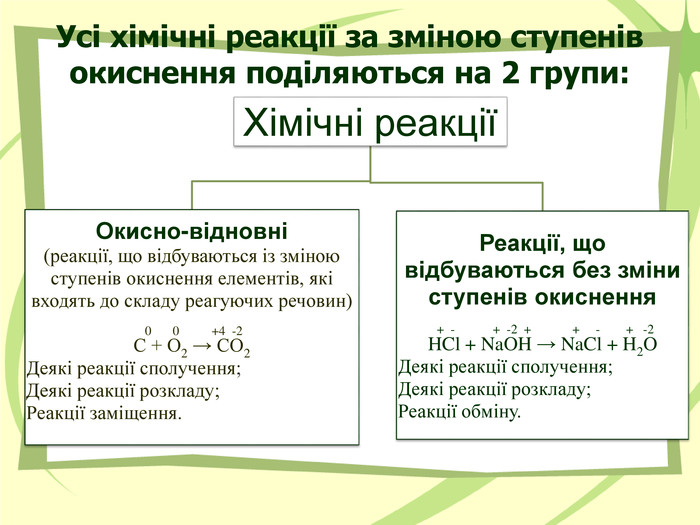
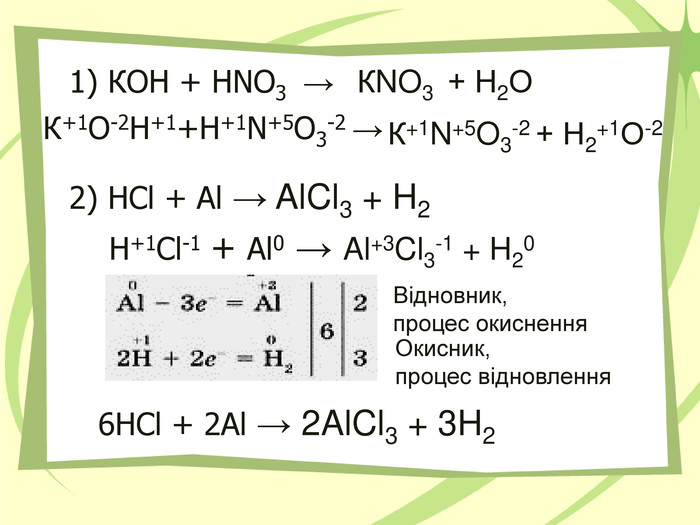
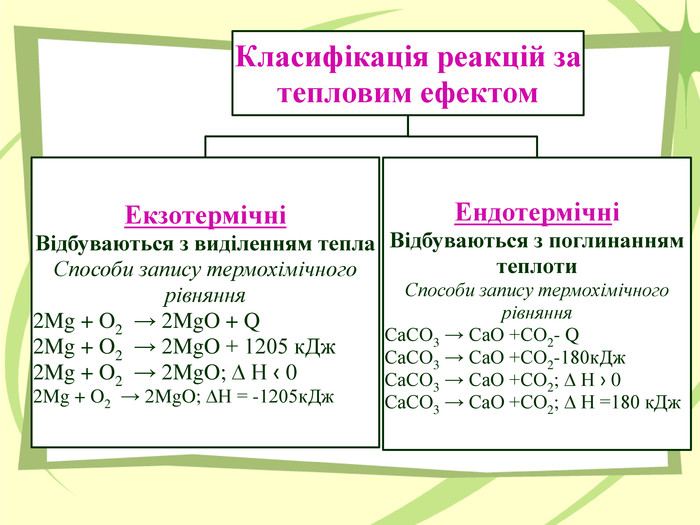
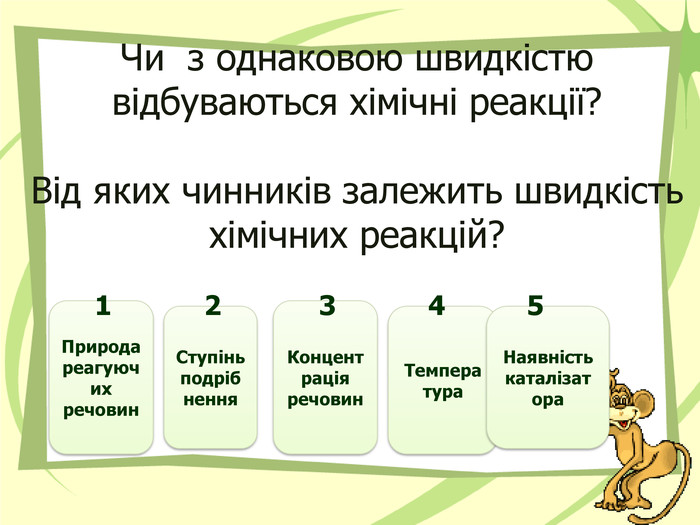
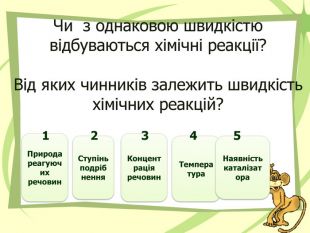
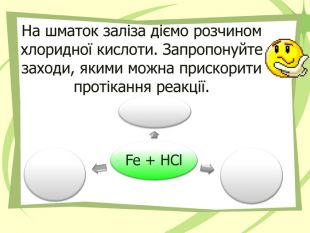
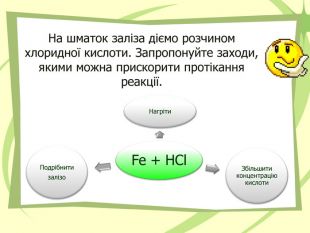
Презнтація на тему "Узагальнення й систематизація знань з теми “ Хімічні реакції ”
Про матеріал
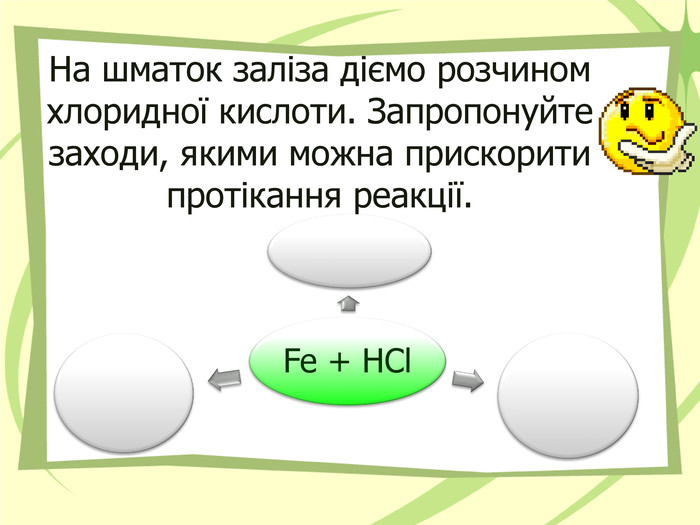
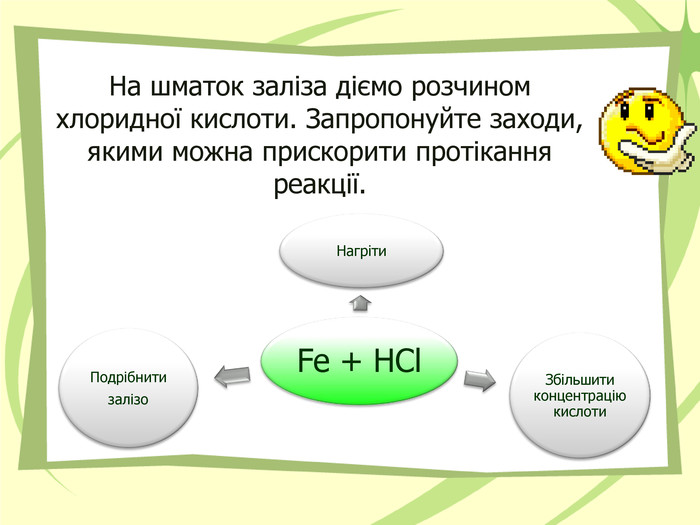
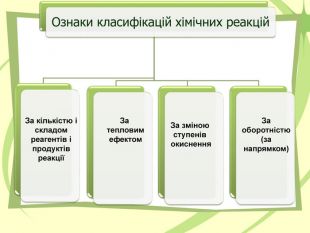
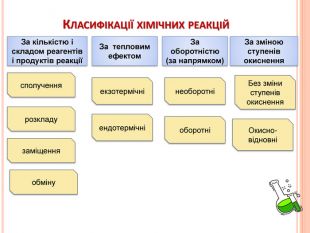
Презентація на тему "Узагальнення й систематизація знань з теми “ Хімічні реакції ” в 9 класі. Можна використати під час дистанційного начання. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку