ПРОЄКТ «Самостійна робота учнів на уроках хімії».
1
ПРОЄКТ
«Самостійна робота учнів на уроках хімії».
Виконала учитель хімії
Білозерської ЗОШ І-ІІІ ступенів№18
Цимбаленко О. М.
2023 р.
ЗМІСТ
РОЗДІЛ І. САМОСТІЙНА РОБОТА УЧНІВ У СИСТЕМІ МЕТОДІВ НАВЧАННІ ХІМІЇ
1.1. Поняття самостійна робота на уроці
1.2. Методи самостійної роботи учнів
РОЗДІЛ ІІ. ЗАСТОСУВАННЯ САМОСТІЙНОЇ РОБОТИ УЧНІВ НА УРОКАХ ХІМІЇ
2.1. Самостійна робота учнів під час вивчення нового матеріалу
2.2. Самостійна роботи при закріпленні знань та вмінь
2.3. Самостійна роботи учнів під час перевірки знань та вмінь
ВСТУП
Досягнення потрібного суспільству рівня освіченості, розвитку індивідуальності учня на основі виявлення його природних задатків і здібностей, інтелекту, формування ціннісних орієнтацій, неможливе без послідовної наполегливої самостійної праці, готовність до якої закладається у шкільному віці. Учень набуває знань лише в процесі особистої самостійної навчальної діяльності. Тому виникає необхідність будувати процес навчання, організацію та методику на уроці хімії так, щоб залучати учнів до самостійної творчої діяльності щодо засвоєння нових знань та успішному застосування їх на практиці.
Одне з пріоритетних завдань сучасної школи – це розвиток у школяра самостійності, здатності до самоорганізації, самовиховання, саморозвитку, самоосвіти. Навчальний предмет «Хімія» має потужний потенціал для організації самостійної діяльності школярів і розвитку в них засобами дисципліни знань, універсальних загальнонавчальних умінь, навичок дослідницької роботи, способів самоконтролю тощо.
Об’єктом дослідження є самостійна робота учнів. Предметом - особливості методів.
Мета курсового дослідження: виявити особливості методів самостійної роботи учнів на уроках хімії.
Реалізація зазначеної мети зумовила постановку наступних завдань:
- розкрити поняття «самостійна робота на уроці»;
- визначити методи самостійної роботи учнів;
- охарактеризувати застосування самостійної роботи учнів на уроках хімії.
Опрацьовані нами педагогічні джерела свідчать, що інтерес до організації самостійної роботи студентів зростає щороку. Дослідники цієї проблеми розглядають різні аспекти питання: дидактичні умови здійснення самостійної роботи учнів (З.І. Архангельський, В.А. Сластьонін), педагогічні умови управління й контролю самостійної роботи (Л.В. Клименко, Н.П. Краєвський), підходи до класифікації типів самостійних робіт (Е.Я. Голант, Б.П. Єсипов, В.П. Козаков, П.І. Підкасистий), формування самостійності як риси характеру (В.І. Осмоловський, Л.Г. Вяткін) та інші.
РОЗДІЛ І. САМОСТІЙНА РОБОТА УЧНІВ У СИСТЕМІ МЕТОДІВ НАВЧАННІ ХІМІЇ
1.1. Поняття самостійна робота на уроці
Самостійна робота учнів - одна з основоположних вимог сучасної педагогіки. Вона хвилює вчених з давніх часів. Ще давньогрецький вчений Сократ говорив про її здійсненні. Французький мислитель XVI століття Мішель Монтень [4] писав: «Я хотів би, щоб вихователь вашого сина з самого початку, погодившись з душевними схильностями довіреної йому дитини, представив йому можливість вільно виявляти свої схильності, пропонуючи йому зазнати смак різних речей, вибирати між ними і розрізняти їх самостійно, іноді вказуючи йому шлях,іноді, навпаки, дозволяючи відшукувати дорогу йому самому» [17, с. 192].
До цієї теми зверталися такі вчені як Ж.Ж. Руссо, Ян Амос Коменський, К.Д. Ушинський та багато інших, приділяючи їй першорядну увагу.
Дуже важливим для нашого дослідження ми вважаємо зауваження К.Д. Ушинського про те, що дітям треба надати можливість самим шукати діяльність. Пізнавальна діяльність учнів,виникла за їх почином, може бути дуже плідною, і вчителю треба підтримувати її і допомагати дітям у кращому здійсненні їх задумів [24].
Як бачимо, класична педагогіка дала широке тлумачення самостійної роботи учнів.
Для вітчизняної та зарубіжної педагогіки проблема самостійної навчальної роботи навчаються і пов'язані з цим різні питання соціалізації професійної адаптації,учнів не є новою. Найбільш повне визначення самостійної роботи учнів дає відомий педагог Б.П. Єсіпов, який розглядає самостійну роботу учнів як з'єднання самостійної думки учнів з їх самостійним і фізичною дією. Воно виконується «без безпосередньої участі вчителя, але за його завданням у спеціально наданий час », при цьому учні прагнуть досягти поставленої в завданні мети« через свої розумові та фізичні зусилля [11].
«Самостійна робота, каже автор, допомагає підвищенню ефективності навчання як щодо розвитку оволодіння системою знань, умінь і навичок, так і щодо розвитку здібностей у розумовому та фізичному праці ».
Р.М. Мікельсон в під самостійною роботою розуміється «виконання учнями завдань без всякої допомоги, але під візуальним наглядом вчителя, який у разі труднощів може перейти до колективних вправ » [13, с. 112]. У даній роботі не розглядаються об'єктивно необхідні, на наш погляд, ланки самостійної роботи, такі як: з'ясування завдання і планування роботи, контроль за ходом і результатом її виконання, без яких неможливо домогтися бажаних результатів у навчанні. У дослідженнях І.М. Казанцева, В.П. Метеликові, І.Т. Федорченко вказується на необхідність встановлення певного часу на виконання завдання з обов'язковим проявом учнями самостійності і розумової напруги. Однак нічого не говориться про можливість керування цим процесом з боку викладача .
Під самостійною навчальною роботою розуміють будь-яку, організовану вчителем, активну діяльність учнів, спрямовану на виконання визначеної дидактичної мети в спеціально відведений для цього час: пошук знань, їх осмислення, закріплення, формування та розвиток умінь і навичок, узагальнення та систематизацію знань. Як дидактичне явище, самостійна робота, з одного боку, є навчальне завдання, яке повинен виконати учень, з другого – форма вияву відповідної діяльності: пам'яті, мислення, творчого відображення, поглиблення та розширення сфери дії раніше отриманих знань [9].
Результативність самостійної роботи учнів залежить і від рівня її організації, набуття учнями досвіду самоорганізації навчальної діяльності, формування в них «методики учнів» [10, с.33]. «Здійснення учнем самостійної роботи, – зазначає І.А. Зимня, – вимагає попереднього його навчання вчителем прийомів, форм та змісту цієї роботи» [10, с.120].
Таким чином, самостійна робота – це такий засіб навчання, який:
у кожній конкретній ситуації засвоєння відповідає конкретній дидактичній меті та завданням;
формує в учнів на кожному етапі їх руху від незнання до знань необхідний обсяг та рівень знань, навичок і умінь для розв'язання відповідного класу пізнавальних завдань, поступового просування від нижчих до вищих рівнів розумової діяльності;
сприяє виробленню в учнів психологічної готовності до самостійного систематичного поповнення своїх знань і вироблення умінь орієнтуватися в потоці наукової та суспільної інформації;
є найважливішим знаряддям педагогічного керівництва та управління самостійною пізнавальною діяльністю учня в процесі навчання.
Дослідження вчених-педагогів та психологів дозволяють встановити чотири рівні самостійної продуктивної діяльності учнів:
1. Копіюючі дії учнів за заданим зразком. Ідентифікація об'єктів та явищ, їх розпізнавання шляхом порівняння з відомим зразком. На цьому рівні здійснюється підготовка учнів до самостійної діяльності.
2. Репродуктивна діяльність, пов'язана з відтворенням інформації про різні властивості навчального об'єкта. На цьому рівні вже починається узагальнення прийомів та методів пізнавальної діяльності.
3. Продуктивна діяльність самостійного застосування набутих знань для вирішення завдань, які виходять за межі відомого зразка і потребує здатності до індуктивних та дедуктивних висновків.
4. Самостійна діяльність, що виявляється в переносі знань при вирішенні завдань в істотно нових ситуаціях, складанні нових програм прийняття рішень, виробленні гіпотетичного мислення. Завдання вчителя — довести якомога більше дітей до четвертого рівня самостійності.
1.2. Методи самостійної роботи учнів
У методиці навчання хімії в основу класифікації самостійних робіт покладаються такі ознаки:
- дидактична мета;
- тип пізнавальної діяльності;
- форма організації навчальної роботи учнів на уроці;
- джерела знань (засоби роботи).
На Рис.1 показані різноманітність і взаємозв’язок усіх видів самостійних робіт, що відрізняються за цими ознаками [9] :
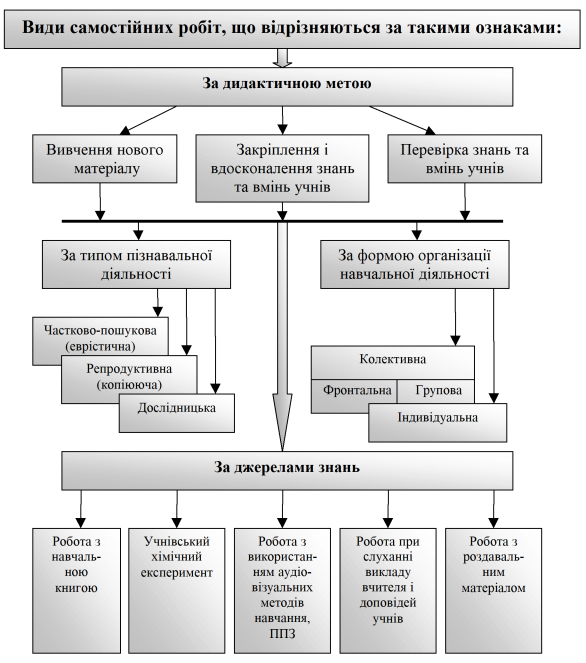 Рис. 1 Класифікація самостійних робіт учнів,
Рис. 1 Класифікація самостійних робіт учнів,
що використовуються на уроках хімії
Як видно з Рис.1 самостійні роботи реалізують такі головні дидактичні цілі: сприяють вивченню нового матеріалу, закріпленню і вдосконаленню знань і вмінь, перевірці результатів навчання. Тому за дидактичною метою усі види самостійних робіт можна поділити на три групи:
- вивчення нового матеріалу;
- закріплення і вдосконалення знань та вмінь учнів;
- перевірки знань та вмінь учнів.
На уроках хімії кожен тип самостійної роботи представлений різноманітністю видів робіт, що використовуються в системі урочних та позаурочних занять:
1. Робота з книжкою. Це робота з текстом та графічним матеріалом підручника: переказ основного змісту тексту; складання плану відповіді за прочитаним текстом; короткий конспект тексту; пошук відповіді на раніше поставлені до тексту завдання; аналіз, порівняння, узагальнення й систематизація матеріалу кількох параграфів. Робота з першоджерелами, довідниками, науково-популярною літературою, конспектування та реферування прочитаного.
2. Вправи: тренувальні, відтворюючі і за зразком, складання завдань та запитань і їх розв'язання, рецензування відповідей інших учнів, оцінка їх діяльності, вправи, спрямовані на вироблення практичних умінь та навичок.
3. Розв'язання різноманітних завдань та виконання практичних і
лабораторних робіт.
4. Різноманітні перевірочні самостійні роботи, контрольні роботи, диктанти, твори.
5. Підготовка доповідей та рефератів.
6. Виконання індивідуальних та групових завдань.
7. Домашні лабораторні досліди та спостереження.
8. Технічне моделювання та конструювання.
Більшість з перерахованих видів самостійних робіт може використовуватися на різних рівнях самостійної діяльності учнів, тобто віднесена до кожного з відзначених вище типів самостійних робіт. В розпорядженні ж творчо працюючого вчителя є великий арсенал різноманітних самостійних робіт для різних дидактичних завдань.
Будь-яка самостійна робота повинна починатися з усвідомлення учнем мети та способів дії. Від цього в значній мірі залежить ефективність всієї роботи. Спостереження за практикою організації самостійної роботи та аналіз результатів виконання учнями значної кількості таких робіт дозволяє виділити деякі недоліки в їх організації:
- відсутність системи в організації робіт, вони випадкові і за змістом, і за кількістю, і за формою;
- рівень пропонованої самостійності не відповідає навчальним можливостям учня; слабо виражений індивідуальний підхід у доборі завдань;
- самостійні роботи одноманітні, їх тривалість не є оптимальною для даного класу.
РОЗДІЛ ІІ. ЗАСТОСУВАННЯ САМОСТІЙНОЇ РОБОТИ УЧНІВ НА УРОКАХ ХІМІЇ
2.1. Самостійна робота учнів під час вивчення нового матеріалу
Роль інтегрованої літератури в процесі навчання велика, і в умовах стрімкого потоку інформації вона не знижується. Освоєння змісту освіти неможливо без підручника, в якому відображено сучасний рівень наукових знань, трансформований в робочі програми. Роль підручника велика, він є засіб освіти і джерело змісту освіти. В умовах, коли значимість самостійної освітньої діяльності як ніколи зросла, навчання має спиратися на активні форми оволодіння знаннями, такі як, наприклад, самостійна робота з навчальною літературою. Підручник з пасивного джерела інформації трансформувався в конструктивну, діючу дидактичну систему.
Йому відводиться роль формування особистісних якостей, мотиваційної сфери учнів, розкриття змісту навчального матеріалу, вироблення практичних умінь і навичок. Цілеспрямоване, мотивоване навчання учнів умінням самостійної роботи з підручником може стати одним з можливих шляхів для вирішення нагальних проблем освіти України. Володіння вміннями самостійної роботи з підручником забезпечить потребу і готовність індивіда до безперервної самоосвіти (Додаток А).
У навчальному процесі самостійної роботи учнів робота з підручником
є обов’язковою. Вона розвиває вміння складати план, вибираючи головне з прочитаного, дозволяє краще зрозуміти й запам’ятати зміст навчального матеріалу [12, с. 14].
При самостійній роботі з підручником на уроці є можливість тут же з’ясувати з допомогою вчителя незрозумілі моменти.
Під час організації самостійної роботи з підручником найважчим питанням є відбір навчального матеріалу. Ефективною діяльність є тоді, коли матеріал добре й доступно викладений, нескладний і не потребує наочного доведення, зв’язаний із вивченням промислових процесів, у ньому відсутні нові теоретичні поняття, він заснований на раніше здобутих знаннях.
Але незалежно від того, де вивчається матеріал — на уроці чи вдома, — важливо, щоб учні отримали конкретне завдання.
На уроці учитель повинен якнайширше використовувати дидактичні можливості підручника в спільній роботі з учнями, оскільки за допомогою книги можна виконувати інформативну, навчальну, розвивальну та виховну функції процесу навчання.
2.2. Самостійна роботи при закріпленні знань та вмінь
Для закріплення та вдосконалення знань і вмінь на уроках хімії учнями Біозерської ЗОШ І - III ступенів №18 були використані наступні методи:
1. Робота із навчальною літературою (Додаток Б)
Природно, що учень не може повністю оволодіти всією сумою знань лише на уроках, він мусить багато працювати самостійно в позаурочний час.
Під час виконання робіт учні використовують додаткову літературу, довідники тощо.
2. Учнівський хімічний експеримент (Додаток В, Додаток Д ).
Хімічний експеримент – це досліди, які учні самостійно виконують в умовах класу за завданням вчителя. Виходячи з означення цього поняття, можна зробити висновок, що хімічний експеримент – це один із видів самостійної роботи учнів. Підставами для цього є ознаки, які характеризують самостійну роботу учнів: а) наявність завдання; б) відведення часу для виконання; в) виконання учнями завдання; г) складання учнями звіту про виконану роботу [5, 15].
Навчальний експеримент з хімії — це не лише метод пізнання, а й метод навчання, розвитку і виховання учнів, який застосовується для досягнення різних цілей: повторення вивченого матеріалу, формування нових понять з хімії, прищеплення й закріплення знань і вмінь, перевірки їх засвоєння учнями. Крім того, навчальний експеримент організовують для розвитку логічного та діалектичного мислення учнів, їх інтересів, виховання ініціативи, творчої самостійності, акуратності, навичок роботи в колективі тощо.
Навчальний експеримент є значно складнішим, порівняно з іншими методами самостійної роботи, тому при його використанні учні витрачають більше часу і сил. Він завжди пов’язаний зі спостереженням, але має свої якісні відмінності.
Навчальний експеримент протікає в певній послідовності:
1) здійснюється спостереження за об’єктами, які підлягають дослідженню, виясняються їх зовнішні характерні ознаки та властивості;
2) формується гіпотеза або наукове припущення, що визначає мету експерименту, яку потрібно реалізувати й довести;
3) проводиться планування експерименту, що забезпечує умови, які дозволяють слідкувати за проходженням дослідження, намічають практичні дії досягнення мети (прийоми, фіксація отриманих результатів тощо);
4) експеримент виконується відповідно до плану;
5) отримані результати підтверджують або заперечують гіпотезу; остаточна перевірка гіпотези відбувається за допомогою широкої практики.
Хімічний експеримент допомагає учням більш свідомо засвоїти основи наукових знань з хімії, активізує їх пізнавальну діяльність сприяє формуванню вмінь самостійно здобувати знання, розвитку предметних компетенцій.
Хімічний експеримент виконує в навчанні хімії методологічну, освітню, виховну та розвивальну функції. Методологічна функція полягає в тому, що експеримент поглиблює знання учнів про загальнонаукові методи пізнання, зокрема, експериментальні [4]. Освітня функція полягає в тому, що за допомогою дослідів учні одержують інформацію про властивості речовин, перебіг хімічних реакцій. Виховна функція полягає в тому, що експеримент дає змогу розкрити низку світоглядних положень про пізнаваність хімічних явищ, роль практики в пізнанні тощо. Розвивальна функція виявляється в тому, що в процесі виконання домашніх дослідів в учнів розвиваються спостережливість, уміння аналізувати спостережувані явища, узагальнювати, робити висновки.
3. Робота з використанням візуальних методів навчання (Додаток В, Додаток Г).
До цих методів відносимо презентації учнів.
Учнівські презентації можна класифікувати за різними ознаками: за місцем в ході уроку(теми), за кількістю виконавців, за призначенням (для результатів дослідження, як результат учнівського проекту тощо )
За кількістю учасників учнівські презентації можна об’єднати у такі групи: :
1. Індивідуальні презентації. Кожен учень створює власну мультмедійну презентацію на запропоновану вчителем тему і виступає, супроводжуючи свою доповідь створенною презентацією. При такому виконанні роботи важливо передбачити для всіх учнів класуподібні, однакові за складністю, але різні завдання, які учні виконують самостійно.
Доцільно давати завдання та інструкції та вимоги щодо створення індивідуальних презентацій перед початком роботи учнів з презентаціями.
Небажаною є практика, коли одні учні класу виконують навчальне завдання, наприклад, з географії, а інші створюють мультимедійну презентацію на «чужому» дослідницькому матеріалі. Зараз ніхто не буде заперечувати, що всім учням незалежно від навчального предмету потрібні презентаційні навички, які складаються як з уміння створювати презентації, так і демонструвати результати досліджень та іншої самостійної роботи.
Неприпустимими також є випадки, коли презентацію роблять одні учні, а виступають з нею інші учні, які не брали участі ні в створенні, ні обговоренні мультимедійних ефектів презентації.
2. Парні презентації. Дуже ефективний, на наш погляд, спосіб представлення учнівської роботи. Переваги такої роботи: обидва учні – навчаються і створенню презентацій, і обговорюють результати, і пишуть висновки, і вчаться працювати в команді. Недоліки такої організації роботи учнів: не завжди можна знайти так багато подібних завдань для кожної пари; потрібно вислухати виступи всіх – а це потребує багато часу. Проте, можна організувати демонстрування презентацій пари, поділивши клас на групи для представлення результатів на різних комп’ютерах, хоча вчитель не може одночасно – оцінити і вислухати всіх, а це потребує формування в учнів навичок взаємного оцінювання за певними критеріями.
3. Групові презентації. Можливо об’єднати учнів в малі групи, коли презентація на одну задану тему готується всіма учасниками з розподілом окремих ролей та обговоренням спільного результату.
Слід враховувати деякі суттєві моменти при організації роботи учнів на груповими презентаціями:
· Кількість учасників. Найбільш ефективною з огляду на набуття учнями навичок та знань є мала група, яка налічує від 3 до 5 учнів.
· Розподіл ролей в групі. Якщо групова робота не є звичною для учнів, то варто почати з випадку, коли вчитель надає перелік можливих ролей в групі сам, або з допомогою учнів розподіляє ці ролі, враховуючи особливості учнів та їх бажання. З часом учні зможуть самі розподіляти обов’язки в малій групі. Важливо, щоб при кожній наступній роботі роль кожного учня була іншою для набуття і вдосконаленні різноманітних навичок.
Важливо дати зрозуміти учням, що вони всі відповідають за зміст презентації, її оформлення та презентування, але, в залежності від основної діяльності учнів, передбаченої перед створенням презентації, можна передбачити такі, наприклад, ролі: керівник групи, виступаючий, відповідальний за дизайн, за звуковий супровід, фотограф, той, хто слідкує за часом (хронометражист - таймкіпер).
Обов’язково слід на початку роботи групи ознайомити учнів з формами оцінювання як самої презентації, так і групової роботи під час створення і демонстрації презентації.
4. Класна презентація. Така презентація може бути підготовлена всім класом, коли презентація спочатку ретельно обговорюється, планується всіма учнями, а потім окремі слайди створюються окремими учасниками чи малими групами. Наприкінці такої роботи всі слайди об’єднуються в одну презентацію. З числа учасників обирається доповідач, або ж таку презентацію можуть представляти група доповідачів. Проте, важливо зауважити, що і в такій презентації небажана велика кількість слайдів незалежно від аудиторії, на яку вона розрахована.
4. Робота при слуханні викладу матеріалу вчителем (Додаток Б, Додаток В, Додаток Д).
5. Слухання доповідей учнів (Додаток Б , Додаток В, Додаток Д).
При формуванні навичок роботи з підручником велике значення має вивчення додаткової літератури, залучення учнів до читання науково-популярних книг і періодики з хімії, уміння знаходити потрібний матеріал в Інтернеті. Під час підготовки повідомлень саме здатність самостійно отримувати нові знання, орієнтуватися в потоці наукової та іншої інформації сприяє успіху. Прищеплювати ці вміння — завдання педагога.
На першому етапі підготовки повідомлень учням доречно буде скористатися пам’яткою.
6. Робота з роздавальним матеріалом (Додаток Д). Це звичайно - схеми, рисунки, графіки, таблиці тощо, тобто ті наочні форми, в яких можна стисло і ефектно представити текстовий матеріал.
Самостійні роботи частково-пошукового характеру спонукають учнів до цілком свідомої діяльності. Завдання для такого типу робіт дають учням можливість самим знайти шлях і спосіб розв’язання певної задачі на основі наявних знань. Наприклад, завданнями такого типу є поширений в практиці навчання вправи, що ґрунтуються на знанні генетичного взаємозв’язку і властивостей речовин, що вивчаються.
Залежно від характеру пізнавальної діяльності учнів самостійну роботу можна поділити на декілька типів:
1) репродуктивні, які містять завдання, що потребують установлення зв’язку пройденого матеріалу з новим;
2) пізнавально-наукові, які містять завдання з проблемними ситуаціями, завдання цього типу містять елементи дослідження;
3) Пізнавально-практичні, що передбачають складання таблиць, текстів, доповідей, тематичних словників тощо;
4) Творчі, тобто такі завдання, що потребують прояву самостійності мислення школярів.
2.3. Самостійна роботи учнів під час перевірки знань та вмінь
Для керування самостійною роботою вчителю слід спиратися на такі дидактичні засоби, як пам’ятки, питальники й картки (Додаток Д); використання взаємної перевірки (Додаток К).
Плануючи урок, учитель обов’язково має визначити завдання для самостійного опрацювання учнями, а також вибрати відповідну форму контролю. Це може бути самоконтроль з опорою на ключі, алгоритми, зразки, схеми тощо, або ж контроль з боку учителя.
Плануючи і проводячи самостійну роботу учнів, учитель може використати завдання з підручника або скласти свої.
Під час виконання учнями самостійної роботи на уроках керівна роль учителя не тільки не знижується, а, навпаки, підвищується. Він повинен постійно стежити за роботою учнів, направляти їх, попереджати неправильні дії, показувати прийоми скорішого виконання роботи, дбати про те, щоб уміння й навички, набуті учнями, були правильними, давати додаткові пояснення та вказівки, привчати учнів до самоконтролю.
Слід використовувати різні форми перевірки домашнього завдання:
• фронтальні;
• вибіркові;
• письмове опитування;
• тестування;
• хімічні диктанти.
Дуже важливою є самооцінка.
Результативність самостійної роботи студентів залежить від того, наскільки студенти зрозуміли цілі навчання, що були поставлені викладачем, наскільки правильно в змісті завдань відображена їх діяльність зі сприйняття та осмислення навчальної інформації, організації самоконтролю, а також від повноти критеріїв оцінювання знань. Систематичні та правильно організовані контроль і оцінка відіграють важливу роль в активізації самостійної роботи учнів.
Самостійна робота учнів у процесі вивчення хімії є основним засобом виявлення та розвитку в них творчих здібностей і обдарованості, підготовки дітей до практичної діяльності. Залежно від підготовленості учнів, учитель щоразу повинен сам визначати послідовність і насиченість самостійної роботи, проявити свою творчість та ініціативу. При переході учнів із класу в клас зростає рівень їх знань і пізнавальні можливості. У зв’язку з цим, і види самостійної роботи поступово ускладнюються.
Але потрібно пам’ятати, що самостійна робота — не самоціль, а один із засобів поліпшення навчально-виховного процесу, підготовки учнів до життя та практичної діяльності.
ВИСНОВКИ
Під самостійною навчальною роботою розуміють будь-яку, організовану вчителем, активну діяльність учнів, спрямовану на виконання визначеної дидактичної мети в спеціально відведений для цього час: пошук знань, їх осмислення, закріплення, формування та розвиток умінь і навичок, узагальнення та систематизацію знань.
Розвиток навичок самостійної роботи учнів на уроках хімії – важливий компонент навчально-виховного процесу.
Широке застосування самостійної роботи учнів на уроках хімії дає змогу успішно розв’язувати багато навчально-виховних завдань:
• підвищувати свідомість і міцність засвоєння знань учнями;
• учити користуватися набутими знаннями й уміннями в житті, у суспільно корисній праці;
• розвивати пізнавальні здібності, спостережливість, допитливість, логічне мислення, творчу активність під час засвоєння знань;
• прищеплювати дітям культуру розумової та фізичної праці;
• учити їх самостійно продуктивно та з інтересом працювати;
• готувати учнів до того, щоб вони могли ефективно працювати після закінчення школи.
Навчити учня вчитися, самостійно здобувати знання й удосконалювати навички та вміння – таке завдання стоїть перед кожним учителем. Для цього необхідно озброїти учня прийомами виконання завдань, виробити певні алгоритми опрацювання того чи іншого матеріалу, підготувати відповідні наочні посібники для кабінету, які були б завжди перед очима учнів.
Розвиваючий ефект самостійних робіт досягається тільки в тому випадку, коли вони використовуються різнопланово і в системі. Необхідно творче поєднання різних методів самостійних робіт. Виконання цієї вимоги можливе за рахунок організації такої системи навчання, яка передбачає і забезпечує систематичне включення учнів на уроках хімії у самостійну роботу, що вимагає прийняття мети як особистісно-значущої, аналізу умов пізнавальної задачі, моделювання способів її рішення, контролю та обговорення отриманих результатів.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- Алексеев Н.Г., Леонтович А.В., Обухов А.В., Фомина Л.Ф. Концепция развития исследовательской деятельности учащихся // Исследовательская работа школьников, 2002. - № 1. - С. 24-33.
- Ахметов, М.А. Индивидуально ориентированное обучение химии в общеобразовательной школе [Текст]: монография / М. А. Ахметов. – Ульяновск: УИПКПРО, 2009. – 260 с.
- Беликов А.А. Зксперимент на уроках химии.- К.: Рад. шк., 1988.- 150с.
- Буринська Н. М. Хімія Ірпінь: ВТФ «Перун», 2000. – 160с.
- Буряк В. Самостійна робота як системоутворюючий елемент навчальної діяльності студентів / В. Буряк // Вища школа. - 2008. – №5. – С. 10 – 24.
- Галузинська Н. Посилити роль хімічного експерименту // Біологія і хімія в шк. – 1998. – №3. – С. 27-29.
- Дитиняк Г. Я досліджую, експериментую, спостерігаю / Г. Дитиняк, Л. Андрушко, Н. Древня. – Львів: Літопис, 2003. – 140 с.
- Журин, А.А. Парадоксы обучения химии в современной школе [Текст] / А. А. Журин // Химия в школе. – 2007. – С.2-5.
- Зайченко І.B. Педагогіка. - К.: Освіта України, КНТ, 2008. – 528 с.
- Зимняя И.А. Педагогическая психология: Учебник для вузов. – М.: Логос, 2001.
- Есипов Б.П. Самостоятельная работа учащихся на уроке / Б.П. Есипов. — М.: Учпедгиз, 1961.— 212 с.
- Клімова В. Самостійна робота на уроках хімії. // Хімія: творча майстерня. – 2012. - № 4 (688). – С. 4-17.
- Ковтун Р.Н. Учебно-методическое обеспечение самостоятельной работы учащихся как средство повышения качества образования в техническом лицее. // Вісник СевДТУ. Вип. 90: Педагогіка: зб. наук. пр. — Севастополь: Вид-во СевНТУ, 2008. – С.112-116.
- Кузнецова, Л.М. Новая технология обучения химии. 8 класс [Текст]: методическое пособие для учителя / Л. М. Кузнецова – М. : Мнемозина, 2006. – 272 с.
- Малкин И.И. О классификации и рациональном сочетании видов самостоятельной работы учащихся на уроке // Вопросы развития познавательной активности и самостоятельности школьников. – Казань, 1966.
- Мартишок Г.В. Хімічний експеримент. Практикум: Навч. Посібник. -Рівне: Видавничий центр РДГУ, 2011.- 263с.
- Монтень М. Об искусстве жить достойно / М. Монтень. — М.: Просвещение, 1973. — 528 с.
- Найдан В.М., Грабовий А.К. Використання засобів навчання на уроках хімії:Посіб. Для вчителів .- К.: Рад. шк., 1988.- 70с.
- Пидкасистый П.И. Самостоятельная познавательная деятельность школьников в обучении: Теоретико-экспериментальное исследование. М.: Педагогика, 1980. – 240 с.
- Попель П. П., Крикля Л. С. Хімія 8 кл.: Підручник.- Київ.: ВЦ «Акедемія», 20088кл.: Підручик для серед. загальноосвіт. шк.. – 3-тє вид., випр.. і доп. Київ;
- Ризванов А.К. Хімічний експеримент у школі: Метод. Посібник. - Харків: Веста : Видавництво «Ранок», 2002.-128с.
- Русак Т., Попюк О. Технологія розвитку критичного мислення на уроках хімії // Хімія. – 2010. - № 30 (642). – с. 6.
- Савченко, О.Я. Розвиток пізнавальної самостійності молодших школярів [Текст] / О. Я. Савченко. – К. : Рад. шк., 1982. – 176 с.
- Ушинский К.Д. Собрание педагогических сочинений / К.Д. Ушинский. — М.: Педагогика, 1974.— 358 с.
- Черный А.Г. Психодидактика и творческое развитие личности / А.Г. Черный //Возрастная и педагогическая психология. – СПб: СПб ГУ, 2010. – С. 102-108.
- Ярошенко О.Г. Хімія: підручник для 8 класу загальноосвітнього навчального закладу. – К.: Освіта, 2008. – 208 c.
ДОДАТОК А
![]()
![]()
![]()
![]()
![]() Білозерська загальноосвітня школа
Білозерська загальноосвітня школа
І - III ступенів №18
Добропільської міської ради
Донецької області
Урок з хімії в 9 класі
Тема: «Швидкість хімічних реакцій»
Учитель хімії
Цимбаленко О.М.
2022 р.
Мета: Сформувати поняття про швидкість хімічної реакції; розглянути фактори, які впливають на швидкість хімічної реакції: природа реагуючих речовин, температура, концентрація, поверхню зіткнення реагуючих речовин, каталізатори та інгібітори.
Розвивати: Продовжити розвивати в учнів уміння пов'язувати вже отриманні знання із новою інформацією, новим матеріалом, вміння аналізувати та виділяти головне, основне у вивченому матеріалі.
Виховувати: Виховання відповідального ставлення учнів до навчання, прагнення до творчої, пізнавальної діяльності.
Тип уроку: вивчення нового матеріалу
Обладнання: комп’ютер, мультимедійний проектор, обладнання та реактиви для проведення хімічного експерименту в групах.
Мотивація: Як і всякі інші процеси, хімічні реакції відбуваються в часі і тому характеризуються тією чи іншою швидкістю. Розділ хімії, в якому вивчаються швидкості і механізми хімічних реакцій, називається хімічною кінетикою. Що таке швидкість хімічної реакції і чому швидкість різних реакцій не однакова, як можна збільшити або сповільнити швидкість реакції, як змістити рівновагу для оборотних реакцій - ось основні питання, на які нам належить дати відповідь.
Давайте згадаємо, що мається на увазі під швидкістю у фізиці?
(Це довжина шляху, пройденого фізичним тілом за одиницю часу. Ставлення пройденого шляху до одиниці часу).
Що змінюється в часі при механічному русі? (Координати тіла, отже, довжина шляху).
Швидкість якого процесу - це зміна якої фізичної величини за одиницю часу. Можливо, в понятті швидкості хімічної реакції є спільне з поняттям швидкості руху.
Тепер потрібно знайти величину, яка змінюється при протіканні хімічної реакції. Давайте подивимося на графік (слайд 4).
Що ми бачимо? З плином часу зменшується концентрація вихідних речовин, але збільшується концентрація продуктів.
Розрахувати швидкість можна по зміні концентрації або вихідних речовин, або продуктів. Формула буде виглядати наступним чином:
![]()
Якщо для розрахунку взято концентрація вихідних речовин, то ставиться знак «-», якщо продуктів, то «+».
Швидкість реакції вимірюється в моль / (л • сек).
Запишемо, швидкість реакції - це зміна концентрації одного з реагуючих речовин або продуктів реакції в одиницю часу.
Запишемо формулу для розрахунку швидкості хімічної реакції.
Щоб відповісти на наступне важливе питання: «які чинники впливають на швидкість хімічної реакції», ви сьогодні будете працювати єдиним колективом. Кожна група буде вивчати вплив окремого фактора на швидкість реакції і внесе свій внесок у вирішення даного питання. Щоб робота в групах була злагодженою, кожен буде виконувати свою роль. Ви самі оберете собі організатора, який керуватиме роботою групи, експериментатора, який здійснюватиме хімічний експеримент, теоретика, який грамотно проаналізує пройдений досвід, запише рівняння реакцій і сформулює висновок, доповідача, який викладе класу отримані вами результати, хронометриста, який стежитиме за тим, щоб ви вклалися у відведені вам тимчасові рамки. Щоб було видно внесок вашої групи у загальну справу, ми складемо загальний опорний конспект.
Перш ніж приступати до роботи, давайте згадаємо основні правила техніки безпеки. Так як ви сьогодні працюєте з обширним класом речовин, серед яких є підвищеної небезпеки - кислоти, то нагадайте, як слід працювати з такими речовинами? Які правила техніки безпеки повинні дотримуватися при роботі зі спиртівкою?
У вас на столах картки з інструкціями для виконання досвіду, а також картки з таблицями, в які ви вносите рівняння реакцій і де формулюєте висновок. Час на роботу 5-6 хвилин. Після цього ви виступаєте перед класом з результатами свого дослідження.
Група 1. Вплив природи реагуючих речовин.
У дві пробірки налийте по 1 мл сірчаної кислоти H2SO4. В одну пробірку додайте магній, в іншу - цинк. Спостерігайте відбуваються зміни. Запишіть рівняння реакцій.
Mg + H2SO4 = MgSO4 + H2
Zn + H2SO4 = ZnSO4 + H2
Висновок: швидкість реакції залежить від природи реагуючих речовин. Чим активніше речовина, тим швидше протікає реакція.
Учні, можна теоретично довести правильність зроблених висновків. Якщо ми подивимося в ряд активності металів, що побачимо, що магній стоїть лівіше, а значить він більш активний метал, ніж цинк.
Група 2. Вплив температури.
Лабораторний досвід. У дві пробірки помістіть на кінчику шпателя оксид міді (II) СuO і налийте в кожну по 1 мл соляної кислоти. Одну пробірку нагрійте. Спостерігайте за змінами. Запишіть рівняння реакції.
CuO + 2HCl = CuCl2 + H2O
Висновок: підвищення температури прискорює реакцію.
Група 3. Вплив концентрації речовини.
Лабораторний досвід. У дві пробірки помістіть по 1 гранулі цинку. В одну пробірку налийте сірчану кислоту (1:5), в іншу - (1:2). Спостерігайте за змінами, що відбуваються. Запишіть рівняння реакції.
Zn + H2SO4 = ZnSO4 + H2
Висновок: з підвищенням концентрації швидкість реакції зростає.
Група 4. Вплив поверхні зіткнення речовин.
Лабораторний досвід. У дві конічні колби помістіть соляну кислоту. У першу колбу киньте шматочок крейди, у другу - насипте порошок крейди. Спостерігайте за змінами
Запишіть рівняння реакції в молекулярному та іонному вигляді.
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
CO32- + 2H+ = CO2 + H2O
Висновок: із збільшенням поверхні зіткнення речовин швидкість збільшується.
Група 5. Вплив каталізатора.
Лабораторний досвід. У дві хімічних склянки налийте кілька мл пероксиду водню. В один стаканчик додайте подрібнену сиру картоплю, в іншій - варену. Спостерігайте за змінами.
Запишіть рівняння реакції.
2H2O2 = O2 + 2H2O
Висновок: є речовини, які прискорюють протікання реакцій - каталізатори.
Експеримент останньої групи дає нам можливість поміркувати над природою каталізатора. П'ята група використовувала біокаталізатор. Я покажу ефективність неорганічного каталізатора. Як і представник останньої групи я беру пероксид водню, але в якості каталізатора - оксид марганцю (IV).
Демонстраційний дослід. Помістити в конічну колбу 30 мл пероксиду водню, додати до неї на кінчику шпателя оксид марганцю (IV).
Даний дослід, показує, що в якості каталізатора для одних і тих же реакцій можуть виступати різні речовини.
Ще раз, підбиваючи підсумок виконаної роботи, звернемо увагу на чинники, запишемо їх у зошиті.
Фактори, що впливають на швидкість реакції:
1. Природа реагуючих речовин.
2. Температура.
3. Концентрація речовини.
4. Поверхня зіткнення речовин.
5. Каталізатор.
Закріплення і контроль знань
Ми з'ясували залежність швидкості реакції від впливу різних факторів. Тепер давайте перевіримо, наскільки була ефективною наша робота. Дізнаємося ми це за допомогою графічного диктанту. У самому графічному диктанті немає нічого складного. Я пропоную твердження, якщо ви згодні, то ставите на готовому листочку «+», якщо ні, то «-». Підпишіть своє прізвище на листочку.
Твердження:
1) Каталізатор знижує швидкість хімічної реакції.
2) Порошок цинку взаємодіє з сірчаною кислотою повільніше, ніж гранули.
3) Натрій взаємодіє з киснем швидше, ніж залізо.
4) Взаємодія магнію з водою прискорюється при нагріванні реакційної суміші.
5) Залізо швидше взаємодіє з 30%-ним розчином сірчаної кислоти, ніж з 10%-ним.6) Для прискорення розкладання пероксиду водню як каталізатора можна використовувати тільки оксид марганцю (IV) MnO2.
7) Для зменшення швидкості хімічної реакції необхідно збільшити концентрацію реагуючих речовин.8) З найбільшою швидкістю при однакових умовах йде реакція соляної кислоти з міддю, а не з залізом.
9) Оксид міді (II) швидше взаємодіє з сірчаною кислотою при 60оС, а не при 20оС.
10) Водень швидше взаємодіє з фтором, а не з йодом.
Відповіді: - + + + - - - + +
Передайте свій листочок сусідові зліва.
Перевірте один одного. Критерії позначки: 10 правильних відповідей - оцінка «12», 8-9 - «9», 5-7 - «6».
Я сподіваюся, що оцінок «2» немає.
Організатори груп передайте листочки вчителю.
Будь-яка теорія не ефективна, поки ми не знайдемо їй практичного застосування. У вас на столах є стікери. Напишіть на них, де в своєму повсякденному житті ви стикаєтеся з хімічними реакціями, що йдуть з низькою і високою швидкістю.
Учні наклеюють свої листочки на дошку, розділяючи їх на дві групи: реакції, що йдуть з низькою і високою швидкістю.
Підведення підсумків, рефлексія.
Отже, ми добре сьогодні попрацювали. Ви довели, що вмієте працювати в колективі. Почуття підтримки однокласника є важливим чинником для успішної діяльності, свого роду каталізатором спільної роботи. Я дякую вам за урок. Мені хочеться вірити, що у вас залишилося позитивне думка про урок.
Домашнє завдання: вивчити записи за урок.
ДОДАТОК Б
Біозерська ЗОШ І – III ступенів №18
Прикладний проект
у навчанні хімії «Місце хімії в системі природних наук»
Учитель хімії
ЗОШ№18
Цимбаленко О. М.
Мета уроку (проекту). Сформувати в учнів цілісне уявлення про місце хімії серед природничих наук. Розвивати логічне та філософське розуміння основних законів природничих наук. Виховувати пізнавальний інтерес, вміння працювати в групі.
Основні стадії роботи
• Визначення тематичних завдань для дослідження:
1.Довести, що хімія і фізика - споріднені науки на основі атомно-молекулярного вчення в хімії та молекулярно-кінетичної теорії у фізиці. Показати взаємозв'язок та взаємозалежність між хімією, фізикою, біологією, географією.
2. Показати, як квантова теорія поєднує знання у фізики, хімії, біології.
• Поділ учнів класу на 4 групи: хіміки, фізики, біологи, географи.
• Самостійна робота учнів з різними джерелами знань (позаурочна
робота)
• Оформлення результатів роботи групи (позаурочна робота)
• Спільне дослідження проекту методом „круглого столу" (урочна
діяльність)
• Оформлення результатів проекту у вигляді збірки або газети.
План-конспект уроку
Форма проведення: дослідження проблеми методом „круглого столу". Девіз уроку: „Розум мислителя не відчуває себе щасливим, поки він не зв'яже в одне розрізнені факти, які спостерігає". (Хевіші)
Хід уроку
- Організація класу.
- Мотивація навчальної діяльності.
Учитель. Сьогодні на уроці ми поговоримо про місце хімії в системі природничих наук. У свідомості людини знання про навколишній світ формують її ставлення до довкілля, Всесвіту, впливають на її моральні
якості, особливо в дитинстві і юності. Це не просто знання, а проникнення в таємниці природи, через які розкривається царство науки, збагачується духовний світ людини.
Спробуємо поєднати знання з фізики, хімії, біології та географії, створити чітку систему зв'язків та взаємозалежностей між цими науками.
3. Сприйняття та усвідомлення. Круглий стіл на тему „Місце хімії в системі природничих наук".
Учитель. Хімія та фізика - споріднені науки, зв'язані з біологією та географією. Доведіть це, використавши атомно-молекулярне вчення в хімії та молекулярно-кінетичну теорію у фізиці.
Учень-хімік. В основі атомно-молекулярного вчення в хімії та молекулярно-кінетичної теорії у фізиці багато спільного, усі речовини складаються з атомів, а більшість із молекул. Молекула - найдрібніша частинка речовини, що зберігає її властивості. Для дослідження, нами використана найпоширеніша на Землі речовина - вода, яка складається з двох атомів Гідрогену та одного атома Оксигену Молекула має кутову будову, кут становить 105°. Вона - диполь, тобто поляризована, несе в собі позитивний та негативний заряди. На атомі Оксигену нагромаджується негативний заряд, на атомах Гідрогену - позитивний. Молекулу води можна уявити у вигляді .витягнутого еліпсу. Між молекулами виникає водневий зв'язок між атомами Гідрогену однієї молекули та електронегативним атомом Оксигену другої молекули.
Учитель. Завдяки здатності молекули води утворювати водневий зв'язок ця речовина має ряд аномалій. Це найпоширеніша на Землі речовина. Це можуть довести географи.
Учень-географ. Погляньте на глобус, більшу частину площі нашої планети займає світовий океан, який разом із морями, озерами, річками та льодовиками утворює гідросферу, площа якої становить 71% від площі планети. Об'єм води складає 1,5 млрд. км2, що в 10 разів перевищує об'єм суходолу. Вода входить до складу гірських порід. Атмосфера містить водяну
пару, яка утворює хмари і пом'якшує клімат Землі. 1,3 млрд км - це морська вода, яку називають рідкою рудою, оскільки в ній розчинена величезна кількість йонів металів та аніонів кислот. 0,2 млрд.км2 - прісна вода, завдяки якій існує життя. Це єдина сполука, яка зустрічається на Землі у трьох станах: рідкому, твердому(лід), газоподібному(хмари, туман). Вода в молекулярному стані сприяє створенню кліматичних умов, придатних для життя живих організмів. Завдяки воді на планеті не відбуваються різкі перепади нічних та денних температур.
Учитель. Друге положення атомно-молекулярного вчення стверджує: молекули перебувають у безперервному русі. Поясніть на основі цього явище дифузії. Слово хімікам.
Учень-хімік. Дифузія - це взаємне проникнення однієї речовини в іншу внаслідок безладного теплового руху молекул, атомів, йонів. Візьмемо колбу з водою і обережно опустимо в неї кристали калій перманганату. Між молекулами води розміщуються катіони К+та аніони МпО4.
Учитель. Де ще може відбуватися процес дифузії? Слово надається біологам.
Учень-біолог. Процес дифізії відбувається в живих організмах. Всім відомо, що жаба живе у воді і ніколи не п'є води. На суходолі вона дихає легенями, у воді - за допомогою шкіри, пронизаної величезною кількістю капілярів. Стінки клітин шкіри дуже тонкі й здатні пропускати кисень, який дифундує в кров, а кров через тканину виділяє вуглекислий газ. Явище дифузії відбувається і в легенях людини. Альвеоли легенів густо пронизані капілярами. їх стінки та стінки альвеол дуже тонкі, що сприяє проникненню молекул кисню в кров і виведенню вуглекислого газу в повітря. Швидкість газообміну залежить від площі поверхні, через яку відбувається дифузія газів. Різниця парціальних тисків дифундуючих газів сприяє газообміну. Парціальний тиск кисню у крові становить 6 кПа в капілярах альвеол. Завдяки різниці тисків і відбувається газообмін в легенях.
Учитель. А чи характерне явище дифузії для рослинних клітин?
Учень-біолог. Молода клітина рослини має цитоплазму. У міру росту в цитоплазмі нагромаджується клітинний сік, його оточує цитоплазматична плівка, утворюються вакуолі. У дорослої клітини утворюється одна велика вакуоля. Клітинний сік - це водний розчин солей, цукрів, органічних речовин. Цитоплазматичний шар - це напівпроникна система, яка краще пропускає воду, ніж великі молекули. Якщо концентрація речовин у клітинному соку вища, ніж у цитоплазмі або в навколишньому середовищі, вода внаслідок осмосу переходить у вакуолю, розтягує її і притискує цитоплазму до клітинної оболонки, яка під дією внутрішнього тиску теж розтягується і стає напруженою. При поглинанні певної кількості води в клітині досягається рівновага, тиск урівноважується, клітина перебуває в стані тургору. Тургор - це тиск протопласта на клітинну оболонку. Надходження води залежить не тільки від осмотичного тиску, а й від тургорного тиску в клітині. При рівновазі осмотичного й тургорного тиску вода надходить у клітину, якою б високою не була концентрація в клітинному сокові. Таке явище спостерігається при затяжних дощах.
Учень-біолог. Зробимо висновок. Завдяки молекулярній будові води, її особливостям відбувається розчинення поживних речовин, а також явище дифузії. У клітини надходять необхідні поживні речовини. Створюється осмотичний і тургорний тиск. Так фізика та хімія пояснюють основні процеси життя.
Учитель. Ви довели на основі атомно-молекулярного вчення в хімії та молекулярно-кінетичної теорії у фізиці взаємозв'язок і взаємозалежність природничих наук.
А тепер я пропоную вам розв'язати логічні задачі.
- Чому лід легший за воду і плаває?
-
Чому перед заморозками розсаду помідорів та огірків рекомендують
сильно поливати? -
Які фізичні процеси відіграють роль при приживленні живця до
дички?
4. Чому у всіх частинах альпійських рослин цукру нагромаджується більше, ніж у тих самих рослинах, які ростуть в інших місцевостях?
А тепер я хочу згадати про ще одну важливу теорію, яка успішно поєднує знання з фізики, хімії і біології. Слово фізикам.
Учень-фізик. Це квантова теорія. Початок теорії поклав М.Планк. Він стверджував, що атоми та молекули випромінюють і поглинають енергію окремими порціями - квантами. Далі вчення розвинули Резерфорд та Бор. Теорія об'єднує ядерну модель атома з квантовою теорією світла, згідно з якою променева енергія випромінюється та поглинається тілами окремими порціями - квантами, а випромінювання є потоком фотонів, енергія яких тим більшаючим вища частота випромінювання. Бор виклав своє уявлення про дискретність, переривчастість енергії електрона в атомі. Згідно з його теорією електрони можуть обертатися навколо ядра атома по строго визначених орбітах, електрони не випромінюють електромагнітну енергію. Яку орбіту буде займати електрон, залежить від енергії атома. У не збудженому стані атом має мінімальну енергію і електрон обертається по найбільш близькій до ядра орбіталі.
Учитель. І цьому випадку зв'язок електрона та ядра найбільш стійкий та міцний, і якщо атом одержує додаткову порцію енергії, він переходить у збуджений стан. Мою розповідь продовжить представник групи хіміків.
Учень-хімік. При цьому електрон переміщується на одну з віддалених від ядра орбіт. Енергія електрона в збудженому стані атома більша, ніж енергія електрона в не збудженому стані. Атом перебуває в не збудженому стані недовго. Після цього електрон повертається на свою стійку орбіталь. Цей період супроводжується зменшенням енергії атома і виділенням її у вигляді електромагнітного випромінювання.
Учень-фізик. Я продовжу розповідь. Під час переходу електрона з віддаленої орбіти на ближчу до ядра, енергія випромінюється порціями. Величина кванта енергії пов'язана з частотою випромінювання або довжиною хвилі:
Е = Е2 - Еі= Ьу, де
Е]Е2 - енергія атома в певному стані, Ь - стала Планка, яка дорівнює 6,625*1034Джс*с.
Учитель. А що скаже група біологів?
Учень-біолог. Я хочу звернути увагу на наш зір. За його допомогою ми сприймаємо до 90% інформації. У чому полягає процес сприймання світу органами зору? Перша стадія цього процесу - одержання зображення на сітківці, що досягається оптичною системою ока. Об'єктив ока складається з рогівки і кришталика. Кришталик, змінюючи свою кривизну, автоматично установлює різке зображення предмета, що розглядається. Крім того, виконує також роль світлофільтра: не пропускає ультрафіолетове світло. Роль діаграми виконує райдужна оболонка. Зіниця змінює діаметр від 2 до 8мм залежно від освітлення, а пігментний епітелій, розміщений за сітківкою, поглинає світло, щоб зменшити його розсіювання, що призводить до погіршення зображення. Око має постійний час експозиції - 0,1 секунди. Усі фотони, що потрапляють на нього за цей час, сприймаються ним одночасно. У механізмів зору використовуються квантові властивості світла. Фоторецептор працює так: у мембранах дисків знаходиться зоровий пігмент родоцин. Його молекула складається із білка пепсину, альдегіду вітаміну А, ретиналю. Ретиналь має вигляд букви „Г". Якщо на ретиналь попадає квант світла, молекула випрямляється і переходить в ізомер. Ізомерне перетворення сприяє появі зорового сигналу.
Учитель. А який приклад наведуть хіміки?
Учень-хімік. Я хочу довести, що за допомогою квантової теорії можна пояснити процес фотосинтезу. Він починається з поглинання кванта світла, а закінчується синтезом вуглеводів з вуглекислого газу і води:
6 СО2 + 6Н20 - СбНі2Об +6О2
Фотосинтез відбувається у зелених пластидах рослин - хлоропластах. Світло сонця падає на зелений листок, частина фотонів поглинається хлорофілом. Коли молекула хлорофілу поглинає фотон, один із його
електронів переходить на більш високий енергетичний рівень, і називається збудженим електроном. Повернення електрона на свою постійну орбіту супроводжується виділенням енергії, яка перетворюється у внутрішню енергію продуктів фотосинтезу.
4.Підсумки уроку. Рефлексія.
Учитель. Ми розглянули дві теорії, що об'єднають природничі науки в одне ціле. Вони доводять, що фізика, хімія, біологія, географія доповнюють і поглиблюють одна одну, тому що все це науки про природу.
5. Домашнє завдання.
Підготуватися до тематичного оцінювання по темі: „Роль хімії в житті суспільства"
ДОДАТОК В
Білозерська загальноосвітня школа
І-Ш ступенів № 18
Білозерської міської ради
Донецької області
Тема: «Нафта - основа цивілізації.
Значення хімії у вирішенні соціально-економічних задач суспільства».
Урок хімії в 11 класі.
учитель хімії Цимбаленко О.М.
проблемний інтегрований
особистісно- орієнтований
урок узагальнення і систематизації знань
з хімії в 10 класі
Тема: "Нафта-основа цивілізації. Роль хімії в рішенні соціально- економічних задач суспільства"
Мета:
-
Узагальнити і систематизувати знання учнів з теми: "Нафта-природне
джерело вуглеводнів". -
Підкреслити позитивну роль хімії в рішенні соціально-економічних задач
суспільства. -
Створити умови для розвитку навичок науково-дослідної роботи учнів,
їхньої творчої і ділової активності.
Методи:
метод проектів.
Форми роботи: групова, колективна. Обладнання:
Комп'ютери, локальна мережа, мультимедійний проектор, робочий зошит,таблички настільні з позначенням підприємства, план роботи над проектом.
При підготовці до уроку були сформовані групи учнів,проведена попередня робота з наступних етапів.
Планування змісту й етапів навчального проекту:
1. Продумування вчителем теми проекту уроку, вибір навчального розділу відповідно до програми, визначення виду,типу і методу проведення уроку.
2.Вибір вікової категорії учнів: учні 10-х класів. З.Формулювання питань навчальної теми. Як раціонально використовувати нафту? Скільки нафти на планеті?
Що таке нафта?
Як можна вирішити проблему "обмеженості" нафти?
Що ефективніше: використовувати нафту як джерело чи енергію як ресурс для нафтохімічної промисловості?
4.Формування дидактичних цілей проекту.
5.Формування компетентності в сфері самостійно їпізнавальної діяльності, уміння працювати з великим обсягом інформації, уміння побачити проблему і намітити шляхи її рішення.
6.Формування критичного мислення, навичок роботи в команді. 7.Формування методичних задач.
8.Формувати уміння самостійно працювати з новими джерелами інформації: аналізувати, систематизувати, класифікувати, відбирати інформацію, представлятиїї, використовуючи сучасні технології.
9.Розвивати творчі й аналітичні здібності учнів, уміння аргументувати власні думки.
10.Формувати уміння працювати в группах ііндивідуально. Виховувати почуття відповідальності, взаємодопомоги, взаємоаідтримки. 11.Підтримувати пізнавальний інтерес до предметів. 12..Формулюванняпроблеми (вибір теми індивідуальних досліджень учнів).
13.Висування гіпотез рішення проблеми гіпотези досліджуються як можливі варіанти рішення проблеми).У ході дослідження вони піддаються перевірці.
14.Визначення творчої назви проекту "Нафта - не паливо, топити можна й асигнаціями"(Д.И.Менделєєв.)
15.Формування груп для проведення дослідження і визначення форми представлення результатів. Учні поділяються на групи за інтересами.
16.Обговорення плану роботи учнів чи індивідуально в групах. 17.Обговорення зі школярами можливих джерел інформації.
18.Самостійна робота учнів у групах, обговорення завдання кожного в групі. Пошук групової угоди.
І9.Самостійна робота груп (учитель консультує, допомагає, направляє, координує діяльність учнів).
20. Підготовка учнями презентації за звітом виконану роботу (дизайн підприємства з розробки якої-небудь пропозиції, доказ через аргументи і факти).
21.3ахист отриманих результатів і висновків.
22.Оцінювання результатів проекту школярами (рефлексія).
Хід уроку
І.Організаційна частина П.Основна частина
Девіз уроку: "У будь-якій праці, у будь-якім творінні-необхідно натхнення".
Учитель. Добрий день. Сьогодні ми проведемо мультимедійний проблемно-інтегрований урок. Він потребу від вас знань як хімії, так і економіки. Його тему і ціль ми визначимо трохи пізніше.
Людина...У людини величезна кількість потреб, у тому числі і матеріальних. "Ми усі бажання ніколи свої не зменшуємо, маючи що небудь, ми більшого бажаємо". А що ж потрібно для створення предметів, що складають економічні блага?
Звичайно ж, природні ресурси.
Виходить, чим швидше ростуть наші потреби, тим стрімкіше зменшуються природні запаси. Чи бачите ви в цьому проблему?
Уявимо собі, що коли-небудь, а може бути, зовсім незабаром закінчиться такий природний ресурс, як нафта.
Звучить голос за кадром, що коментує слайди, складені заданою інформацією.
Прогноз доктора Коліт Кіпбелла- найбільшого фахівця в області нафтовидобутку. В даний час консультант уряду США і великих нафтових корпорацій: "Сумарні запаси нафти на планеті складають 1800 гігабаррелей, з яких людина вже добула майже половину- 822 гігабарреля. При цьому людство споживає в рік 22 гігабарреля нафти, а розвідує всього 6. Пік видобутку прийшовся на 2007рік, після чого виснаження світових запасів нафти складає 2% у рік. 2007 рік став поворотним моментом в історії людства".
Оцінка нафторесурсів доктора Кинга Хубберта-відомого фахівця в області розвідки і виснаження нефторесурсов: "Нафту використовують як джерело енергії доти, поки добувати її дешевше, ніж одержувати її за допомогою електроенергії. Після цього видобуток нафти припиниться незалежно від того,яка буде її грошово-кредитна ціна . До 2025 року людство споживе 80% світових запасів нафти.
Авторитетна думка профессора Айвенго-консультанта уряду США по оцінці нафтових запасів основних басейнів: "У океані знайдена вся нафта на Землі. Критична дата-коли глобальний попит перевищить світовий видобуток-прийшлася на період між 2005-2010 роками. Після цього темпи видобутку
почали знижуватися. Це відбувається в межах життя більшості людей, що живуть на планеті. Далі наступить енергетична криза, що торкнеться
кожного землянина".
Невже прогнози вчених збудуться і до закінчення XXI століття з надр Землі будуть викочені останні барелі нафти? І що? Це торкнеться всіх?
Дискусія дітей про наслідки, що можуть виникнути в результаті використання всієї наявної нафти, про необхідність нафти для виробництва благ.
Виходить,уже зараз ми повинні думати про те, як знизити споживання нафти, зменшити :свої потреби в харчуванні, одязі, пересуванні транспортом, у користуванні електроенергією.
Уявіть собі,наскільки погіршаться умови життя людини, зогляду на це .Держави
усього світу вирішують задачі ,пов'язані з поліпшенням рівня і якості життя своїх громадян. Отже,ми бачимо проблему, що може виникнути через невідповідальність усіх.
Виходячи з цілей уроку,спробуйте самостійно сформулювати його тему."Нафта-основа цивілізації .Роль хімії у вирішенні соціально-економічних задач суспільства".
Давайте згадаємо,фізичні властивості нафти. Проведемо невелике лабораторне дослідження,визначимо її агрегатний стан ,колір,запах,розчинність у воді.
Лабораторний дослід.
«Фізичні властивості нафти».
Мета роботи: визначити колір, запах, розчинність у воді.
Учень. Історична довідка.
З нафтою людина познайомилася давно. Відомості про неї прийшли до нас із Близького Сходу. Археологічні розкопки свідчать про те, що ще в долині ріки Євфрат нафта і продукти її окислювання (асфальти) люди добували 6-8 тис. років тому. Древні шумери використовували бітум як клей у серпах і аплікаціях, у великих містах індійської цивілізації "Для бальзамування мумій використовували асфальт, а у Вавилоні нафтою висвітлювали вулиці.
Людям давно були відомі "смоляніями" асфальтні озера, що "подарували" нам сотні добре збережених кістяків гігантських лінивців, саблезубих тигрів і інших хребетних тварин.
У ранньому Середньовіччі нафта вже добувається з колодязів, потім з'являються перші шпари глибиною до 200-300 метрів в Італії.
У Китаї буравлення було відоме ще до н.е.
У XVIII столітті з'являються перші асфальтовані вулиці в Парижі.
Потім нафта знадобилася для двигунів внутрішнього згоряння. Після винаходу інженером В.Г.Шуховим методу перегонки нафти, вона стала універсальним паливом. Перша нафтова шпара у світі пробурена в 1848року в Баку. Саме з цієї шпари,як прийнято вважати,і починається промисловий видобуток нафти у світі.
Учитель. Повернемося до проблеми. Невже ми будемо спокійно чекати той
час, коли цивілізація зануриться в морок і холод? Що ви можете запропонувати
для збереження ресурсів нафти? Які ви можете запропонувати шляхи рішення?
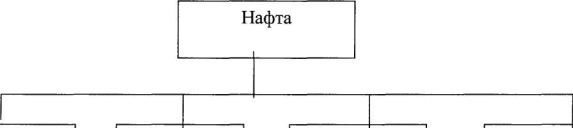
Об'єднаємо ваші пропозиції наступною інформаційною моделлю.
Нафта
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Зміна
Зміна
альтернативними джерелами енергії
Відкриття нових джерел
Надійність транспортування
Інтенсифікація процесів переробки
![]()
![]()
![]()
![]() Для розробки гіпотези клас розділився на 4 групи:
Для розробки гіпотези клас розділився на 4 групи:
1-а команда "Альтернативщики";
2-а команда "Дослідники";
3-а команда "Активісти";
4-а команда "Захисники природи".
Вдома ви продумали свою позицію, підібрали аргументи на користь свого рішення, і тепер у вас є 2 хвилини для того, щоб підготувати свої презентації проектів. Хотілося б звернути вашу увагу на те, що по закінченні презентацій буде проведений рейтинг пропозицій за рішенням проблеми невідповідності між ростом споживання нафти і її природних запасів. Якщо під час підготовки
проекту ви працювали над однією пропозицією, то під час презентацій довідаєтеся ще про три. У вас з'являється можливість тепер вже особистої переваги рішення за значеної проблеми. Тому ви можете задавати питання, які вас цікавлять, після презентації однієї з груп, щоб переконатися, що така пропозиція в більшому ступені вирішить проблему. Коли всі групи представлять свої проекти, ви зможете оцінити роботу кожної з груп.
Але спочатку невелика довідка: у даний час нафтову політику визначають два картелі - західний і східний. Перший включає найбільші нафтові компанії, на які доводиться 40% нафтовидобутку країн. Сукупний обсяг продаж і в цих компаній - 400млр доларів. У східний картель-ОПЕК входять 13 країн, що дають 60% світового експорту нафти. В ОПЕК входять: Алжир, Венесуела, Габон, Індонезія, Іран, Ірак, Кувейт, Лівія, Нігерія, ОАЗ, Саудівська Аравія, Еквадор.
Презентації проектів учнів
Ви переглянули презентації, осмислили кожну пропозицію команд. Які аргументи були недостовірними? Яка пропозиція, на ваш погляд, вирішить проблему? З'являється рейтинг для цього.
Результати рейтингу.
Заключна частина, підведення підсумків уроку,оцінка роботи учнів.
Давайте згадаємо початок уроку. Ми говорили, що у людства необмежені потреби і, щоб людина була задоволена умовами життя, їй необхідно одержати величезне число благ, для виробництва яких необхідні фактори виробництва: природні ресурси, праця, капітал, підприємництво.
Зменшення таких факторів, як природні ресурси можна компенсувати підприємництвом, відкрити такі підприємства, що вирішать проблему раціонального ефективного використання обмежених природних ресурсів. "Велика наука жити полягає в тому, щоб жити в майбутньому"(Піфагор).
Додаток
Матеріал презентацій проектів
Команда" Альтернативщики"
Тема дослідження. Використання альтернативних джерел енергії.
Мета роботи. З'ясувати, чи можна замінити нафту іншими видами палива.
Нафта-кров цивілізації, а наша цивілізація, безсумнівно, нафтова. Саме їй ми зобов'язані неймовірним злетам. Енергетика є основою розвитку людського суспільства, а вона, у свою чергу, не може існувати без нафти-головного джерела енергії.
Витрати енергії на одного жителя в перерахунку на нафту складають 300-600 л/рік на людину в країнах що розвиваються і з перехідною економікою і 3000-10000 л/рік на людину в країнах з розвиненою економікою. В наявності досить велика різниця в цифрах.
Аналізуючи діаграму світового енергоспоживання, ми бачимо, що: 33% енергії дає нам нафта, 28%-вугілля, 18%-газ,
4%-ядерна енергетика, 4,4%-нетрадиційні джерела (сонце, вітер, вода, біомаса і т.і.).
Подивимося на діаграму по енергоресурсах. Вугілля нам вистачить на 600 років, газу на 50рокі, урану на 27років, нафти в країнах ОПЕК на 80 років, в інших країнах -на14 років,у США-на 10 років. Використання нафти переважає через зручність транспортування і високої теплоємності: 10 тонн нафти дає стільки ж енергії, скільки і 31 тонн дров. Але нафта занадто коштовна, щоб спалювати її.
Ще наприкінці XI століття Д.І.Менделєєв писав: "Нафта не паливо, топити можна й асигнаціями" .Альтернативна економіка є не тільки виходом з тупика, що очікує нас, але і рішенням безлічі екологічних проблем. Багато чого вже зроблено. На території Японії, США, Франції працюють десятки геліоустановок, що перетворять енергію сонця. Нідерланди використовують енергію повітря,попутно відвойовуючи території в океані. 7000 вітряків виробляють 60 МВТ/годину і цілком постачають енергією фермерів, що живуть на прилеглих територіях. Гідроенергетика дає до З 1% енергії в країнах, що розвиваються. За допомогою таких станцій у Канаді виробляється 70% енергії, в Австрії60%, у Швеції 45%, М.Рейк'явік в Ісландії одержує 100% енергії з геотермальних джерел. Ще одне"ноу-хау"-це використання біомаси. Англійська компанія "Дженерал Електрик" вирощує морську водорість спіруліну, суха речовина якої при спалюванні виділяє велика кількість тепла. Компанія "Боїнг"спалює міське сміття. А в країнах висхідного сонця вже давно спалюють сміття і відходи. 1 тонна гною еквівалентна по калорійності 1 центнеру бензину. Самим багатообіцяючим джерелом енергії майбутньому є водень. Він дає в 4 рази більше енергії, чим вугілля. Ядро нашої планети містить металогидрати (сплави легких металів кремнію і магнію, насичених воднем). При взаємодії з водою виділяється водень. Спалюючи водень у
двигуни внутрішнього чи згоряння на електростанції ми одержимо дистильовану воду. Якщо ж нафту використовувати тільки в нафтохімії, то її вистачить на сотні років.
Ми уявили схему, використання нафти як сировину органічного синтезу у виді дерева, що харчується не водою з розчиненими в ній речовинами,а нафтою-сумішшю різних вуглеводнів. Нафта-це сировина для виробництва синтетичного каучуку, спиртів, поліетилену , поліпропілену, широкої гами різних пластмасі готових виробів з них, штучних тканин, будівельних матеріалів (бітуми,гудрон,асфальт); сировина для одержання ряду білкових препаратів, використовуваних як добавки в корм худоби і для стимуляції його росту.
Ми бачимо, скільки корисних і необхідних речовин можна і потрібно робити з нафти. Дві котельні нашого містечка за рік витрачають приблизно 20000тонн мазуту. Скільки ж усього можна було б зробити з цієї нафти? Висновок: необхідно перерозподілити частку нафти на користь нетрадиційних джерел енергії. Вони більш екологічні та економічні. Потенціал ресурсів альтернативної енергетики перевищує податки потреби в ній.
Команда. "Захисники"
Тема дослідження. Ресурсозбереження-один зі способів рішення енергетичних проблем."
Мета : Проаналізувати втрати нафти й екологічні проблеми, що виникли вз в'язку з цим.
Девіз: Океан сивий гримить тривожно. Він таїть образу в глибині,
Чорні розгойдуючи плями на крутій розгніваній хвилі. Екологічні катастрофи:
1982р.-самий великий нафтовий танкер "Ексон Вальдес" зазнавав арії у берегів Північної Норвегії.
1989р.-нафтовий танкер зазнав аварії в затоці Принца Уільмса на Алясці. У море вилилося близько 240000 тонн нафти.
1990р.-південно-корейське судно "Сальвія" зазнало аварії, через тріщину, що утворилася, в обшивці, на поверхню води вилилося 13000 тонн нафти.
1992р.-бельгійський танкер "Мінерал Диаманд", роблячи плавання в Індійському океані, потрапив в ураган. 26чоловік екіпажу загинули,у море вилилося 75330 тонн нафти;
"Нафтова чума-зворотний бік добробуту" (Тур Хейєрдал).
Тур Хейєрдал писав: "Посередині океану, відкритого для Європи Колумбом, тепер неможна руку сунути у воду, щоб не вимазатися в бруді". Під словом "бруд" він, звичайно ж, мав на увазі нафту.
Схема перетворення нафти у водоймі. Розглядається схема по приготовленому слайду.
• Отруєння живих організмів з летальним результатом
• Порушення фізіологічної активності;
• Виникнення хвороб через великий зміст вуглеводнів у середині
організму;
• Обволікання нафтопродуктами - зменшується доступ кисню;
• Зміна середовища існування.
Висновок: транспортування нафти повинне бути технічно надійним ,що забезпечить не тільки економічні вигоди, але й екологічну безпеку.
Команда" Активісти"
Тема дослідження. Інтенсифікація технологій переробки нафти.
Мета дослідження. Проаналізувати процесе перегонки нафти і визначити найбільше оптимальні умови для збільшення виходу продуктів.
З нафти ми беремо для нужд країни своєї потік бензину, масел и мазуту. До них в додаток тисячу речей для дому і домашнього затишку.
Нафта-це складна суміш насичених і ароматичних вуглеводнів, а також циклопарафінів з домішкою неорганічних речовин. Розрізняють нафти парафінові, нафти ароматичні в залежності від змісту тих чи інших вуглеводнів.У природі існують в основному нафти із мішаного складу.
В основі первинної переробки нафти лежать різні температури кипіння її компонентів:
БензиниС5Н12-С11Н24 (40-200С).
Лігроїн С8Н18-С14Нзо(150-250С).
Керосин С12Н26-С18НЗ 8(180-300С) піддаються вторинної
Солярова фракція переробці (палива)-
ГазойльС18Н38-С24Н5О (270-400С).
МазутС19Н40-С53Н108 (більш400С). Продукти вакуумної перегонки мазуту:
1)мастила-моторне, індустріальне, циліндрове й ін.;
2)немастильні олії-трансформаторне, кабельне, поглинальне;
3)парафін (основний споживач-сірникова промисловість);
4)бітуми, нафтовий кокс(сировина для виробництва сажі, бензолу, толуолу);
5)вазелін (для медичних препаратів).
Вихід бензину при первинній переробці нафти складають у сього лише 20%, інше-висококип'ячі продукти. Якже одержати бензину більшій кількості? У1891 році російський інженер В.Г.Шухов розробив метод розщеплення складних вуглеводнів, названий згодом крекінгом.
Крекінг-це термічне розкладання вуглеводнів і інших-складових частин нафти. Чим вище температура, тим більше швидкість крекінгу і більше вихід газів і ароматичних вуглеводнів.
Крекінг нафтових фракцій крім рідких продуктів дає першорядно важлива сировина - гази, що містять не граничні вуглеводні(олефіни).
Розрізняють наступні основні види крекінгу:рідинно-фазний(20-60атм,430-550С), дає неграничний і насичений бензини,вихідбензинупорядку50%,газів-10%; паро-фазний (звичайний чи знижений тиск,600С), дає неграничний ароматичний бензин, вихід менше, ніж при рідинно-фазному крекінгу, утвориться велика кількість газів; піроліз нафти( звичайний чи знижений тиск,650-700С), дає суміш ароматичних вуглеводнів (піробензол), вихід порядку 15%, більш половини сировини перетворюється в гази; деструктивне гідрування(тискводню200-250атм,300-400С в присутності каталізаторів-заліза,нікелю, вольфраму ), дає граничний бензин з виходом до 90%; каталітичний крекінг(300-500 присутній каталізаторів-А1СЬ,алюмосилікатів,
![]() МЬСЗ,Сг2ОЗ і ін.), дає газоподібні продукти і високосортний бензин з перевагою ароматичних і граничних вуглеводнів ізобудови.
МЬСЗ,Сг2ОЗ і ін.), дає газоподібні продукти і високосортний бензин з перевагою ароматичних і граничних вуглеводнів ізобудови.
У техніці велику роль грає так називаний каталітичний реформінг-перетворення низькосортних бензинів у високосортні високооктанові чи бензиноароматичні вуглеводні.
Основними реакціями при крекінгу є реакції розщеплення вуглеводорідних ланцюгів, ізомерізаціїі циклізації.
Висновок. Для того, щоб перерозподілити ролі "нафта-паливо"і" нафта-сировина" на користь другий варто максимально інтенсифікувати процес переробки нафти з метою одержання оптимальних обсягів необхідних продуктів.
Команда"Слідопити"
Мета дослідження. Аналіз стану і перспектив розвитку нафтовидобувної галузі.
Родовища нафти виявлені на кожнім континенті, а також на континентальних
шельфах. Деякі з них активно розробляються, інші законсервовані. Оцінка того
на який період вистачить нафтових запасів, включаючи два фактори -обсяги
відомих родовищ, розробка яких економічно доцільна з погляду сучасної
технології, рівень видобутку в поточному році. Однак при збільшенні
розвіданих запасів, змін і інтенсивності видобутку і впровадженні нових
технологій оцінка також міняється.
Найбільші запаси нафти зосереджені в країнах Ближнього Сходу (65% від світових): на долю Росії приходиться 13-15% світових запасів. ДО 2010 року в Росії передбачається збільшення видобутку нафти до 490 млн тон, а до 2025 року -до 520 млн тон.
Природне виснаження над ріст старіння районів нафтовидобутку є глобальною закономірністю .Чітко виділяються три періоди -до 1950р., з 1951 по 1991р. із 1991р. по дійсний час. Перший період пов'язаний з відкриттями нафтових родовищ у США, Мексиці, Ірану, Саудівській Аравії, Індонезії. Усього ж у світі було відкрито 17 великих і гігантських родовищ із загальними запасами 35,6 млрд тонн.
Другий етап характеризується інтенсивними пошуками нафти і відкриттям "нових нафтових родовищ у країнах Перської затоки, Північної Африки, на Алясці і шельфі Північного моря. Усього у світі в 1951-90р. було відкрито 57 великих і гігантських родовищ із сумарними запасами 60,7 млрд.т.
Різкий спад приростів запасів приходиться на 1981-1990рр. У 1981-1988 рр. У світі було відкрито тільки три великих родовища, а в 1986-1990р. жодного. Перелом наступив після 1990р., коли, були продовжені відкриття на шельфі Бразилії, почалися перші відкриття на шельфах Анголи Перської затоки.
Для ефективної геологорозвідувальної роботи необхідні відповідні фінансові, технічні й інтелектуальні вкладення.
Розвідка нафтових родовищ включає ряд операцій.
Супутник здійснює фотозйомку ділянок землі й океану. Літак виконує детальну радіолокаційну зйомку. Наземні дослідницькі групи вимірюють "магнітні й електричні полюси, проводять сейсмічні дослідження і проводять побудову карт гірських порід, відбирають проби при буравленні шпар.
Висновок. Ми пропонуємо удосконалити нормативно-правову базу на розробку родовищ, і зокрема:
• Законодавчо гарантувати надроспоживачу право на розробку
родовищ, відкритих на умовах ризику;
• Прийняти конкурсну форму видачі ліцензій на геологічне дослідження
надр;
• Увести диференційовану плату за видобуток корисних копалин у
залежності від гірничо-геологічних умов, якості продукції та
продуктивності шпар;
• Передбачити податкові пільги малим із середнім підприємствам по
розвідці і видобутку нафти.
![]()
![]() Робочий лист
Робочий лист
Учня(ці)_
![]() Тема уроку Мета уроку_
Тема уроку Мета уроку_
1 .Узагальнити і систематизувати знання з теми : "Нафта-природне джерело вуглеводнів".
2.Підкреслити позитивну роль хімії в рішенні соціально-економічних задач суспільства.
Конспекту року
1. Згадай!
Людина необмежені можливості блага
![]()
![]()
![]()
![]() Фактори виробництва
Фактори виробництва
![]()
![]()
![]()
![]() 2.Модель рішення проблеми обмеженості нафти і необмеженості потреб
2.Модель рішення проблеми обмеженості нафти і необмеженості потреб
![]()
![]()
запобігання втрат нафти
Заміна альтернативи
йми джерелами
Заміна технологій переробки
Відкриття нових джерел
![]() 3.Алгоритм захисту проекту: а) ціль дослідження;
3.Алгоритм захисту проекту: а) ціль дослідження;
б)результати дослідження рішення проблеми;
в) загальні висновки__________________
4.Сформулюйте питання по презентації
проектів______________________
5.Рейтинг Моя перевага:
б. Висновок з проблеми, яка була поставлена на
уроці:______________________________
7.Рефлексія
Продовжити наступні речення:
Я довіда (лася)вся(а) на
уроці__________________
Я незгодний (на)
На уроці зштовхнувся (лась) з наступними
труднощами_____________________
ДОДАТОК Г
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Білозерська загальноосвітня школа
Білозерська загальноосвітня школа
І - III ступенів №18
Добропільської міської ради
Донецької області
Урок
з хімії в10 класі тема «Спирти»
Учитель хімії Цимбаленко О.М.
![]()
Тема: «Спирти»
Мета: узагальнити, поглибити знання, закріпити знання основних питань
теорій (будова, фізико-хімічні властивості, способи отримання та
застосування одноатомних, багатоатомних, ароматичних спиртів);
розвивати уміння та навички диференційного рішення розрахункових задач з
теми, уміння працювати за хімічним диском та опорним конспектом, у парах,
групах, співпереживати за роботу товаришів, працювати з додатковою
літературою, працювати творчо; розширювати та поглиблювати уявлення про
шкоду алкоголю, розкрити соціальне та економічне зло алкоголізму;
виховувати активну життєву позицію творчо працюючих громадян України.
Методична мета: реалізація між предметних зв'язків, розвиток умінь та
навичок узагальнення, систематизації, логіки мислення, усвідомленого
висловлювання своїх думок.
Тип уроку: узагальнення та систематизація знань.
Форма проведення уроку: тематична атестація ( урок - 2 години)
Обладнання: магнітофон (інструментальна музика - фонограма-мінус пісні
«Дитинство», таблиця «Спирти», «Етанол та спадковість», плакати з
цитатами «Пияцтво - добровільне безумство» (Аристотель), «Найбільша
перемога - над собою, а найсоромніше - це бути переможеним своїми
бажаннями» (Демократ), набори для хімічного експерименту:
Набір 1: етанол, вода, сірники, лабораторний посуд.
Набір 2: етанол, оцтова кислота, лабораторний посуд, лід.
Набір 3: гліцерин, сульфат Си (II), гідроксид натрія, горілка, сірники,
лабораторний посуд.
Картки для індивідуальної та групової роботи, пам'ятка старшокласнику
"Твоє щастя - у твоїх руках».
Атестаційні листи для учнів, диски для відповідей (індивідуальних).
Хід уроку
|
Етап уроку |
Що потрібно знати |
Що потрібно |
Завдання |
Дія учнів |
Дія вчителя |
|
|
|
вміти |
|
|
|
|
І.Мотивація |
Тему уроку, мету, |
|
Записати мету до зошита |
Слухають та |
Повідомлення |
|
уроку |
регламент. |
|
|
записують мету |
теми та мети |
|
(2 хв.) |
|
|
|
уроку |
уроку |
|
II. Актуалізація |
Теоретичні викладки |
Встановлювати |
Встановлювати |
Встановлюють |
Контроль |
|
знань учнів (5 |
теми, формули, |
відповідність |
відповідність між назвою |
відповідність між |
за виконанням |
|
хв.), тести +(5 хв.) |
властивості, склад, |
між формулами |
та формулою речовини (за |
формулою та |
тестового |
|
робота за |
будова, отримання, |
та назвами |
опитуванням, див. |
назвою речовини, |
завдання, |
|
картками |
застосування спиртів. |
речовин, |
додаток №1, відповісти на |
записуючи по черзі |
читати |
|
|
|
обирати |
питання тестового |
номера речовин, |
питання |
|
|
|
правильні |
завдання (див. додаток |
які (за їх думкою) |
за додатком. |
|
|
|
відповіді під час |
№2). |
відповідають |
|
|
|
|
виконання |
Учні працюють у парах, |
запропонованій |
|
|
|
|
тестових |
потім перевіряють та |
учителем речовині, |
|
|
|
|
завдань. |
оцінюють роботу. |
відповідають на |
|
|
|
|
|
|
питання тестового |
|
|
|
|
|
|
завдання, |
|
|
|
|
|
|
взаємоперевірка. |
|
|
III. Робота з |
Хімічні властивості |
Записувати |
Записувати рівняння |
Обирають рівень |
Надає |
|
хімічним диском |
спиртів |
рівняння, які |
реакцій за диском (див. |
завдання, |
консультаційну |
|
(5 хв.) |
|
відповідають їх |
додаток №3), написати |
записують |
допомогу |
|
|
|
реакціям |
максимум можливих |
рівняння реакції за |
учням |
|
|
|
|
рівнянь реакцій. |
диском |
|
|
|
|
|
Рівень А. Диск №2 + №3 |
|
|
|
|
|
|
(шість рівнянь) |
|
|
|
|
|
|
Рівень Б. Диск №1 + 3№ |
|
|
|
|
|
|
(чотири рівняння) |
|
|
|
|
|
|
Рівень В. Диск №1 + №2 |
|
|
|
|
|
|
(два рівняння) |
|
|
|
|
|
|
|
|
|
|
У IV. Відтворення |
Склад, будова, |
Відтворювати |
Варіант 1 - етанол |
Згідно із |
Надає |
|
"опорного ^ |
властивості, отримання |
опорні |
Варіант 2 - фенол |
запропонованим |
консультаційну |
|
конспекту (5хв.) |
спиртів |
конспекти за |
Варіант 3 -гліцерин |
варіантом |
допомогу |
|
|
|
темою |
|
відтворюють |
учням |
|
|
|
«Спирти», |
|
опорні конспекти |
|
|
|
|
«Феноли» |
|
|
|
|
V. Рішення |
Алгоритми рішення |
Рішення задач |
1 рівень - який об'єм |
Обирають рівень І |
Надає |
|
розрахункових |
задач |
різних типів |
водню (н.у.) виділяється у |
розв'язують задачі |
консультаційну |
|
• задач (8 хв.) |
|
|
результаті взаємодії 9,2г |
|
допомогу |
|
|
|
|
натрію з етанолом? |
|
|
|
|
|
|
2 рівень - з'ясувати об'єм |
|
|
|
|
|
|
(н.у.) газу, утвореного в |
|
|
|
|
|
|
результаті взаємодії 8г |
|
|
|
|
|
|
етиленгликолю з 2,3г |
|
|
|
|
|
|
натрію |
|
|
|
|
|
|
3 рівень - під час |
|
|
|
|
|
|
нагрівання одноатомного |
|
|
|
|
|
|
спирту з бром воднем |
|
|
|
|
|
|
утворюється |
|
|
|
|
|
|
сполука,масова доля |
|
|
|
|
|
|
брому в якій 73,4%, |
|
|
|
|
|
|
визначте формулу спирту |
|
|
|
УІ.Хімічний |
Хімічні властивості |
Проводить |
1 група - провести |
Проводить |
Контролює |
|
експеримент |
спиртів, правила |
досліди, які |
досліди з розчинності |
досліди, записує у |
спостереження |
|
( в групах,6 хв) |
техніки безпеки під час |
доводять хімічні |
етанолу, горіння етанолу. |
звітах результати |
правила ТБ під |
|
|
проведення хімічного |
властивості |
2 група - реакція |
дослідів, |
час проведення |
|
|
експерименту |
сиртів |
етерифікації - взаємодія |
спостережень, |
хімічного |
|
|
|
|
етанола с отцетовою |
рівнянь реакцій |
експерименту, |
|
|
|
|
кислотою. |
|
оцінює учнів |
|
|
|
|
3 група - якісна реакція |
|
(макс. 8балів) |
|
|
|
|
на гліцерин |
|
|
![]()
![]()
![]()
![]()
![]()
![]()
![]() і ,?а.х.ист ■■■:: ами "Ми за чспш спосіб г їя» 3 групи по і. [6 хв)
і ,?а.х.ист ■■■:: ами "Ми за чспш спосіб г їя» 3 групи по і. [6 хв)
Вплив алкоголю на організм підлітків
Творчо мислити,
складати
рекламу,
оформлювати
плаката[
Намалювати плакат «Ми за здоровий спосіб життя», скласти текст реклами
Малюють плакати, складають тексі
реклами, захищають її
Оцінює результати роботи груп (макс. 5 балів)
![]()
![]()
![]() Етап роботи пах, 3 групи
Етап роботи пах, 3 групи
У.В. (9 ХВ.)
Генетичний зв'язок між класами органічних сполук
Записувати рівняння реакцій за запропонованою схемою перетворень
с* щ-ои
і
Керівники груп беруть завдання, після хвилинного спілкування групи починають писати І рівняння реакції на '" дошці ( по одному рівнянню кожен учень)
Контролює правильність записів рівнянь
реакцій
![]() З група
З група
о
![]()
![]()
![]()
![]()
![]()
![]() 'угкетування
'угкетування
: т'^вання 4 хв.
Про вплив алкоголю на
організм підлітка
Відверто
відповідати на питання анкети
Питання анкетування (див. додаток №4)
І Відповідають на
І питання;
| розрахункова
комісія робить
аналіз анкет
І____________
Проводить анонімне анкетування учнів, підводить підсумки
![]()
![]()
![]()
![]()
![]()
![]()
Див. додаток №
X. Диспут "Тверезість -норма життя» (20
хв.)
XI. Підведення підсумків уроку (6хв.)
__ . ..
Про вплив алкоголю на ! Висловлює свої
організм, про | думки
необхідність боротьби :■
пияцтвом, про
соціальне зло, яке несе
алкоголізм________ |__________
Складає пам"ятку для старшокласника
Висловлюють свої думки
Скласти пам'ятку "Твоє І Складають щастя - у твоїх руках» пам'ятку
Проводить диспут
Коректує висловлювання
ДОДАТОК №1
№1 Варіанти карток та ключ розшифрування. (За кожну правильну відповідність 0,5 бал. - всього 10 бал.)
1 ВАРІАНТ
і. анз -сня, он 2. сн% ^
з. ш* - сиг
І І он он
4.
5. Шз -
Я
6. №з~С-СНз
0
7.
8.
9. Ні
ю.
![]()
![]()
І
ОК
М
І І
ОМ
14.
15.
„о
-І
^ОА£
16. ,0/СЕг, 17.
18.
19.
20.
\
2 ВАРІАНТ
і. Шк-СН-Шя,
І І /
ои он оя
2.
с її
о
З.Ні
А 01
6. Так 7. СМз-С
■ О
![]()
8.
9.СМзОМ
10.
V
00*,
,0 П.СМз-с
ш
12.
13.
![]()
14. Сз Ш ОЯ 15. СНг ■=
16.
їв.
О/ІГсь
19.
![]()
|
ПИТАННЯ |
|
|
|
|
|
Відповіді |
|
|
|
|
1 варіант |
2 варіант |
|
|
1. Фенол |
8 |
|
4 |
|
2. Етанол |
1 |
|
17 |
|
3. Пікринова кислота |
12 |
|
10 |
|
4. Гліцерин |
13 |
|
1 |
|
5. Вініловий спирт |
2 |
|
15 |
|
6. Ароматичний спирт |
20 |
|
16 |
|
7. Фенолет натрію |
16 |
|
18 |
|
8. Нітробензол |
18 |
|
8 |
|
9. Етилат натрію |
19 |
|
19 |
|
10. Ацетон |
6 |
|
2 |
|
11 .Етиленгліколь |
3 |
|
13 |
|
12.Метанол |
14 |
|
9 |
|
13.Оцтова кислота |
15 |
|
11 |
|
14.Хлорбензол |
10 |
|
20 |
|
15.Чи бувають спирти газоподібними? |
9 |
|
3 |
|
іб.Чи реагують спирти з ме...? |
7 |
|
6 |
|
17. Діетиловий ефір |
11 |
|
12 |
|
18.Оцтовий альдегід |
5 |
|
7 |
|
19.Бензол |
17 |
|
5 |
|
20.Пропанол |
4 |
|
14 |
|
СИСТЕМА ОЦІНЮВАННЯ |
|
|
|
|
КІЛЬКІСТЬ ПРАВИЛЬНИХ ВІДПОВІДЕЙ |
С |
>ЩГО |
|
|
20 |
|
12 |
|
|
19 |
|
11 |
|
|
18 |
|
10 |
|
|
17-16 |
|
9 |
|
|
15-14 |
|
8 |
|
|
11-13 |
|
7 |
|
|
9-Ю |
|
6 |
|
|
7-8 |
|
5 |
|
|
5-6 |
|
4 |
|
|
3-4 |
|
3 |
|
|
1-2 |
|
2 |
|
ДОДАТОК №2
Тести
1) Дати визначення речовинам:
- СгНзОН
- С4Н9ОН
- С2Н5ОК
- С2Н5-О-С2Н5
За кожну правильну відповідь - 0,5 б. - всього 26.
2) Закінчити речення:
- Ізомером пропанолу є...
- Ізомером етанолу є...
- Етанол можна отримати з...
- Метанол можна отримати з...
-
Внаслідок внутрішньо молекулярної дегідрації з етанола можна
отримати... - Загальна формула спирту...
За кожну правильну відповідь - 16. - всього - 66.
№3
ОБРАТИ ПРАВИЛЬНУ ВІДПОВІДЬ Під час взаємодії спирту з карбоновою кислотою виникає: А) простий ефір Б) сіль
В) складний ефір За кожну відповідь - 16.
№4
Властивість характерна для гліцерину та фенола: А) взаємодіють з лугами Б) не розчиняються у воді В) мають низьку температуру плавлення За кожну відповідь - 16. - всього - 106.
ЩАТОК №3
ПИТАННЯ АНКЕТИ
1. З яких джерел ти дізнався про алкогольні напої вперше?
А) від друзів; В) через пресу;
Б) від батьків; Г) через телебачення
2. Чи вважаєш ти, що алкоголь - отрута?
А) так; Б) ні
. Чи знаєш ти хвороби, якими страждають люди, що зловживають алкоголем?
А) так; Б) ні
\. Чк сумісні алкоголь та спорт?
А) так;
І) » Ні
5. Твоє ставлення до алкоголю?
А) позитивне; В) негативне
6. Як часто ти вживаєш спиртні напої? А) один раз у житті; Б) кілька раз;
Б) у свята: і 'і часто
ДОДАТОК №5 ДИСПУТ Питання до обговорення:
-
Алкоголь - отрута, ворог. Звідки з'явився цей ворог, з чого почався
потяг людей до алкоголю? -
Алкоголь - соціальне зло! Який вплив має алкоголь на організм
людини? -
Які міри використовуються для попередження алкоголізму, боротьби з
пияцтвом? -
Чи правильна думка про те, що алкогольні напої мають лікувальні
властивості? - Хімія оп'яніння.
- Алкоголь та нащадки.
- Алкоголь та виробництво.
- Алкоголь та родина.
Під час диспуту використовуються естрадні мініатюри, пісні. Естрадна мініатюра « Пішла геть, проклята».
Лектор у ВНЗ розповідає про шкідливість горілки ( на столі стоїть пляшка з надписом «Горілка», до неї прив'язана біла нитка). Лектор: Іванов, Ви зрозуміли, чому не можна пити? Іванов: Не зовсім!
Лектор: Як? Так через неї, проклятої, родини розпадаються, діти народжуються каліками, людина перетворюється на тварину, падає виробництво праці!
Іванов: Так це через тебе, проклята, всі ці біди! Пішла геть! ( Дивиться на пляшку, в цей час асистент непомітно за нитку прибирає пляшку) Пісня на мотив « Детство, детство, тьі куда спешишь» - співають учні.
Рассказать хотим сегодня всем,
Что не нужно водку пить совсем.
От алкоголя много всем вреда,
И пьющих много он сведет с ума. Припев: А мьі хотим, а мьі хотим опять
Учиться, жить и о любви мечтать. Здоровьім бьіть, всегда вперед идти И с нами Вам, конечно, по пути.
ДОДАТОК № 6 Залікові листи учнів
Достатній (7-96.) - 596. Середній (4-66.) - 20-396.
|
№ етап У |
Вид навчальної діяльності |
Дидактична форма |
Час (Хв. ) |
Максимальна кількість балів |
Кількіст ь реально набрани х балів |
|
1. |
Робота за копитником (робота у парах) |
Встановлення відповідності між формулою та назвою |
5 |
10 |
|
|
2. |
Тестування |
Відповіді на питання |
5 |
10 |
|
|
3. |
Робота за хімічним диском |
Диференційована самостійна робота за рівнями А,Б,В- |
5 |
10 |
|
|
4. |
Відтворення опорних конспектів |
Самостійна робота за варіантами |
5 |
11 |
|
|
5. |
Рішення розрахункови х задач |
Диференційована самостійна робота за рівнями ІДІДИ |
8 |
5 |
|
|
6. |
Хімічний експеримент |
Робота в групах |
9 |
6 |
|
|
7. |
Захист творчих робіт |
Робота в групах |
6 |
5 |
|
|
8. |
Робота в групах за завданнями |
Групова форма роботи біля дошки |
9 |
3 |
|
|
9. |
Анкетування учнів |
Анкетування та аналіз анкет |
10 |
|
|
|
10. |
Диспут |
Виклад думок, логіка, висновки |
20 |
5 |
|
|
11. |
Загальна кількість балів |
|
|
|
|
|
12. |
Ваш рівень знань |
|
|
|
|
Максимальна кількість балів - 65 Високий рівень (10-12 б.) - 60-656. Низький (1-36.)-1-196.
ДОДАТОК Д
Тема: «Роль хімії та фізики в житті людини».
Тип уроку: науково-практична конференція. Урок розрахований на 90 хвилин (два уроки по 45 хвилин).
Цілі:
1.Освітні:
• активізувати пізнавальну діяльність учнів на уроці;
• узагальнити знання учнів про речовини та їх агрегатні стани, вплив на організм людини;
• закріпити вміння учнів пояснювати фізичні і хімічні процеси на основі МКТ і хімічної будови;
• показати значення деяких речовин в природі та житті людини.
2.Розвиваючі:
• Розвивати вміння застосовувати свої знання для пояснення конкретних явищ;
• розвивати уміння виділяти головне і складати тези;
• продовжити формування логічного мислення;
• розвивати інтерес до предметів природничо - наукового циклу;
• розвивати усне мовлення;
• продовжити формування переконаності учнів про можливості пізнання законівт природи шляхом розкриття розуміння явища, фактів .
3.Виховні:
• формування культури спілкування;
• розвиток самостійності.
Головна проблема уроку: Інтеграція знань за допомогою методу проектів призводить до більш зацікавленого, особистісно значимого і осмисленого сприйняття цих знаннь, що посилює мотивацію і активність залучення учнів у навчальний процес. Кожне проектно-орієнтоване завдання являє собою тісно пов'язаний ланцюжок окремих актів у діяльності школярів. Це дозволяє їм розглядати проблему проекту в різних режимах мислення, що природним чином вимагає інтеграції знань, які при предметному навчанні учень отримував дискретно.
Обладнання:
комп'ютери, мультипроектор, диски, лабораторне обладнання, плакати, стенд, газети, реактиви, висловлювання відомих людей, фізичні прилади.
Методи і прийоми для розвитку мислення учнів;
1. навчальна гра;
2. наочний (демонстрація фрагменту фільму «Вода», презентації, таблиці, схеми)
3. практичний (проведення експерименту)
Форма проведення уроку: науково-практична конференція.
Епіграфи уроку:
1. Думати легко, діяти важко. Діяти згідно з тим, як думаєш, найскладніше в світі» .Гете.
2. « Мої учні дізнаються про нове не від мене; вони відкривають це нове самостійно. Моє головне завдання - допомогти їм розкритися. М. Писталлоци.
3.« Фізика - це наука яка відповідає на питання чому».
Річард Фейман.
4. Природа - це книга, яку потрібно прочитати та правильно зрозуміти.....
Л.Л.Налбануям
5 .«Хімія - це найскладніша фізика»
Д.И.Менделеев
6. « Роби велике, не обіцяючи великого».
Піфагор
7.« Щастя дістається тому, хто багато працює».
Леонардо да Вінчі
8. . «Посів науковий зійде для жнив народних» .
Д.И.Менделеев.
План-схема уроку.
|
№ п\п |
Етапи уроку |
Діяльність учителя |
Діяльність учнів |
час |
Результати |
|
1. |
Організація. |
Знайомство з цілями і завданнями уроку. |
Усвідомлення своєї діяльності на уроці. |
2 хв. |
Створення сприятливого психологічного клімату в класі. |
|
2. |
Введення в тему,актуалізація опорних знань |
Презентація основних напрямкив теми (з точки зору хімії та фізики).Постанова проблемних питань.
|
Відповіді на проблемні питання,перегляд слайдів. |
5 хв. |
формування загальної картини, що ілюструє взаємозв'язки основних напрямів теми. |
|
3. |
Мотивація навчальної діяльності учнів. |
Показ фільму "Хімія і фізика навколо нас". |
Перегляд фільму і розуміння цілісного уявлення про роль хімії і фізики в житті людини. |
10хв. |
Сформувати загальне уявлення про роль хімії та фізики для людини. |
|
4. |
Розминка. |
Контролюють відповіді, проводять потокове оцінювання роботи учнів. |
Відповідають на питання розминки. |
8хв. |
Розвиток інтересу до предметів природничого циклу. |
|
5. |
Ознайомлення з новим матеріалом (сприймання та усвідомлення знань) |
Представлення міні-проектів. |
Виступ груп з презентаціями. |
30 хв. |
Формування переконаності учнів про можливості пізнання закону природи шляхом розкриття розуміння явищ, фактів навколишнього світу. |
|
6. |
Рефлексія після виступу кожної групи. |
Координує обговорення проектів. |
Ставлення до виступу (запитання, пояснення, думки, побажання). |
7 хв. |
формування культури спілкування; розвиток самостійності. |
|
7. |
Творче завдання для кожної групи-вивести формулу кохання |
Спостереження за роботою груп. |
Виконання творчого завдання. |
На протязі уроку. |
Розвиток уміння працювати творчо,формування комунікативної компетенції. |
|
8. |
Захист творчої роботи груп |
Оцінювання результатів роботи,коментарі. |
Виступ груп з презентаціями робіт. |
10хв. |
Здатність мислити і пацювати творчо,висловлювати свою думку, вміння застосовувати свої знання для пояснення конкретних явищ; |
|
9. |
Підсумок уроку.
|
Підводить підсумки за допомогою методу «Прес..!»
|
Роблять підсумки за матеріалом конференції,пропонують буклети, пам'ятки . |
10хв. |
розвиваток уміння виділяти головне і складати тези; формування логічного мислення. |
|
10. |
Загальна рефлексія.
|
Проводить дискусію. |
Відповідають на питання. |
5хв. |
вміння застосовувати свої знання для пояснення конкретних явищ; формування культури спілкування;вміння аналізувати,робити висновки,систематизувати інформацію. |
|
11. |
Домашнее задание |
Підготовка домашнього завдання з хімії та фізики. |
Розуміння виконання домашнього завдання. Оформлення матеріалів у шкільну газету «45+перемінка». |
3хв. |
більш глибоке вивчення матеріалу. |
Хід уроку:
1. Вчитель фізики:
Сьогоді урок ми проводимо трохи в незвичній формі, тому що ми будемо говорити про людину з точки зору фізики і хімії. Здається, що ми знаємо про людину все, але є багато фактів і явищ, які не всім відомі. Пояснити нез'ясовне ми не зможемо, але використовую знання, отримані на уроках і під час самостійної роботи, спробуємо зорієнтуватися у великому потоці інформації, вивести формулу успіху,формулу любові. Наша мета сьогодні не змагання, що важливе - фізика, або хімія.
Слова « серце», « енергія» асоціюються з фізикою, а кров, плазма - це хімія.
Вчитель хімії :
Протягом усієї історії науки фізика і хімія розвивалися в тісному зв'язку. І хімія та фізика - це науки, що виникли для вирішення практичних потреб людини, і благородної їх метою є служіння людству. Сьогодні наша науково-практична конференція пройде під девізом “хімія і фізика - це науки, що визначають науково-технічний прогрес. ”
Перед тим, як почати доводити девіз конференції, вам, молоді фізики і хіміки, необхідно відповісти на деякі питання та отримати творче завдання.
Протягом уроку вам належить вивести формулу любові тому, що саме любов робить людину людиною. Доведіть що це велике почуття - результат складних фізико-хімічних перетворень в організмі людини.
А тепер з першим питанням до вас звертається всесвітньо відомий вчений, лауреат Нобелівської премії Лайнус Полінг:
1. Якби в результаті якої-небудь світової напасті були знищені всі наукові закони і теорії, то який закон або теорія лягли б в основу нових відкриттів і чому? ( відповіді учнів)
2. Чи згодні ви з твердженням Ломоносов “ хімія і фізика - дочірні науки?” Доведіть. ( відповіді учнів)
Розминка:
1. Яку силу розвиває серце людини?( 70-90 хв)
2. Як називаються речовини, що змінюють швидкість реакції, але не входять
до складу продуктів реакції? ((Каталізатори)
3. Який об'єм крові перекачує серце за добу? (6000 л.)
4. Масова частка кисню в повітрі ? (21%)
5.Наведіть приклади важелів у людини? (руки , ноги, щелепи, пальці.)
6. Назвіть число Авогадро (6,02 * 10(23))
7. Маса якої тканини в людині найбільша? ( м'язова, 43%)
8. Метал, назва якого в перекладі з латинської - “ранкова зоря”?
( золото)
9.Яка вологість повітря для людини є оптимальною? (40-60%)
10.Аллотропічна видозміна вуглецю ? (алмаз)
11.Сердце космонавта працює в умовах невагомості з меншою затратою
Енергії, ніж на Землі. Чому? (відсутній вага, а значить і вагове тиск, що припадає відразу долати на Землі)
2. Газ із запахом свіжості - аллотропічна видозміна кисню (озон)
3. Яку кількість чистого кисню необхідно людині протягом доби ? (700гр)
1.Ведучий :
• Проблеми, які нам необхідно вирішити сьогодні об'єднують в собі фізико-хімічний зміст.
Отже , ми запрошуємо групу фізиків і хіміків, які працюють над темою “Вода - найцінніший мінерал”.
(Учні захищають проект, проводять експерименти, які показують фрагмент фільму “Вода”)(додаток 1)
2.Ведучий:
• Останнім часом ми часто читаємо і чуємо це слово в засобах масової інформації. Так само з'явилося багато реклами, що пропонує купити щось з приставкою “нано”
А що це таке?
Слово надається групі фізиків і хіміків, які працюють над проблемою “ Людина , мобілки і нанотехнології”
(Учні захищають проект) (додаток № 2)
1.Ведущий:
• Ну що, сильна стать, романтики Ви? Квіти, цукерки, вірші, гумор - це про вас? Або, крім пробірок, склянок і приладів нічого не визнаєте? Ні ! Фізики та хіміки - теж лірики! І ми запрошуємо групу, яка доведе і покаже нам, це незаперечний факт!
(Танець “ Кохання ”, пісня “Фізика, хімія і Любов, сценки, розповіді про дивовижні випадки з життя вчених - додаток № 3)
2. Ведучий:
• Прорив у космос, пришестя космічного століття - аж ніяк не випадковість і не примха людської винахідливості, людство було приведено до космонавтики всією сумою своїх матеріальних і духовних потреб. Космонавтика пронизує сьогодення та спрямована в майбутнє.
Група , яка працює над проблемою “ Людина і космос” здійснить екскурсію у світ космосу і покаже його вплив на організм людини.
( Учень захищає проект.)(додаток № 4)
1.Ведучий:
• Вітаємо всих, хто практикує магію і чаклунство! Чудові перетворення подивитися сьогодні нам пропонують вчені. Вони розкажуть вам про дивовижні науки - фізику і хімію з точки зору чудес і перетворень.
(Група експериментаторів пропонують цікаві
досліди)(додаток № 5)
Вчитель:
• Настав час кожній групі захистити свою творчу роботу “ Формула кохання”. ( Представники груп захищають свою формулу роздають буклети.)
Підсумки уроку:
1.Ведучий:
Без хімії життя, повірите, немає.
Без хімії став би тьмяним весь світ.
З хімією їздимо, живемо і літаємо,
У різних точках землі живемо.
Чистимо , стираємо, виводимо плями.
Спимо і їмо, і з зачісками ходимо.
Хімією лікуємося, творимо і шиємо,
З хімією дружно живемо пліч-о-пліч!
Так що всі ми без неї пропадемо,
Якщо значення її не зрозуміємо.
2.Ведучий:
Фізика потрібна!
Фізика важлива!
Без неї не зробити нам ні кроку!
Як з берези отримати папір?
Як мобільний телефон
Перетворити в магнітофон?
Як отримати незатухаюче багаття?
Як зробити розумний натирач?
Як побачити мікросвіт?
Як створити нам новий світ?
І паралельні світи нам відвідати?
Як заглянути в інші часи?
Як в невагомості зростити нам насіння?
Відповідь одна - тут фізика потрібна!
Вчи її - і ти станеш розумним,
Досягнеш з нею кар'єрних висот!
Вчитель:
Ми впевнені, що аналізуючи почуте, ви отримали відповіді на багато питань, відкрили в собі дослідників, вчених. Немає меж людському розуму, немає меж його можливостей! Вмійте бачити і дивуватися!
Проводиться оцінювання виконаної роботи.
Загальна рефлексія.
1. Які цілі ставили ви перед собою?
2. На скільки відсотків виконали поставлені перед собою цілі?
3. Що допомогло виконувати, а що заважало?
4. Ваш внесок у загальну справу?
5. Чи були події, які змінили ваші погляди?
6. Які знання і досвід придбали?
7. Якби ви знову почали працювати, як би ви це робили?
форми контролю й оцінки результатів уроку.
• значимість і актуальність висунутих проблем, адекватність їх досліджуваної тематики;
• коректність використовуваних методів дослідження та методу обробки одержаних результатів;
• активність кожного учасника проекту відповідно до його індивідуальних можливостей;
• колективний характер прийнятих рішень;
• характер спілкування і взаємодопомоги, взаємодоповнюваності учасників проекту;
• необхідна і достатня глибина проникнення в проблему, залучення знань з інших областей;
• доказовість прийнятих рішень, вміння аргументувати свої висновки;
• естетика оформлення результатів виконаного проекту;
• вміння відповідати на запитання опонентів, лаконічність і аргументованість відповідей кожного члена групи.
10. Домашнє завдання.
1.Оформлення матеріалів у шкільну газету «45+перемінка;
Література:
-
Алексашина И. Интегративный подход в естественнонаучном образовании // Народное образование. - 2001. - №1. - С.161-164.
2. Архипова Т. Межпредметные связи: в чём их актуальность // Учитель (Россия). - 2001. - №4. - С.34-36.
3. Арцишевська М. Суспільствознавча картина світу як теоретична основа інтеграції змісту шкільної освіти // Шлях освіти. - 2000. - №3. - С.16-20.
4. Банарик Н.Б. У пошуках моделі інтегрованого уроку // Всесвітня література. - 1997. - №7. - С.11.
5. Бицюра Ю. Інтегрована система навчання // Завуч (Перше вересня). - 2002. - №16. - С.10-11.
6. Гончаренко С., Мальований Ю. Інтегроване навчання: за і проти // Освіта. - 1994. - 16 лютого. - С.3.
7. Елагина В.С. Профессиограмма деятельности учителей естественнонаучных дисциплин по реализации межпредметных связей в обучении школьников // Наука и школа. - 2002. - №2. - С.24-30.
8. Жилин В., Подольникова Л. Игровая ситуация: интегрирование дисциплин // Учитель. - 2002. - №1. - С.22-24.
9. Іванчук М.Г. Інтеграція як наукова категорія // Педагогіка і психологія. Вісник АПН України. № 2 (43) - К., 2004. - С.23-31.
10. Іванчук М.Г. Міжособистісна взаємодія в умовах інтегрованого підходу до навчання // Неперервна професійна освіта: теорія і практика. Науково- 11.Козловська І.М., Собко Я.М. Принципи дидактики в контексті інтегративного навчання // Педагогіка і психологія. - 1998. - №4. - С.48-51.
12. Кучменко Н.Г. Интегрированный подход в обучении естественным наукам // Завуч. - 2002. - №5. - С.59-66.
13.Степанюк А.В., Гадюк Т.В. Інтеграція природничих дисциплін у школі // Педагогіка і психологія. - 1996. - №1. - С.18-24.
ДОДАТОК Е
![]()
![]()
![]()
![]()
![]() Білозерська загальноосвітня школа
Білозерська загальноосвітня школа
І - III ступенів №18
Добропільської міської ради
Донецької області
Урок з хімії в 8 класі
Тема: «Генетичний зв’язок між
класами неорганічних сполук»
Учитель хімії
Цимбаленко О.М.
2022 р.
Мета: систематизувати та узагальнити знання учнів про склад, назви, класифікацію неорганічних речовин; виявити взаємозв’язок хімічних властивостей основних класів неорганічних сполук; формувати поняття про генетичний зв’язок між класами неорганічних сполук та генетичні ланцюги між класами неорганічних сполук та відповідні рівняння хімічних реакцій; розвивати уміння критично мислити, порівнювати, систематизувати, узагальнювати, робити логічні висновки
Тип уроку: систематизація знань, умінь і навичок, урок-тренінг.
Форми роботи: бесіда, робота біля дошки, індивідуальна робота, демонстрація, лабораторний дослід
Обладнання: роздатковий матеріал, таблиця «Основні класи неорганічних сполук», реактиви і посуд згідно з інструкціями до хімічного експерименту
І. Організаційний етап
Добрий день! Я дуже рада зустрічі з вами. І привід для зустрічі у нас приємний. По-перше, знову урок хімії. По-друге, наближається до закінчення вивчення основних класів неорганічних сполук і на останніх уроках будемо пожинати плоди, які зростили у цьому семестрі. По-третє, урок наш відбуватиметься у формі тренінгу. І, по-четверте, у нас на уроці присутні ще й гості. І мені здається, що ми зможемо порадувати себе та один одного: знаннями, оцінками, а може, і ще щось знайдемо.
ІІ. Перед вами лежить аркуш паперу. Дайте відповіді на поставлені запитання словами, схемами та малюнками
|
Ваше ім’я: |
||
|
З чим ви себе асоціюєте в хімії |
Ваші досягнення в хімії |
Ваші труднощі в хімії |
|
|
|
|
ІІІ. Вивчаючи тему «Основні класи неорганічних сполук», ми вже ознайомилися з їх класифікацією (стенд). Давайте пригадаємо ці класи та запишемо загальні формули:
Отже,
Метод «Знаємо – хочемо дізнатися – дізналися»
|
Знаємо |
Хочемо дізнатися |
Дізналися |
|
Основні класи неорганічних сполук: оксиди, кислоти, основи, солі |
Як пов’язані між собою основні класи неорганічних сполук?
|
|
Ми вже знаємо, що…
- Бінарні сполуки, один з елементів в якій Оксиген, називаються …
Чому дорівнює валентність Оксигену в оксидах? (ЕхОу)
- Складні речовини, які складаються з атомів Гідрогену і кислотного залишку – це … (НхКЗ)
За чим визначається валентність кислотного залишку?
- Складні речовини, до складу яких входять атоми металу і кислотного залишку, називаються … (Ме(ОН)х)
Якою валентністю володіє гідроксогрупи?
- Складні речовини, що складаються з атомів металу і кислотного залишку, називаються … ( Мех(КЗ)у )
Під час вивчення властивостей речовин ми також з’ясували, що за допомогою відповідних хімічних реакцій з речовин одного класу можна добути речовини інших класів.
Сьогодні на уроці ми повинні остаточно розібратися з такою проблемою: який зв’язок існує між класами неорганічних сполук.
Давайте cпробуємо розшифрувати тему уроку
|
Сполуки |
Оксиди |
Кислоти |
Основи |
Солі |
|
1. Ферум (ІІІ) оксид |
г |
н |
м |
ж |
|
2. Сульфітна кислота |
а |
е |
о |
у |
|
3. Хром (ІІІ) гідроксид |
р |
п |
н |
л |
|
4. Барій ортофосфат |
н |
о |
у |
е |
|
5. Силікатна кислота |
о |
т |
ж |
й |
|
6. Натрій сульфід |
д |
п |
м |
и |
|
7. Ферум (ІІ) гідроксид |
у |
і |
ч |
ь |
|
8. Йодидна кислота |
м |
н |
к |
с |
|
9. Алюміній бромід |
а |
а |
б |
и |
|
10. Літій оксид |
й |
й |
х |
ф |
ГЕНЕТИЧНИЙ
IV.Постановка проблеми:
Розгляньте схему і скажіть, як ви зрозуміли поняття генетичний зв’язок?
Генетичний зв’язок – зв’язок між класами неорганічних сполук, оснований на добуванні речовин одного класу з речовин іншого класу.
У перекладі з грецької генетичний означає – такий, що стосується походження, вивчає розвиток чого-небудь (міжпредметні зв’язки з біологією)
V. Первинне закріплення інформації.
1. Давайте спробуємо виразити генетичний зв’язок між класами неорганічних сполук, прослідкувавши генетичний ряд МЕТАЛУ та НЕМЕТАЛУ (якого Ме та Е?)…

2. Завдання. Скласти генетичні ланцюги згідно схеми. Підкріпити рівняннями реакцій.
VІ. Закріплення вивченого матеріалу
Розв’язування вправ.
Учням пропонується роздатковий матеріал із переліком завдань.
- 1. Здійснити перетворення:
- Na → Na2O → NaOH → NaNO3;
- S → SO2 → H2SO3 → K2SO3 ;
- Al → Al2O3 → AlCl3 → Al(OH)3 → NaAlO2 .
2. Експериментальна задача:
NaOH → Na2SO4 → BaSO4.
CuSO4 → Cu(OH)2 → CuCl2
ІІ. «Хімічний лабіринт» (слайди 3, 4, 5 із презентації «Генетичний зв’язок»)
Пройти лабіринт, знайти ключове слово, підкріпити відповідними рівняннями реакцій. Вмотивувати свій вибір «шляху».
VI. Підсумок уроку
- Які зв’язки існують між класами неорганічних сполук?
- Які ж НАБУТІ ЗНАННЯ нам допоможуть справитися з будь-яким генетичним перетворенням?
«Кулька – хімічні проблеми»
(кожен записує свою проблему, яку потрібно вирішити для успішного розв’язування любої хімічної задачі).
Висновок: Разом ми здатні розв’язати усі проблеми
VII. Д/з:«Подарунок другові» - підготувати схему перетворень.
ДОДАТОК К
![]()
![]()
![]()
![]()
![]() Білозерська загальноосвітня школа
Білозерська загальноосвітня школа
І - III ступенів №18
Добропільської міської ради
Донецької області
Урок з хімії у 8 класі
Тема: «Основні класи неорганічних сполук»
Учитель хімії
Цимбаленко О.М.
2022 р.
Самостійна робота для перевірки знань з класифікації неорганічних сполук, номенклатури, фізичних властивостей
Мета: Сформувати поняття про швидкість хімічної реакції; розглянути фактори, які впливають на швидкість хімічної реакції: природа реагуючих речовин, температура, концентрація, поверхню зіткнення реагуючих речовин, каталізатори та інгібітори.
Розвивати: Продовжити розвивати в учнів уміння пов'язувати вже отриманні знання із новою інформацією, новим матеріалом, вміння аналізувати та виділяти головне, основне у вивченому матеріалі.
Виховувати: Виховання відповідального ставлення учнів до навчання, прагнення до творчої, пізнавальної діяльності.
Тип уроку: Самостійна робота для перевірки та закріплення знань.
Обладнання: комп’ютер, мультимедійний проектор.
І варіант
1. Вкажіть ряд речовин, в якому наведено тільки оксиди:
|
А) K2SO4, MgO, Fe2O3; |
Б) Al2O3, SiO2, HNO3; |
В) SO2, SO3, CO2; |
Г) N2O, CO, Ca(OH)2 |
2. Позначте формулу оксиду, в якому Нітроген виявляє валентність ІІІ:
|
А) NO; |
Б) N2O3; |
В) NO2; |
Г) N2O5 |
3. Вкажіть ряд, в якому наведено тільки оксигеновмісні кислоти:
|
А) сульфатна, нітратна, хлоридна; |
Б) флуоридна, сульфідна, бромідна; |
|
В) сульфітна, фосфатна, силікатна; |
Г) нітритна, сульфідна, фосфітна; |
4. Позначте формулу кальцій сульфату:
|
А) Ca(SO4)2; |
Б) Ca2SO4 ; |
В) CaSO4; |
Г) K2SO4 |
5. Позначте назву основи:
|
А) калій хлорид; |
Б) натрій гідроксид; |
В) алюміній сульфат; |
Г) магній оксид |
6. Позначте назву речовини, що має формулу H3PO4:
|
А) фосфор оксогідрата; |
Б) фосфор гідрат; |
В) гідроген фосфід; |
Г) ортофосфатна кислота; |
7. Позначте формули солей:
|
А) HCl; |
Б) H2SO4; |
В) NaOH; |
Г) KCl; |
Д) Na2SO4; |
Е) AlI3 |
8. Позначте правильні твердження про кислоти:
|
А) всі кислоти містять у своєму складі Оксиген; |
Г) до складу молекули кислоти входить тільки один атом Гідрогену; |
|
Б) більшість кислот використовують у вигляді розчинів; |
Д) у розчині кислоти можна виявити за допомогою індикатора; |
|
В) всі кислоти солодкі на смак; |
Е) у присутності кислот фенолфталеїн набуває синього кольору |
9. Встановіть відповідність між назвою речовини та її хімічною формулою:
|
Назва речовини |
Формула |
|
А |
Б |
В |
Г |
|
1.сульфатна кислота; |
A.K2SO3; |
1 |
|
|
|
|
|
2. сульфітна кислота; |
Б. H2SO4; |
2 |
|
|
|
|
|
3. калій силікат; |
В. K2SO4; |
3 |
|
|
|
|
|
4. калій сульфат; |
Г. K2SiO3; |
4 |
|
|
|
|
|
|
Д. H2SO3 |
|
|
|
|
|
10.Обчисліть і вкажіть масу кальцій карбонату кількістю речовини 0,4 моль
11. Обчисліть та вкажіть кількість речовини нітратної кислоти масою 378г
12 Знайдіть густину азоту за воднем
ІI варіант
1. Вкажіть ряд речовин, в якому наведено тільки гідроксиди:
|
А) K2SO4, MgO, Fe2O3; |
Б) Al(OH)3, KOH, NaOH; |
В) SO2, SO3, CO2; |
Г) N2O, CO, Ca(OH)2 |
2. Позначте формулу оксиду, в якому Нітроген виявляє валентність V:
|
А) N2O3; |
Б) NO2; |
В) NO; |
Г) N2O5 |
3. Вкажіть ряд, в якому наведено тільки безоксигенові кислоти:
|
А) флуоридна, сульфідна, бромідна; |
Б) сульфітна, фосфатна, силікатна; |
|
В) нітритна, сульфідна, фосфітна; |
Г) сульфатна, нітратна, хлоридна |
4. Позначте формулу калій сульфату:
|
А) K2SO3; |
Б) CaSO4; |
В) Ca(SO4)2; |
Г) K2SO4 |
5. Позначте назву кислоти:
|
А) натрій гідроксид; |
Б) калій хлорид; |
В) хлорид на кислота; |
Г) алюміній сульфат |
6. Позначте назву речовини, що має формулу NaOH:
|
А) натрій оксогідрата; |
Б) натрій гідроксид; |
В) натрій фосфід; |
Г) натрій гідрид |
7. Позначте формули кислот:
|
А) H2SO4; |
Б) NaOH; |
В) AlI3 |
Г) Na2SO4; |
Д) HCl; |
Е) KCl; |
8. Позначте правильні твердження про гідроксиди:
|
А) всі кислоти містять у своєму складі Оксиген; |
Г) до складу молекули кислоти входить тільки один атом металу; |
|
Б) більшість гідроксидів мaлинового кольору; |
Д) у розчині гідроксиди можна виявити за допомогою індикатора; |
|
В) всі луги милкі на дотик; |
Е) у присутності кислот фенолфталеїн набуває синього кольору |
9. Встановіть відповідність між назвою речовини та її хімічною формулою
|
Назва речовини |
Формула |
|
А |
Б |
В |
Г |
|
1.сульфатна кислота; |
A.K2SO3; |
1 |
|
|
|
|
|
2. калій сульфіт; |
Б. H2SO4; |
2 |
|
|
|
|
|
3. калій гідроксид; |
В. KОН |
3 |
|
|
|
|
|
4. сульфідна кислота; |
Г. K2SiO3; |
4 |
|
|
|
|
|
|
Д. H2SO3 |
|
|
|
|
|
10. Обчисліть і вкажіть масу кальцій гідроксиду кількістю речовини 0,6 моль
11. Обчисліть та вкажіть кількість речовини сульфатної кислоти масою 378г
12 Знайдіть густину хлору за киснем.
Перевірка. Учні обмінюються зошити і виконують взаємоперевірку.


про публікацію авторської розробки
Додати розробку
