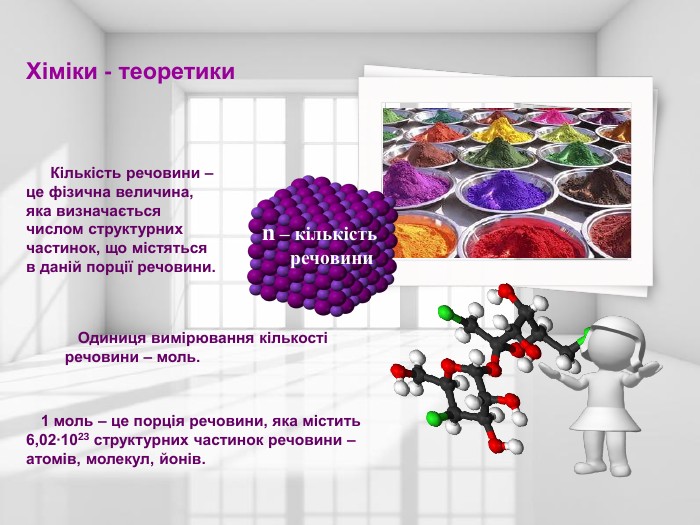
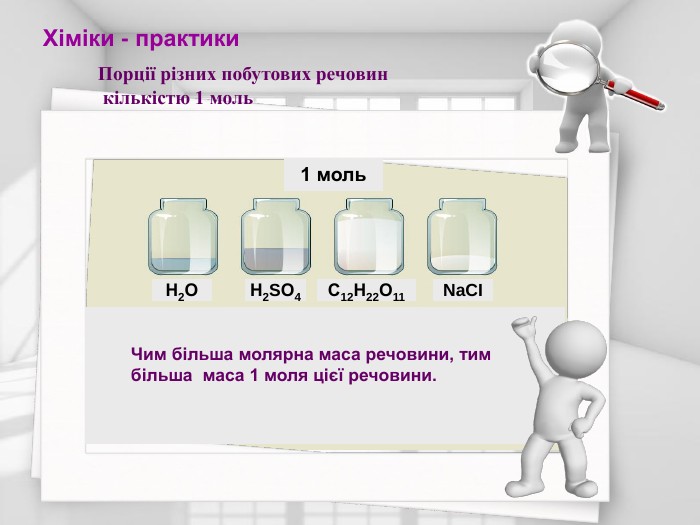
Проект - презентація для учнів 8 класу з теми " Кількість речовини. Розрахунки за хімічними формулами"
Про матеріал
Проект - презентація для учнів 8 класу для узагальнення і систематизації знань. Допоможе учням повторити і узагальнити знання з вивченої теми. Презентація цікава, доступна і може бути використана для проведення дистанційних уроків. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку