Проєкт "Анілін – основа для виробництва барвників"





![Взаємодія з водою Реакція окиснення. Анілін на повітрі швидко окиснюється. При окисненні аніліну сумішшю калій дихромату К2 Сr2 O7 і концентрованої сульфатної кислоти утворюється барвник чорного кольору – чорний анілін. Анілін горить на повітрі кіптявим полум’ям:4 C6 H5 NH2 + 31 О2 → 24 СО2 + 4 N2 + 14 H2 O. Розчинність аніліну у воді незначна. У водному розчині аніліну майже немає йонів ОН– індикатори в ньому не змінюють свого забарвлення: C6 H5 NH2 + H+ → [C6 H5 NH3]+. йон феніламонію Взаємодія з водою Реакція окиснення. Анілін на повітрі швидко окиснюється. При окисненні аніліну сумішшю калій дихромату К2 Сr2 O7 і концентрованої сульфатної кислоти утворюється барвник чорного кольору – чорний анілін. Анілін горить на повітрі кіптявим полум’ям:4 C6 H5 NH2 + 31 О2 → 24 СО2 + 4 N2 + 14 H2 O. Розчинність аніліну у воді незначна. У водному розчині аніліну майже немає йонів ОН– індикатори в ньому не змінюють свого забарвлення: C6 H5 NH2 + H+ → [C6 H5 NH3]+. йон феніламонію](/uploads/files/4062092/366581/422321_images/8.jpg)










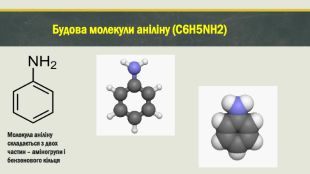
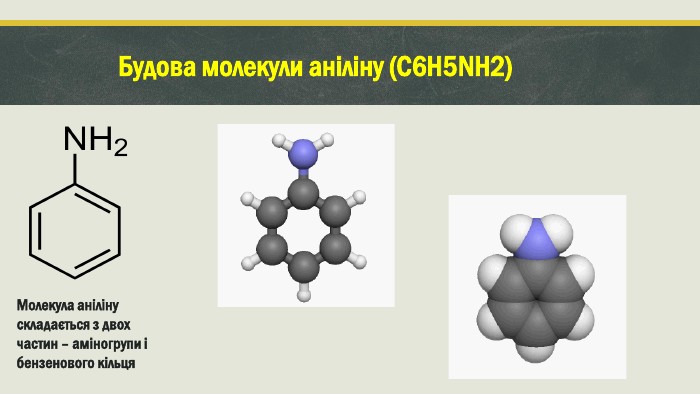
Мета проєкту : Ознайомитися з аніліном як представником нітросполук, дати уявлення про будову молекули аніліну; розглянути фізичнi та хімічні властивості аніліну, способи його одержання й застосування. План проєкту : Що таке анiлiн ?Iсторiя створення анiлiну Будова молекули анiлiну та його вигляд Властивостi анiлiну Добування та застосування анiлiну Висновок
Історія створення аніліну Анілін вперше був ізольований Отто Унвердорбеном шляхом піролітичної дистиляції індиго та описаний 1826 році. Через здатність утворювати кристалічні сполуки з кислотами він отримав назву "Кристалін " , також автор зазначив, що ця сполука "пахне сильно, подібно до свіжого меду”. У 1834 році Фрідліб Рунге отримав анілін шляхом дистиляції кам'яновугільної смоли над оксидом міді й назвав його "Кіанол " , або "Блакитна олія" , бо отриманий продукт утворював із хлорним вапном стабільні сполуки блакитного кольору. У 1840 році Карл Юліус Фріцше додав індиго в розчини їдкого калі та їдкого натру, а отриману після дистиляції сполуку назвав "Анілін " У 1842 році Микола Зінін відновив нітробензен сірчистим амонієм (реакція Зініна); шляхом подальшої дистиляції він отримав олію, яку назвав "Бензідам ". Зінін зазначив, що ця речовина "малорозчинна у воді, але змішується зі спиртом та ефіром", "має доволі гострий присмак, особливий запах, сполучається з усіма оксигеновмісними й безоксигеновими кислотами". У 1845 році А. В. Гофман ідентифікував продукти Фріцше й Зініна як ідентичні, віддавши перевагу терміну "Анілін "; він також описав реакцію відновлення нітробензену до аніліну за допомогою водню (цинк + кислота). З 1897 року Баденська анілінова та содова фабрика використовує анілін у великих масштабах для синтезу індиго (синтез Гемана). Анілін також використовувався для синтезу багатьох інших барвників, тому його назва поширилася у назви інших сполук та навіть промислових термінів: аніліновий пурпур (став барвником, що поклав основу аніліновій фарбовій промисловості), анілінова шкіра (шкіра, що пофарбована розчинними пігментами, тому має фарбу по всьому об'єму, а не тільки на поверхні), аніліновий друк (друга назва флексографічного друку).
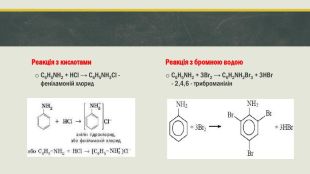
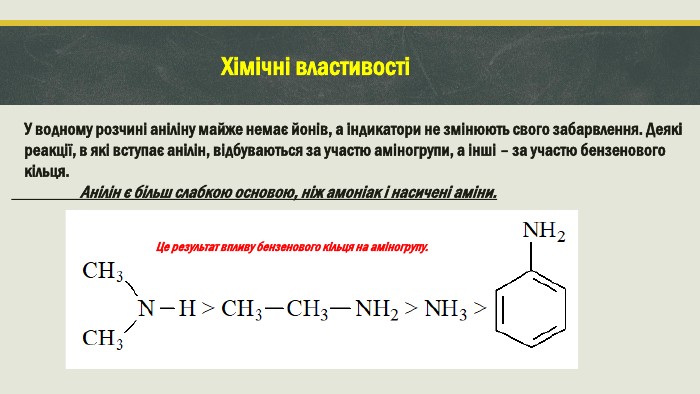
Хімічні властивості У водному розчині аніліну майже немає йонів, а індикатори не змінюють свого забарвлення. Деякі реакції, в які вступає анілін, відбуваються за участю аміногрупи, а інші – за участю бензенового кільця. Анілін є більш слабкою основою, ніж амоніак і насичені аміни. Це результат впливу бензенового кільця на аміногрупу.
Взаємодія з водою Реакція окиснення. Анілін на повітрі швидко окиснюється. При окисненні аніліну сумішшю калій дихромату К2 Сr2 O7 і концентрованої сульфатної кислоти утворюється барвник чорного кольору – чорний анілін. Анілін горить на повітрі кіптявим полум’ям:4 C6 H5 NH2 + 31 О2 → 24 СО2 + 4 N2 + 14 H2 O. Розчинність аніліну у воді незначна. У водному розчині аніліну майже немає йонів ОН– індикатори в ньому не змінюють свого забарвлення: C6 H5 NH2 + H+ → [C6 H5 NH3]+. йон феніламонію
Добування Анілін є найважливішим аміном. Його добувають у промисловості відновленням нітробензену C6 H5 NO3: C6 H5 NO2 + 3 Н2 C6 H5 NH2 + 2 Н2 О Нітробензен Анілін Добування аніліну відновленням нітробензену вперше здійснив в 1842 р. Микола Миколайович Зінін. Діючи на нітробензол амоній сульфідм, він одержав анілін: C6 H5 NO2 + 3(NH4)2 S → C6 H5 NH2 + 6 NH3 + 3 S + 2 H2 O
Відкрите М. М. Зініним перетворення ароматичних нітросполук в аміни дало початок новій епосі у хімічній промисловості і стало поштовхом для бурхливого розвитку промисловості органічного синтезу, особливо анілофарбової і фармацевтичної промисловості.«Якщо б Зінін не зробив нічого більше, крім перетворення нітробензензолу в анілін, то і тоді його ім’я залишилось би записаним золотими буквами в історії хімії», – так закінчив свою промову, присвячену пам’яті М. М. Зініна, в 1880 р. президент німецького хімічного товариства, засновник анілофарбової промисловості А. Ф. Гофман.
Застосування Головна галузь застосування – синтез барвників і лікарських засобів. Анілінові барвники застосовують для фарбування натуральних волокон (льону, бавовни, шовку, вовни), штучних тканин, синтетичних та змішаних матеріалів. Анілін застосовується також для синтезу вибухових речовин, високомолекулярних речовин (анілоформальдегідних смол), прискорювачів вулканізації каучуків.
Анілінова промисловість Аніліно-барвиста промисловість дозволила відмовитися від дефіцитної та дорогої природної сировини (індиго, марена, кошеніль, пурпур). Спочатку анілінові барвники використовувалися в основному в текстильній промисловості, і в 1913х споживання становило 1 1,9 тис. т. Виробництво було зосереджено переважно в Німеччині
Шкідливий вплив аніліну Анілін впливає на центральну нервову систему, спричиняє кисневе голодування організму за рахунок утворення в крові метагемоглобіну, гемолізуючи дегенеративних змін еритроцитів. В організм анілін потрапляє під час дихання, у вигляді парів, а також крізь шкіру та слизові оболонки. У разі легкого отруєння аніліном спостерігаються слабкість, головний біль, синюшність губ, вушних раковин і нігтів. У випадку отруєнь середньої тяжкості також спостерігаються нудота, блювота, іноді хитання під час ходьби, частішання пульсу. Тяжкі випадки отруєння є вкрай рідкими. У разі хронічного отруєння аніліном виникають токсичний гепатит, нервово-психічні розлади, розлади сну, погіршення пам'яті тощо.
Чорний Характеризується глибоким, соковитим чорним кольором, на фоні якого особливо яскраво виглядає колір інших барвників. Жоден з чорних барвників не може порівнятись з ним в цьому відношенні. Має високу стійкість до світла і прання, але недостатньо стійкий до гладіння; Процес фарбування досить неприємний через високу токсичність аніліну. Широко застосовується у фарбуванні бавовняних тканин, хутра.
Метиленовий синій Метиленовий синій застосовують для фарбування бавовни, шерсті, шовку в яскраво-блакитний колір, але фарба слабостійка до світла. Метиленовий синій використовується в якості антисептика, антидота при отруєнні цианідами, чадним газом та сiрководнем. Маються дані про високу эффективність ціеї сполуки при лікуванні хвороби Альцгеймера.


про публікацію авторської розробки
Додати розробку