Проект на тему " Вода "
9 - КЛАС
ВОДА
![]() Проект
Проект
Учасники проекту: учні 9-го класу.
Тип проекту: пошуково-творчий.
Термін роботи:2 місяці.
Актуальність проекту як навчальної технології:
В основі проекту лежать інтереси учнів .Участь у ньому забезпечує розвиток умінь вирішувати значущі в пошуковому,творчому плані проблеми, що потребує інтегрованих знань , дослідницького пошуку для її розвязання.
Мета і завдання проекту :
Поглибити знання учнів про природу , показати взаємозв язок між природничими науками ; систематизувати й узагальнити знання про речовини ,поглибити їх за рахунок відомостей про властивості води ( лабораторні досліди). Дослідити якість води в смт. Піщанка за показниками постійної твердості та вмісту в ній нітратів;розглянути види її забруднень та методи очищення.Розробити рекомендації щодо очищення питної води в домашніх умовах.
Розвивати вміння учнів будувати промову , виступати перед аудиторією,чітко інтерпретувати результати досліджень ; удосконалювати вміння ефектно використовувати засоби електронних комунікацій.
Виховувати бережливе ставлення до природи , та економне використання води.
План роботи над проектом:
- Постановка проблеми .
- Визначення теми і мети проекту.
- Ознайомлення учнів із суттю проекту та основними етапами його реалізації.
- Робота з інформаційними ресурсами.
- Звіти творчих груп.
- Презентація проекту.
Структура проекту
Ключове запитання :
У чому універсальність води ?
Тематичні завдання :
- Провести огляд теоретичних основ хімії води( будова молекули , фізичні та хімічні властивості ).
- Дослідити якість води у смт. Піщанка за показниками постійної твердості та вмісту нітратів.
- Розглянути види забруднень води.
- Визначити доступні ти економічно доцільні методи очищення питної води в домашніх умовах.
Очікувані результати :
- Формування в учнів умінь працювати з додатковою літературою, систематизовувати матеріал , робити висновки.
- Удосконалення вмінь готувати доповіді й виступати з ними.
- Розвиток умінь працювати в команді.
Фрагменти презентації «Вода».
Напрями дослідження :
- Поширеність у природі .
- Будова молекули води.
- Фізичні властивості води.
- Хімічні властивості води.
- Вода в житті людини.
- Види забруднень води.
- Твердість води та її усунення.
- Визначення твердості води та вмісту нітратів у питній воді нашого смт . Піщанка .
- Методи очищення води в домашніх умовах.
- Висновок.
Звіти груп :
- Поширеність у природі.
Вода – найпоширеніша сполука на нашій планеті. Вона вкриває понад 2/3 поверхні Землі. Приблизно 97% усієї води – вода морів , річок , океанів. Прісна вода – 3%. Вода в природі постійно рухається , здійснюючи кругообіг. Його рушійною силою є Сонце , а головним джерелом води – Світовий океан. Кругообіг – природний процес відтворення прісної води, природна фабрика дистиляції. Розгляньте таблицю «Кругообіг води у природі».
Вода бере участь практично в усіх процесах, що забезпечують життєдіяльність організмів на нашій планеті. Без цієї речовини неможливе існування тварин , рослин , мікроорганізмів і ,звичайно людини.
Вода в незначній кількості міститься в атмосфері , причому – у трьох агрегатних станах : газуватому , рідкому , твердому. Випадаючи на земну поверхню , атмосферні опади (дощ ,сніг ) захоплюють із собою пил , деякі розчинені гази і в такий спосіб очищують повітря.
- Будова молекули води.
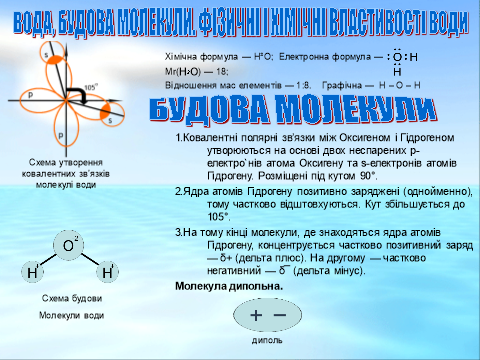
Хімічна формула води H2O , це молекулярна речовина .
Електронна і графічна формули молекули води
H : O : H – O
H H
вказують на те , що два атоми Гідрогену сполучені з атомом Оксигену простими ковалентними зв’язками . Кожний зв'язок у молекулі води утворений s-електроном атома Гідрогену і одним р-електроном атома Оксигену . Два р-електрони атома Оксигену , які беруть участь у цих зв’язках , є неспареними й перебувають у різних орбіталях . Оскільки р-орбіталі зорієнтовані перпендикулярно одна одної, молекула води має кутову будову. Кут між зв’язками молекули води дорівнює 104,5*. Молекула води – диполь : та частина молекули , де знаходиться Гідроген , заряджена позитивно , а частина , де знаходиться Оксиген - негативно. Завдяки полярності молекули води електроліти в ній дисоціюють на йони. Отже , молекула води електронейтральна.
- Фізичні властивості.
Чиста вода – прозора рідина без смаку й запаху. У тонких шарах вона безбарвна , а в товщі має блакитний колір. Вона - єдина сполука , яка може перебувати одночасно в трьох агрегатних станах : у вигляді льоду , рідини й пари.
За температури 0 С вода переходить у твердий стан – лід, а за температури 100 С вона перетворюється на пару, за нормальних умов є рідиною. Максимальна густина води – 1/см3 за 4 С. Вода має високу теплоємність і малу теплопровідність.
Лабораторний дослід № 1 «Розчинність речовин у воді».
Учні перевіряють на розчинність у воді певні речовини і результати досліду заносять у таблицю :
|
|
Розчинність речовин у воді |
|
||
|
№ |
Розчинна речовина |
Спостереження |
||
|
1 |
Крейда |
|
||
|
2 |
Кухонна сіль |
|
||
|
3 |
Цукор |
|
||
|
4 |
Олія |
|
||
|
5 |
Гліцерин |
|
||
|
6 |
Мідний купорос |
|
||
Записати спостереження і висновки у зошит.
Чому вода є гарним розчинником ?
- Хімічні властивості води.
Вода – це надзвичайно важлива сполука , виявляє достатню хімічну активність . Реагує з багатьма речовинами – і простими , і складними:
1) з металами
Ме( Na Li Ca Ba Mg) + H2O --- Me(OH)n + H2|
Me ( Zn Fe ) + H2O --- MenOm + H2|
Me (Cu Ag Au) + H2O ---- не реагують
Лабораторний дослід №1 «Взаємодія металічного натрію (калію) з водою.»
- Наповність кристалізатор водою;
- У нього обережно опустіть шматочок металічного натрію (калію);
- Після припинення бурхливої реакції до продуктів реакції додайте кілька крапель фенолфталеїну.
- 2 Na + 2 H2O = 2 NaOH + H2
- Які зміни відбуваються під час реакції ?
- Який газ утворився в результаті взаємодії ?
- Якого кольору став розчин після додавання розчину індикатора та про що це свідчить ?
( Записати спостереження і висновки у зошит ).
2) з оксидами металів :
Na2O + H2O = 2 NaOH ;
BaO + H2O = Ba(OH)2 ;
Лабораторний дослід №2 « Взаємодія негашеного вапна з водою .»
- У пробірку насипте порошок кальцій оксиду та долийте води ;
- До утвореного розчину додайте кілька крапель розчину фенолфталеїну ;
- CaO + H2O = Ca(OH)2 ;
- Що спостерігаємо під час доливання води до негашеного вапна?
- Які зміни відбулися після додавання розчину фенолфталеїну й чому ?
( Записати спостереження і висновки у зошит .)
3) з оксидами неметалів
SO3 + H2O = H2SO4 ;
P2O5 +3 H2O = 2 H3PO4;
Лабораторний дослід № 3 “ Взаємодія вуглекислого газу з водою.»
- Добуваємо вуглекислий газ при взаємодії кальцій карбонату і хлоридної кислоти .
- Добувший вуглекислий газ пропускаємо крізь воду і до отриманого розчину добавляємо кілька крапель розчину метилового оранжевого .
CO2 + H2O =H2CO3 ;
- Які зміни відбулися у пробірці після додавання розчину індикатора.
- Про що це свідчить ?
(Записати спостереження і висновки у зошит )
4)Розклад води
Вода дуже стійка проти нагрівання , але за високої температури(2000 С) або під дією постійного електричного струму вона розкладається:
2H2O = 2H2 + O2;
5)Електролітична дисоціація
Дослідити електричну провідність дистильованої води; води з крану , з криниці ; водний розчин кухонної солі .
- Вода в житті людини.
Кругообіг води – винятково важливий процес. Він забезпечує сушу прісною водою, яка постійно оновлюється. Заміна води в річках відбувається в середньому 30 разів на рік , тобто кожні 12 діб. Волога яка міститься в грунті , оновлюється за 1 рік . Води проточних озер повністю обмінюються за десятки років , а непроточних – за 200 – 300 років . Води Світового океану оновлюються в середньому за 3000 років.
Людина використовує воду практично скрізь :
- Як хімічну сировину воду використовують для одержання водню, кисню , кислот ,лугів , різних органічних сполук .
- Як розчинник вона використовується в різних галузях промисловості (хімічна промисловість , металургійні підприємства , текстильні фабрики , цукрові й крохмале –патокові заводи ),у будівництві ,транспорті .
- Використовують воду в парових двигунах ,системах охолодження й опалення .
- Найбільше воду використовують в побуті , а також для зрошення полів , садів .
- Широко використовується вода в хімії як каталізатор.
Вода є найважливішою біологічною рідиною , необхідною для процесів життєдіяльності живих організмів :травлення кровообігу , розмноження .
Жодна рідина у світі не має такої кількості корисних якостей ,як
вода . Саме тому вона застосовується в усіх галузях промисловості .
Для побутових потреб людина використовує воду з річок , озер або підземних джерел . Природна вода ніколи не буває чистою .
Крім розчинних домішок , вона містить тверді частинки піску , глини , рештки рослин і тварин , різноманітні мікроорганізми .
Тому природну воду перед уживанням очищують.
6. Забруднення води поділяють:
1) фізичне;
2) хімічне ;
3) біологічне;
4) теплове .
Фізичне забруднення виникає внаслідок збільшення у воді нерозчинних домішок – піску , глини , намулу за рахунок змиву дощовими водами з розораних ділянок (полів) ,надходження суспензій з діючих підприємств гірничорудної промисловості , пилу .
Хімічне забруднення води відбувається за рахунок надходження у водойми зі стічними водами різних шкідливих домішок неорганічного (кислоти , луги , мінеральні солі ) і органічного походження (нафта й нафтопродукти , миючі засоби , пестициди ).
Біологічне забруднення водойм полягає в надходженні зі стічними водами різних мікроорганізмів (бактерій , вірусів ) ,спор , грибків і т. д.,багато з яких є хвороботворними для людей , тварин і рослин .
Теплове забруднення води спричиняється спуском у водойми підігрітих вод з ТЕС , АЕС та інших енергетичних установок . Тепла вода змінює термічний і біологічний режим водойм і шкідливо впливає на їх мешканців .
7.Твердість води - це природна властивість води , обумовлена присутністю в ній розчинних солей Кальцію і Магнію .
|
Характеристика |
Тимчасова твердість або карбонатна |
Постійна твердість або некарбонатна |
|
Причини твердості
|
Наявність розчинених гідрогенкарбонатів Mg і Ca; Мg(HCO3)2 Ca(HCO3)2 |
Наявність сульфатів , хлоридів або деяких інших солей Ca , Mg (CaSO4 , MgSO4) |
|
Джерела твердої води |
Річкові й озерні води ,водопровідна вода , різні газовані мінеральні води . |
Морська вода , вода солоних озер , природні негазовані мінеральні води . |
|
Усунення твердості |
При кип’ятінні ,при додаванні кислот або соди. |
Не усувається при кип’ятінні , але зникає при додаванні соди , іонообмінних смол . |
8.Визначення твердості води та вмісту нітратів у питній воді нашого смт. Піщанка за 2011- 2012 р..
Джерела децентралізованого водопостачання:
Твердість води 11-26,8 ммоль/дм3 ;
Нітратів у воді 55-173 мг/дм3 ;
Джерела централізованого водопостачання :
Твердість води 11,1-15 ммоль/дм3;
Нітратів у воді 97- 118 мг/дм3;
Ці показники не відповідають встановленим стандартам ( твердість води повинна бути – 10 ммоль/дм3 ; вміст нітратів у воді -50 мг/дм3 ).
Отже , нами було виявлено , що вода нашої місцевості не відповідає стандартам якості : твердість води є високою , наявний надлишок нітратів . Проте , попри все це , ми щодня використовуємо цю воду для задоволення власних потреб . Кожен з нас розуміє , що таке використання призводить до того , що ми власноруч завдаємо шкоди нашому здоров’ю .
9.Чиста вода – це запорука нашого здоров’я .
У домашніх умовах , ми можемо вжити певних заходів , що допоможе нам зменшити негативний вплив забрудненої води на наше здоров’я .Ці заходи досить прості , але більшість із нас не вживає їх . Вода , яку ми споживаємо , на перший погляд , є достатньо чистою , а отже , не викликає у нас ніяких застережень і , відповідно , бажання очистити її .
Є кілька способів , що можуть допомогти нам у домашніх умовах зробити воду більш безпечною для нашого здоров’я . Ці способи справді прості , тому користуватися ними має змогу майже кожен бажаючий .
1-й спосіб – це відстоювання . Потрібно всього лише відстояти воду певний час . Після цього значна кількість речовин осяде .
2-й спосіб – це кип’ятіння . Достатньо прокип’ятити воду (хоча б 5 хв.) та дати їй відстоятися певний час , щоб в осад випали малорозчинні карбонати . Таким чином можна позбутися тимчасової твердості .
3-й спосіб – за допомогою активованого вугілля . Вода буде чистішою, наприклад , після того , як її пропустити крізь шар марлі , у який вміщено активоване вугілля .
4-й спосіб – використання фільтрів. Їх видів сьогодні достатньо. Є фільтри різного дизайну та різної ціни.
Перші три способи є найбільш економічно вигідними. Вони не спричиняють великих витрат. Використання фільтрів тягне за собою перелік грошових витрат , але очищення води таким способом є найефективнішим з тих, що можна здійснювати в домашніх умовах.
- Висновки
- Вода – основна біологічна рідина й універсальний розчинник.
- Вода – безцінний природний дарунок, необхідний для всього живого на Землі .
- Запаси прісної води на Землі обмежені (приблизно 3% від загальної маси).
- Закріпили знання про фізичні та хімічні властивості води провівши відповідні лабораторні досліди.
- Дослідили якість води в смт. Піщанка за показниками постійної твердості та вмісту в ній нітратів .
- Розробили рекомендації щодо очищення питної води в домашніх умовах.


про публікацію авторської розробки
Додати розробку
