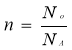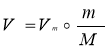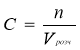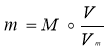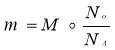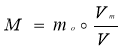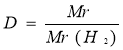Розробка "РОЗВ’ЯЗУВАННЯ ХІМІЧНИХ ЗАДАЧ З ВИРОБНИЧИМ ЗМІСТОМ"
Міністерство освіти і науки України
Кам’янець-Подільський фаховий коледж будівництва, архітектури та дизайну
РОЗВ’ЯЗУВАННЯ ХІМІЧНИХ ЗАДАЧ З ВИРОБНИЧИМ ЗМІСТОМ


Викладач
Ольга Владика
м. Кам’янець-Подільський
2023 рік
Обговорено та схвалено на засіданні циклової комісії
технологічних дисциплін
Протокол № __ від ______
Голова ЦК _______ Юлія Лонська
Автор-упорядник:
Владика Ольга Іванівна, викладач хімії Кам’янець-Подільського фахового коледжу будівництва, архітектури і дизайну.
Зміст анотації
Посібник містить теоретичне обґрунтування методики розв’язування хімічних задач виробничого змісту, що застосовуються викладачем при викладанні хімії, приклади запитань та задач до конкретних тем та розділів. Крім того, у посібнику вміщено довідникові таблиці та матеріали. Призначений для студентів закладів фахової перед вищої освіти та викладачів хімії спеціальності 192 Будівництво та цивільна інженерія.
ЗМІСТ
Вступ
1.Значення хімічних задач виробничого змісту у формуванні професійних компетентностей
2.Приклади запитань і завдань з виробничим змістом
3.Приклади хімічних задач з виробничим змістом
Висновки
Список використаних джерел
Додатки
Вступ
Інтеграція України в європейський та світовий освітній простір викликала необхідність переглянути деякі підходи до навчання. Згідно з Національною доктриною розвитку освіти у XXI столітті, «головна мета української системи освіти — створити умови для розвитку самореалізації кожної особистості України, формування покоління, здатного вчитися протягом життя, створювати і розвивати цінності громадянського суспільства».
Одним із пріоритетів державної політики в розвитку освіти є подолання прірви між освітою та життям, компетентнісне ставлення особистості до життя. Основними структурними компонентами навчальної діяльності студентів є:
• мотиваційний — ставлення до навчання;
• змістовий — відомі та нові знання, уміння,навички;
• процесуальний — способи виконання діяльності на різних рівнях складності.
Щоб мати можливість знайти своє місце в житті, студент повинен володіти певними якостями:
- гнучко адаптуватися в життєвих ситуаціях;
- самостійно і критично мислити;
- грамотно працювати з інформацією (вміти збирати потрібні факти, аналізувати їх, висувати гіпотези для розв'язання проблем, робити необхідні узагальнення, зіставлення з аналогічними або альтернативними варіантами розв'язання, встановлювати статистичні закономірності, робити аргументовані висновки, використовувати їх для розв'язання нових проблем);
- уміти самостійно працювати над розвитком особистого морального, інтелектуального, культурного рівня.
Однією з основних вимог сучасної освіти є формування гнучкого, нестандартного мислення, притаманного творчій особистості. Одним із засобів для досягнення цього є розрахункові задачі.
Розрахункові задачі посідають особливе місце у вивченні хімії. Систематичне їх розв'язування сприяє свідомому засвоєнню хімічних знань, формуванню логічного мислення, розвитку розумових здібностей, навчає практично використовувати набуті теоретичні знання. Хімічні задачі сприяють формуванню системи конкретних уявлень, що необхідно для осмисленого сприйняття теоретичного матеріалу. Задачі, що включають певні хімічні ситуації, стають стимулом до самостійної роботи студентів над навчальним матеріалом, а в процесі розв'язування задач виховується працелюбність, цілеспрямованість, почуття відповідальності, наполегливості у досягненні поставленої мети. Під час розв'язування задач реалізуються міжпредметні зв'язки з фізикою, математикою, біологією, екологією та іншими навчальними дисциплінами. Зв'язок знань і дій є основою формування прийомів мислення.
1.Значення хімічних задач виробничого змісту у формуванні професійних компетентностей
У загальноосвітній і професійній підготовці студентів важлива роль належить задачам виробничого змісту. Розв'язуючи такі задачі, студенти підвищують дієвість знань, їх зв'язок з життям. Застосування в навчанні задач виробничого змісту сприяє формуванню пізнавального інтересу до хімії, усвідомленню її ролі в житті суспільства. Наприклад, уміння застосовувати знання для розв'язування практичних завдань, виконувати розрахунки із застосуванням хімічних формул і рівнянь, аналізувати, порівнювати, узагальнювати й робити висновки, складати раціональний план дій, користуватися підручниками, довідниками, таблицями є основою професійних навичок спеціалістів будівельного профілю. Для випускника коледжу, який володіє поряд із загальнохімічними і технічними знаннями системою вмінь, процес професійної адаптації до праці в сфері будівельного виробництва проходитиме швидко й успішно.
Використання на заняттях задач виробничого змісту не завжди дає належний навчально-виховний ефект. Умови задач часто перевантажуються позапрограмним матеріалом, не враховуються індивідуальні особливості студентів, зокрема їхні здібності, темп роботи, наявні знання.
Під час розв'язування задач виробничого змісту домінують репродуктивні види пізнавальної діяльності студентів, коли вони виконують дії або за зразком, що його показує викладач, або за допомогою інструкцій. Репродуктивні методи необхідні на початкових етапах навчання, але ними не можна обмежуватись, оскільки це гальмує розвиток самостійності студентів, уміння застосовувати знання на практиці.
У методичній літературі з питань використання хімічних задач не приділяється достатньої уваги проблемам поетапного формування у студентів інтелектуальних та спеціальних умінь, запровадженню продуктивних методів навчання, диференційованого підходу при розв'язуванні задач. Збірники задач і посібники здебільшого містять застарілі дані, позапрограмну інформацію, не вживану сьогодні номенклатуру речовин і одиниць їх вимірювання.
Під час розв'язування задач виробничого змісту студенти відчувають труднощі, оскільки їм доводиться оперувати великими числами, виконувати досить громіздкі обчислення з використанням незвичних одиниць вимірювання (тонн, кубічних метрів тощо).
Загальноосвітні предмети мають слугувати не лише базою для вивчення у майбутньому спеціальних дисциплін, а й безпосередньо сприяти закладанню основ професійної підготовки студентів.Значний інтерес до матеріалу, який вивчається, виникає у студентів тоді, коли встановлюються внутрішньо предметні і між предметні зв’язки. Це сприяє розвитку зацікавленості до предмету, технічного мислення, професійного виховання студентів у процесі навчання.
Міжпредметні зв’язки допомагають викладачам швидше і глибше заохотити студентів до вивчення дисципліни, забезпечують взаємозв’язок одного предмета з іншим, що мають схожий зміст, привчають студентів до думки, що знання із спеціальних дисциплін і загальноосвітніх предметів становлять єдине ціле в їх майбутній професії.
Оскільки пізнавальний інтерес студентів, що бачать у будівельній професії своє майбутнє, в основному направлений на оволодіння спеціальності, навчальний матеріал лише тоді привертає їхню увагу, коли вони бачать його практичну значимість.
Однією із форм здійснення зв’язків хімії з виробництвом є розв’язування задач з виробничим змістом. Вміло підібрані і складені задачі при продуманій методиці розв’язання відіграють велику роль в отримані міцних знань із предмету. На прикладі розв’язування цих задач разом із теоретичними знаннями вони глибше усвідомлюють практичну значущість хімії в освоєнні майбутньої професії, бо формування хімічних понять у них відбуваються на основі конкретних прикладів, взятих з життя чи виробництва. Студенти знайомляться з елементами технічного розрахунку, переконуються у тому, що знання з хімії допомагають їм вирішувати практичні задачі.
Матеріал зі встановлення зв’язку хімії з фізикою, матеріалознавством, електротехнікою є у програмованому матеріалі предмету «Хімія».
2.Приклади запитань і завдань з виробничим змістом
В курсі матеріалознавства студенти вивчатимуть властивості металів і сплавів, тому, починаючи вивчення теми «Загальні відомості про метали» у курсі хімії слід звернути увагу на структуру металів, їх фізичні властивості.
Для встановлення між предметних зв’язків слід запропонувати такі запитання:
1.Що обумовлює пружність, міцність, пластичність, твердість, корозійне стійкість, в’язкість металу?
2.Дайте характеристику властивостей металів. Розкажіть про теплопровідність, тугоплавкість, магнітні властивості металів.
3.Вкажіть значення фізичних властивостей у промисловості.
4.Розкажіть про хімічні властивості металів. Вкажіть значення корозійної стійкості металів у промисловості.
5.Яка властивість міді особливо цінна для електротехніки?
6.Які фізичні властивості є особливо цінними:
- Алюмінію для електротехніки;
- Титану для сучасної авіаційної техніки.
7.Який метал найбільш легкоплавкий і у зв’язку з цим використовується у фізичних приладах; які з цих приладів можна зустріти у побуті?
8.Який метал найбільш тугоплавкий і у зв’язку з цим використовується у світлотехніці?
9.Чи можна нитку розжарення електролампочок виготовляти з міді, а електричний дріт, що проводить струм – з вольфраму?
Вивчаючи тему «Неметалічні елементи» важливо вказати студентам на практичне використання вуглецю у хіміко-технічній обробці сталі. На питання
- Які способи обробки сталі застосовують з метою покращення якості сталі?
- Які властивості сталі змінюються при насиченні вуглецем?
студенти дадуть відповідь більш детально, опанувавши знання з технології виготовлення металів.
При вивченні теми «Природні джерела вуглеводнів» слід загострити увагу на одержанні мастильних матеріалів та на їх практичному застосуванні у виробництві, використання мінеральних масел як рідких діелектриків. Слід вказати, що нафтові мастила діляться на три групи:
1.Мастила для високовольтних трансформаторів і високовольтних вимикачів.
2.Кабельнеі мастила, що застосовуються для просочення паперової ізоляції високовольтних кабелів.
3.Конденсаторні мастила, що застосовуються для просочення паперової ізоляції конденсаторів.
Завдання з хімії з виробничим змістом можна використовувати на всіх етапах заняття у самостійній та індивідуальній роботі, при закріпленні матеріалу, при поясненні нової теми, при перевірці та оцінюванні знань.
Розділ «Загальні відомості про метали» у хімії тісно пов'язаний із спецдисциплінами майбутніх будівельників, особливо при вивченні теми «Сучасні силікатні матеріали», «Солі». Після вивчення тем студенти зможуть дати відповіді на запитання:
1.Чому виробники-будівельники називають негашене вапно «кипілою», а гашене –«тушонкою»?
2.Чому гашене вапно зберігають у закритій тарі?
3.Яке хімічне перетворення відбувається з гашеним вапном у нових цегляних будинках?
4.На що перетворюється гашене вапно при тривалому зберігання на повітрі?
5.Як можна переконатись, що невідома речовина – негашене вапно?
6.Для грунтовки стін та стелі використовують розчин мідного купоросу. Чи можна готувати їх у залізних відрах?
7.На складі була пошкоджена партія алюмінієвих деталей через те, що проводили побілку гашеним вапном, а деталі були не захищені від випадкових крапель. Чим пояснити руйнування деталей? Напишіть рівняння окисно-відновної реакції, що відбулась при цьому.
Вивчення теми «Метали і сплави» у курсі хімії пов’язане із темою «Виробництво чавуну і сталі» з матеріалознавства, яку вивчатимуть студенти на старших курсах. Варто запропонувати виконати такі завдання:
1.Яка з руд містить найбільшу масову частку Феруму: червоний залізняк чи магнітний залізняк?
2.Чому при загартовуванні підвищується міцність і твердість сталі?
3.Чи має крихкість чавун, сталь і бронза? Крихкість – це хороша чи погана властивість?
4.З якою метою вироби зі сталі та чавуну перед відправкою до споживачів змащують спеціальними маслами – тавотом і солідолом?
Вивчення теми «Сучасні силікатні матеріали» тісно пов’язане із темами дисципліни «Матеріалознавство». Сировиною для силікатної промисловості служить природний кремнезем, силікати, глина. З метою закріплення знань з теми можна запропонувати такі завдання:
1.Напишіть формули звичайного скла, тугоплавкого скла, кварцового скла.
2.Які керамічні вироби застосовують у побуті, будівельній техніці, у хімічній промисловості?
3.На складі підприємства є цементна суміш, що містить 35% цементу (решта – пісок). У яких кількісних співвідношеннях слід змішати її і чистий цемент, щоб утворилась суміш, яка містить 75% цементу?
4.Чому при нагріванні і охолодженні залізобетонних конструкцій залізо у них не відділяється від бетону?
5.Які властивості бетону лежать в основі його застосування?
6.Силікатна цегла готується з білого піску і гашеного вапна, і являє собою зерна кварцу зцементовані кальцій силікатом. Напишіть рівняння реакцій, що відбуваються при цьому.
7.Який хімічний процес відбувається при затвердінні на повітрі вапняного розчину, який застосовують у зведенні будівель із силікатної цегли?
3.Приклади хімічних задач з виробничим змістом
Тип задач «Обчислення за хімічними рівняннями маси одного з добутих продуктів за масою вихідної речовини, що містить певну кількість домішок».
1.Який об’єм вуглекислого газу може бути поглинутий гашеним вапном, маса якого 100 кг, а вміст домішок 10%?
2.Обчислити масу негашеного вапна, що утвориться при випалюванні 1 кг вапняку, масова частка домішок у якому становить 25%.
3.Який об’єм вуглекислого газу утвориться при прожарюванні 10 т крейди, що містить 20% домішок?
4.Обчислити масу заліза, яку можна одержати із 10 т магнітного залізняку, що містить 20% домішок.
5.Яку масу магнітного залізняку необхідно переробити у доменній печі, щоб добути 300 т чавуну, який містить 97% заліза?
.Який об’єм ацетилену (за н.у.) може бути одержаний із 10 кг кальцій карбіду, що містить 10% домішок?
6.Кальцій карбід доставляється споживачам у барабанах місткістю 130 кг. Який об’єм ацетилену (н.у.) виділиться із одного барабану карбіду, який містить 80% СаС2? Який об’єм кисню необхідний, щоб використати цю кількість ацетилену у газовому пальнику для зварювання?
Тип задач «Обчислення виходу продукту реакції у відсотках від теоретично можливого».
1.Обчислити масу негашеного вапна, яка необхідна для одержання 35 кг гашеного вапна, якщо масова частка виходу становить 75% від теоретично можливого.
2.Із 10 тонн вапняку при випалюванні можна одержати 4 т негашеного вапна. Визначити масову частку виходу продукту від теоретично можливого.
3. Для отримання 1 тонни вапна, що містить 85% кальцій оксиду, витрачено 1,7 т вапняку із вмістом кальцій карбонату 95%. Обчислити масову частку виходу продукту від теоретично можливого.
Тип задач «Обчислення за рівняннями реакцій маси продукту реакції за масою вихідної речовини, що містить певну кількість чистої речовини».
1.Обчислити масу гашеного вапна, що утвориться при дії необхідної кількості води на 1 т негашеного вапна, що містить 90% кальцій оксиду.
2.У результаті прожарювання крейди, масова частка кальцій карбонату у якій 90% одержали 22 т вапна. Обчисліть масу крейди, яку було завантажено у піч.
3.Яку масу вапняку, що містить 80% кальцій карбонату, необхідно взяти для одержання 100 т негашеного вапна?
Тип задач «Обчислення за термохімічними рівняннями».
1.При «гасінні» 14 кг вапна виділилось 16720 кДж теплоти. Складіть термохімічне рівняння реакції.
2.При випалюванні вапняку на розкладення кожного моля кальцій карбонату витрачається 177, 650 кДж тепла. Яка кількість теплоти потрібна для реакції розкладу 20 кг вапняку, масова частка домішок у якому 5%?
3.При «гасінні» вапна кожен моль кальцій оксиду виділяє 67,790 кДж теплоти. Назвіть тип даної реакції і обчисліть кількість теплоти, що виділиться при «гасінні» 100 кг вапна, масова частка домішок у якому 20%.
4.При згорянні 89,6 л ацетилену виділилось 2595,78 кДж теплоти. Складіть термохімічне рівняння реакції.
5.При згорянні 89,6 л ацетилену (н.у.) виділилось 2598,3 кДж теплоти. Складіть термохімічне рівняння цієї реакції.
Тип задач «Обчислення масової частки елемента у складній речовині».
1.Азбест (3MgO*2SiCO3*2H2O) широко використовують як будівельний вогнетривкий матеріал. Розрахуйте: а) масову частку силіцію у азбесті; б)кількість магнію у центнері азбесту.
2.Обчисліть масові частки оксидів, які входять до складу віконного скла.
3.Для підвищення міцності будівельного матеріалу до негашеного вапна додають 2% гіпсу і 25%меленого піску. Визначте вміст силіцій (IV) оксиду у 100 кг даної суміші.
4.Для склеювання скла і металу зі склом і порцеляною використовується замазка, до складу якої входить 10 г нежирного сиру, 2 г гашеного вапна, 5 г води. Розрахуйте: а) масу сиру і вапна для виготовлення 200 г замазки; б)масову частку кальцію у даній замазці.
Експериментальні задачі, які розв’язують на заняттях хімії, як і розрахункові, можуть мати виробничий зміст:
1.Негашене вапно часто містить у вигляді домішок вапняк і пісок. Як виявити у ньому ці домішки?
2.Здійсніть реакції, за допомогою яких можна відрізнити чистий кальцій карбід від крейди.
3.Чи можна гасити палаючий газ, який горить над кальцій карбідом, водою? Відповідь обґрунтуйте.
4.Добутьте ацетилен. Доведіть дослідним шляхом, що одержаний газ – ацетилен.
5.У трьох пробірках знаходиться порошки: крейда, натрій карбонату, магній карбонату. В усі пробірки додайте кілька крапель хлоридної кислоти. Складіть рівняння реакцій у молекулярному та йонному виді.
6.Здійсніть практично наступні перетворення:
- CO32- → CO2
- Fe0 → Fe2+
Ускладнені задачі і вправи вимагають від студентів знань матеріалу кількох тем. У цих задачах також може прослідковуватись виробничий зміст.
1.При прожарюванні гіпсу CaSO4*2H2O до 1800С одержують алебастр 2CaSO4*H2O, що застосовується для виготовлення розчинів для штукатурки. Визначте: а)масову кальцію в гіпсі і алебастрі; б)масу гіпсу, який необхідний для одержання 6 т алебастру.
2.Обчисліть масу кальцій оксиду у вапні, одержаному при випалюванні 50 т вапняку, масова частка кальцій карбонату в якому становить 80%, якщо виробничі втрати становлять 7%.
3.Визначте об’єм ацетилену (н.у.), який можна добути із 300 кг вапняку, масова частка кальцій карбонату в якому становить 90%.
4.Яку кількість води слід залити в ацетиленовий генератор, якщо в реторті його знаходиться 2 кг кальцій карбіду? Враховуйте, що воду необхідно брати у п’ятикратному надлишку.
5.Визначте витрату кисню для газового зварювання (полум’я нормальне) листів мало вуглецевої сталі, якщо витрачається при цьому 500л ацетилену. Який об’єм повітря витрачається при цьому?
6.Кальцій карбонат масою 250 г перетворили на кальцій карбід. Який об’єм ацетилену (н.у.) утвориться при дії води на утворений кальцій карбід? Скільки ацетальдегіду можна добути з такої кількості ацетилену за реакцією Кучерова?
7.Кальцій карбід, який іде на одержання ацетилену, повинен відповідати визначеним вимогам: при дії води на 1 кг його має виділятися 260 л (н.у.) ацетилену. Визначте масову частку СаС2 у такому карбіді.
8.Обчислити масу вихідних речовин – паленого вапна, що містить 98% СаО та коксу, що містить 98% С, які необхідні для одержання кальцій карбіду масою 320 кг, якщо практичний вихід становить 86% від теоретично можливого.
Висновки
Хімія – наука експериментально–теоретична, вона має широкі можливості для розвитку пізнавальних можливостей студентів. Сучасний курс хімії розкриває основні поняття, закономірності, закони хімічної науки, загальні наукові принципи хімічного виробництва, його техніку та технологію. Вивчення наукових основ хімії спирається на проведенні експериментальної роботи та відповідних розрахунків. Проведення хімічних розрахунків сприяє набуттю практичних навичок та умінь, які становлять основу трудової діяльності, поглиблюють знання з хімії. Усе це створює умови для орієнтації студентів у процесі вивчення курсу хімії на професії обраного профілю, де хімія є підґрунтям для формування професійних знань. Головне завдання при викладанні хімії – показати взаємозв'язок хімії із професійною підготовкою у навчальному закладі.
Розв’язування задач є одним із важливих факторів поєднання теорії з практикою, активізації пізнавальної діяльності учнів. В даній збірці представлені задачі, які відображають реальні умови здійснення хімічних процесів в умовах виробництва та мають певну фахову спрямованість. Розв’язування задач виробничого змісту дає змогу встановлювати міжпредметні зв’язки з метою формування у студентів цілісного уявлення про процеси, які протікають на виробництві, готує до майбутньої професійної діяльності.
Розв'язування задач з виробничим змістом сприяє підвищенню зацікавленості до предмету, дозволяє здійснювати індивідуальний підхід до студентів.У результаті цього знання стають міцнішими, засвоюються свідомо, студенти розуміють, що вони знадобляться їм у майбутній професійній діяльності.
Список використаних джерел
1.Барко В.І. Задачі виробничого змісту у викладанні хімії. Посібник для вчителя. — К.: Радянська школа, 1989. — 95 с.
2. Шаповалов А.І. Методика розв’язування задач по хімії: Посібник для вчителя. – К.: Рад. шк., 1989. – 87 с.
3.Всеосвіта - Національна освітня платформа https://vseosvita.ua
4. Освітній проект «На Урок» для вчителів https://naurok.com.ua
Задачі взято з посібників:
1. Ярошенко О. Г., Новицька В. І. Збірник задач і вправ з хімії— К., 1996.
2. Кузьменко М. В., Єрьомін В. В. 2400 задач,— Тернопіль, 2001.
3. Хомченко Г.П. Посібник з хімії для вступників. - Видавництво Київ "Н.С.К." 2000 р.
4. Туринська Н.М. Основи загальної хімії. - Київ: Ірпінь: ВТФ "Перун".
ДОДАТКИ
Позначення та розмірність деяких фізичних величин
|
Позначення фізичної величини |
Фізична величина |
Розмірність |
|
Аr |
Відносна атомна маса |
а.о.м. |
|
Мr |
Відносна молекулярна маса |
а.о.м. |
|
W |
Масова частка |
% |
|
m |
Маса |
г, кг, т |
|
ν |
Кількість речовини |
моль |
|
V |
Об’єм |
мл, л, м3 |
|
Vm |
Молярний об’єм (число Авогадро) |
22,4 л/моль; м3/моль |
|
М |
Молярна маса |
г/моль, кг/моль |
|
N |
Число структурних частинок |
атоми, молекули, йони |
|
NА |
Стала Авогадро |
6,02·1023 моль-1 |
|
ρ |
Густина |
г/мл, г/см3, кг/м3 |
|
DН2 |
Відносна густина за воднем |
|
|
Dпов |
Відносна густина за повітрям |
|
|
С |
Молярна концентрація |
моль/л або М |
|
Р |
Тиск |
Па, кПа, атм |
|
Vх.р. |
Швидкість хімічної реакції |
|
|
T або t |
Температура |
°C або К |
|
∆Н |
Тепловий ефект реакції |
кДж/моль |
|
η або φ |
Вихід реакції |
% |
Основні формули, що використовуються при розв’язуванні задач
|
Фізична величина
|
Формули |
|
Кількість речовини |
|
|
Об’єм |
|
|
Число структурних частинок |
|
|
Молярний об’єм |
|
|
Відносна молекулярна маса |
|
|
Молярна концентрація |
|
|
Маса |
|
|
Молярна маса |
|
|
Відносна густина |
|
|
Масова частка елемента |
|
|
Масова частка розчиненої речовини |
|


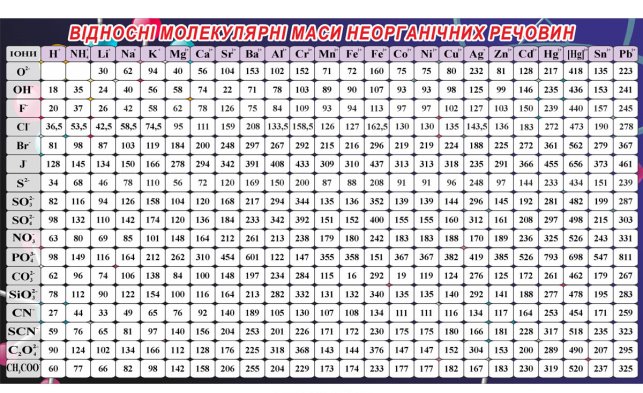
ВІДНОСНІ МОЛЕКУЛЯРНІ МАСИ ОРГАНІЧНИХ СПОЛУК



про публікацію авторської розробки
Додати розробку