Розробка уроку: Алюміній фізичні і хімічні властивості.
Тема : Алюміній: фізичні і хімічні властивості.
Мета : Розширити та поглибити знання учнів про металічні елементи на прикладі Алюмінію – представника головної підгрупи ІІІ групи; вивчити особливості будови, відновні властивості та амфотерність, поширення у природі та галузі застосування.
-Розвивати вміння прогнозувати властивості елемента та його сполук на основі розташування в періодичній системі хімічних елементів, будови атома, типу зв’язку; розвивати в учнів прийоми критичного мислення, вміння працювати з додатковою літературою. Розвивати вміння формулювати гіпотези і проводити їх дослідну перевірку, вміння порівнювати, узагальнювати, робити висновки.
- продовжувати формувати науковий світогляд учнів при вивченні фізичних та хімічних властивостей Алюмінію. Формувати екологічну грамотність, переконання про необхідність дбайливого ставлення до природних ресурсів. Виховувати культуру спілкування через роботу в парах "учень - учень", "вчитель - учень"; спостережливість, увагу, допитливість, ініціативу .
Тип уроку: засвоєння нових знань.
Методи і методичні прийоми:
1.Інформаційно-рецептивний:
а) словесний: розповідь-пояснення,опис, бесіда, повідомлення учня, робота з підручником.
б) наочний: карта, колекція мінералів, демонстрація,ТЗН.
Прийоми навчання: виклад інформації, пояснення, активізація уваги та мислення, демонстраційний дослід, одержання з тексту, демонстраційного досліду нових знань.
2. Репродуктивні.
Прийоми навчання: подання матеріалу в готовому вигляді, конкретизація і закріплення вже набутих знань.
3. Проблемно-пошукові: постановка проблемного питання.
Прийоми навчання: постановка взаємопов’язаних проблемних питань,активізація уваги та мислення.
4. Візуальний: заповнення таблиці, складання рівнянь реакції.
5. Інтерактивні: робота в парах, «мозковий штурм». «Асоціативний кущ»
6. Сугестивний: застосування різних видів мистецтва- легенда.
7. Релаксопедичний: психологічне розвантаження.
Форми роботи: фронтально-колективна, індивідуальна, групова.
Міжпредметні зв’язки : біологія, інформаційні технології, література, ОБЖ, фізик, матеріалознавство.
Засоби наочності: періодична система хімічних елементів Д.І.Мендєлєєва; таблиця “Застосування алюмінію”, довідкова література, географічна карта, Комп’ютер, мультимедійний проектор, презентація « Алюміній як хімічний елемент і проста речовина», «Віртуальна хімічна лабораторія».
Обладнання та реактиви: алюмінієвий дріт, пластинка, фольга, колекція "Алюміній", колекція "Мінерали і гірські породи".
Структура уроку
І. Організаційний етап…………………………………..1-2 хв
ІІ. Актуалізація опорних знань…………………………5 хв
ІІІ. Мотивація навчальної діяльності……………………5 хв
ІV. Вивчення нового матеріалу…………………………25хв
- Положення Алюмінію в періодичній системі та будова його атома.
- Поширення Алюмінію в природі.
- Фізичні властивості алюмінію.
- Хімічні властивості алюмінію.
- Застосування алюмінію.
V. Закріплення, систематизація та узагальнення знань……………6 хв
VІ. Домашнє завдання…………………………………...1- хв
VІІ. Підбиття підсумків уроку…………………………..1- хв
Хід уроку
І. Організаційний етап
ІІ. Актуалізація опорних знань. Відтворення та корекція опорних знань.
- Тест вибірковий (Додаток №1)
Тест перевіряється шляхом взаємоперевірки.(Слайд№1
- Підібрати до слів-характеристик відповідні метали.
Рухливий, як... (Ртуть)
Золотистий, як... (Цезій, золото)
Активний, як... (Францій, натрій, калій)
Твердий, як... (Хром)
Пластичний, як... (Залізо, золото)
Легкий, як... (Літій)
Червоний, як... (Мідь) .
Життєво важливий, як... (Кальцій, калій тощо)
Важкий, як... (Осмій)
Коштовний, як... (Золото, платина)
ІІІ. Мотивація навчальної діяльності. Повідомлення теми, мети, завдань уроку.
1) Ми продовжуємо вивчення великої і важливої теми «Метали». Сьогодні на уроці нам належить познайомитися з металом добре відомим вами з дитинства. Даний урок я хочу почати з легенди.(Слайд №2
Стародавній історик Пліній Старший розповів про цікаву подію, що відбулася майже два тисячоліття тому. Якось до римського імператора Тиберія прийшов незнайомець. Як дарунок імператору він приніс із собою виготовлену власноруч чашу із блискучого, як срібло, але надзвичайно легкого металу. Майстер розповів, що цей нікому не відомий метал він зумів одержати з глинистої землі. Побоюючись, що новий метал, із його прекрасними властивостями, знецінить золото і срібло, що зберігалося у скарбниці, Тиберій позбавив винахідника голови, а його майстерню зруйнував, щоб нікому більше не прийшло в голову займатися виробництвом «небезпечного» металу. «Небезпека» минула і , на жаль, надовго. Про який метал йде мова?
Таким чином, тема нашого уроку: «Алюміній - хімічний елемент і проста речовина».
(Слайд №3) Учні записують тему уроку в зошити).
2) Щодо легенди, то вона досить сумнівна, тому що самородний Алюміній у природі не зустрічається через свою високу активність, і за часів Римської імперії не могло бути технічних засобів, які б дозволили здобути Алюміній із глинозему.(Слайд№4) Лише майже через 2000 років – у 1825 р. Ханс Християн Ерстед одержав кілька мг металічного Алюмінію. Він пропускав хлор крізь розпечену суміш алюміній оксиду з вугіллям, а потім отриманий алюміній хлорид нагрівав з амальгамою Калію. Амальгаму розкладав нагріванням: ртуть випаровувалась, а алюміній залишався.
У 1827 році Фрідріх Веллер отримав алюміній інакше. Він нагрівав алюміній хлорид із лужнім металом калієм або натрієм без доступу повітря.
А1С13+ЗК-=ЗКС1 + А1
Та промисловий спосіб одержання алюмінію у великих кількостях був розроблений набагато пізніше. Цю проблему розв'язав молодий американський учений Чарльз Мартин Холл. А шлях до відкриття, мабуть, був таким.
У 1855 р. на Всесвітній виставці у Парижі було представлено «срібло із глини», яке стало сенсацією. Появі цих експонатів передували такі події. Імператором Франції в той час був Наполеон ІІІ – «маленький небіж великого дядька», як звали його тоді, великий любитель пустити пил в очі, Наполеон ІІІ улаштував бенкет, на якому почесні гості були гідними честі їсти алюмінієвими ложками і виделками. А всім іншим було прикро до сліз: їм довелося користуватися звичайним золотим і срібним посудом.
У 1889 році, коли Д.І. Менделєєв( Слайд№5) перебував у Лондоні, йому на знак визнання видатних заслуг у розвитку хімії подарували цінний подарунок – терези, що зроблені з золота та алюмінію. У 1854 р. вартість 1 кг алюмінію становила 1200 карбованців, тобто він був у 270 разів дорожчий за срібло, а в 1899 році – 1 карбованець. Тепер тонна алюмінію коштує стільки, скільки 120 років тому коштував 1 кг. Вартість знизилася, але цінність зросла. В Україні виробляється 500 тисяч тонн алюмінію на рік. Цей метал одержують Миколаївський глиноземний завод та Запорізький алюмінієвий комбінат.
Проблемне питання
Завдання нашого уроку - з’ясувати у чому полягає цінність алюмінію.
3) Учитель повідомляє, що основною метою уроку є вивчити будову та властивості металічного елемента, який у періоді займає проміжне місце між металічними та неметалічними елементами. Це визначатиме особливості у його будові та властивостях. Вказуєм на основні питання теми та послідовність їх розгляду( Слайд №6)
1. Будова атома алюмінію.
2. Знаходження в природі.
3. Отримання та відкриття металу.
4. Фізичні властивості.
5. Хімічні властивості.
6. Застосування алюмінію
4) Які асоціації, пов’язані з терміном «алюміній»? На дошці будується іасоціативний кущ «Алюміній». Добудуємо його в кінці уроку.
ІV. Вивчення нового матеріалу. Сприйняття та первинне усвідомлення нового матеріалу.
1.Положення Алюмінію в періодичній системі та будова його атома Хімічні властивості алюмінію в першу чергу пов'язані з будовою його атома.
1)Спробуйте охарактеризувати положення Алюмінію в періодичній системі.
(Учні з'ясовують положення Алюмінію: номер групи, періоду, валентні стани атома, заряд ядра, кількість електронів)(Слайд №7)
2) Алюміній розташований у третьому періоді, тому його атом має три енергетичні рівні. Третя група, головна підгрупа свідчить про три валентні електрони на зовнішньому енергетичному рівні. Так як для алюмінію характерний тривалентнийстан атома, то у сполуках він перебуває у збудженому стані Зз13р23d0. Атом Алюмінію, як і більшості металів, проявляє відновні властивості, віддаючи три електрони зовнішнього рівня, перетворюючись на катіон А13+.
.Більше число електронів атом віддає важче і це позначається зниженням хімічної активності порівняно з Натрієм, Калієм, Кальцієм.(Слайд №8)
3)(Учні записують в зошити схему будови атома Алюмінію, електронну формулу, значення ступеня окиснення).
2.Поширення Алюмінію в природі
Далі рухаючись за маршрутом уроку, розглянемо знаходження алюмінію в природі. Подивіться на діаграму і зверніть увагу на поширеність алюмінію в природі.
(Слайд №9)
Яке місце за поширеністю в природі займає алюміній?
1) Самостійна робота з підручником
Учні отримують завдання прочитати у підручнику про алюміній на с.154 «Поширення у природі».
Окремі учні отримують додатково довідникову літературу та опрацьовують її, готують повідомлення.
Обговорення прочитаного. Повідомлення учнів можуть мати приблизно такий зміст:
• Алюміній є досить поширеним елементом. Його масова частка в земній корі становить 8,8%. Він посідає перше місце за поширеністю з–поміж металів і третє місце з–поміж інших хімічних елементів, після Оксисену і Силіцію. Природний алюміній має один стабільний нуклід 2713Al. У штучно добутих ізотопів, як правило, дуже малий період напіврозпаду.
- Алюміній у природі трапляється лише у вигляді сполук. Його велика хімічна активність і здатність утворювати змішані кристалічні гратки, в яких йони Алюмінію частково заміщують йони Силіцію, зумовили різноманітність форм його сполук. Відомо майже 250 мінералів, які містять Алюміній. З – поміж них найпоширеніші:((Слайд№ 10,)
-боксит Al2O3*nH2O;
- польовий шпат, - K2O*Al2O3*SIO2,
-каолін або біла глина - Al2O3*2SIO2*2H2O;
- корунд (Слайд №11)– Al2O3 у природі трапляється у вигляді прозорих кристалів, які забарвлені незначними домішками Cr2O3(рубін) у червоний колір, Ti2O3 і Fe2O3 (сапфір) – у синій, є ще топази і смарагди зеленого кольору
Поклади нефеліну містяться на Кольському півострові та в Красноярському краї (Росія). Родовища бокситів зустрічаються на Уралі, Ленінградській області (Росія), в Башкирії, Казахстані.
В Україні родовища алюмінієвих руд зустрічаються в Закарпатській області – родовище Берегівське, в Черкаській області – родовище Смілянське , в Херсонській області – родовище Високопільське, в Донецькій області – родовище Калініно - Шевченківське.(Учень показує на карті).
Учні під керівництвом вчителя працюють з колекцією "Мінерали і гірські породи".(Учні записують в зошити назви та хімічні формули найважливіших мінералів Алюмінію).
3.Фізичні властивості алюмінію.
Які фізичні властивості характерні для алюмінію?
Спробуйте передбачити, на яких фізичних властивостях ґрунтується застосування алюмінію?
Чому мідь конкурує з алюмінієм в електротехніці?
Які фізичні властивості цього металу сприяють також його широкому використанню?
1)Бесіда з учнями, під час якої учні з’ясовують фізичні властивості алюмінію:
Висновок (Слайд №12)
Алюміній — сріблясто-білий метал, легкий, електропровідний, з високою теплопровідністю, легкоплавкий (іпл = 660 °С), легкий (р = 2,7 г/см3), пластичний. Висока пластичність металу (як у холодному, так і в гарячому стані) дозволяє застосовувати його як дроти, деталі обладнання, виготовляти фольгу. Алюміній плавиться важко, але в розплавленому стані залишається довше, ніж інші метали. Має слабкі парамагнітні властивості. На відміну від інших металів порошкоподібний алюміній має блиск, тому й використовується як срібна фарба. Нею вкривають поверхні інших металів для захисту від корозії. Електропровідність алюмінію сприяє широкому використанню цього металу як дротів, обмотки роторів. Алюміній не кородує, саме тому він та сплави на його основі широко використовуються як конструкційний матеріал.
Цікаво!
Алюміній утричі легше від заліза.
Якщо проаналізувати мідний та алюмінієвий дроти однакової електропровідності, то діаметр алюмінію в 1,3 рази більше, але вага в 1,96 рази менша.
Фізичні властивості пояснюються металічним зв’язком, наявністю постійного циркулюючого електронного газу, об’ємноцентрованої кубічної гратки .
Назва алюмінію походить від слова «алюмен», що в перекладі з латини означає «галун», хоча в давнину це слово мало й інше значення. Назву «алюміній» (алюмініум) запропонував Г. Деві у 1807 році.
Не так давно вчені встановили, що кухонний алюмінієвий посуд не такий уже й безпечний, як вважалося раніше. Під час приготування їжі, зокрема, яка містить слабкі органічні кислоти(оцтову, аскорбінову, винну, лимонну), відбувається руйнування оксидної плівки й утворення сполук, які спричиняють харчові отруєння.
2) Вчитель демонструє пластичність алюмінієвого дроту, пластинки, фольги
3)(Учні записують в зошити найважливіші фізичні властивості алюмінію).
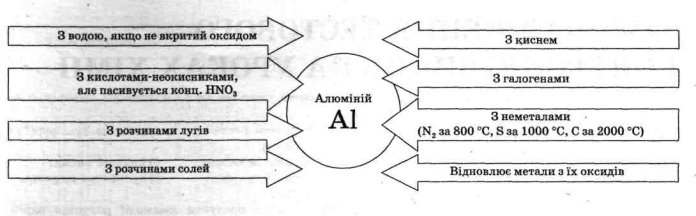
4.Вивчення хімічних властивостей алюмінію.
1.Які хімічні властивості характерні для всіх металів?
Учні: Це взаємодія з простими речовинами-неметалами: киснем, галогенами, сіркою, вуглецем; з складними речовинами - водою, кислотами, розчинами солей.
2. Хімічні властивості алюмінію схожі із загальними властивостями металів,(Слайд№13) але й дещо відрізняються.Алюміній взаємодіє з елементарними окисниками(Слайд №14 Відео №1), з галогенами навіть за звичайної температури. Якщо змішати порошок алюмінію та іоду й додати до суміші декілька крапель води, то починається бурхлива реакція. (Дослід демонструється під скляним ковпаком або у витяжній шафі.) Чим слугує вода в цій хімічній реакції? (Каталізатор)
2А1 + ЗІ2->2А1І3
3. Алюміній належить до числа хімічно активних металів. У витискувальному ряду він розміщений за магнієм. У чистому вигляді як на повітрі. так і у воді він може зберігатися досить довго, бо його поверхня вкривається тонкою (0,00001мм), щільною і дуже міцною оксидною плівкою Al2O3, яка захищає метал від подальшого окиснення, зумовлює його високу корозійну стійкість і надає йому матового вигляду.( Ця плівка захищає метал від подальшого окиснення, утруднює (слайд №15 Відео №2), плавлення металу. Порошкоподібний алюміній під час нагрівання енергійно згоряє в повітрі й може навіть вибухнути.
4А1 + 302 ->2А120,
Під час обробки поверхні алюмінію сильними окисниками (конц. HNO3, K2Cr2O7) чи навіть анодним окисненням товщина захисної плівки збільшується.
4.Учні за бажанням йдуть до дошки пишуть рівняння реакцій, виявляють відповідні властивості алюмінію, складають схеми електронного балансу.
(Всі учні записують рівняння реакцій та схеми в опорні конспекти).
 Взаємодія з простими речовинами:
Взаємодія з простими речовинами:
З хлором і бромом за звичайних умов:
2Al +3Cl2=2AlCl3
2Al+3Br2=2AlBr3
З іншими неметалами за підвищеної температури дає ступінь окиснення +3:
2Al+N2=2AN;
2AL+3S=Al2S3;
4Al+3C=Al4C3;
2Al+3I2=2AlI3;
З металами утворює сплави.
Взаємодіє з водою лише при руйнуванні оксидної плівки амальгамуванням з утворенням гідроксиду і виділенням водню:( Слайд №16, Відео №3)
2Al+6H2O=2Al(OH)3 +3H2
Звертаємо увагу на взаємодію алюмінію з водою, учні записують рівняння, розглядають реакцію як окисно-відновну:
Ця властивість, як і властивість взаємодіяти з розчинами кислот, теж належить до спільних властивостей.
Подібно до інших металів реагує з хлоридною і розбавленою сульфатною кислотами:
2Al+6HCl=2AlCl3+3H2
2Al+3H2SO4=Al2(SO4)3+3H2
Концентровані сульфатна і нітратна кислоти (на холоді) пасивують алюміній.
Взаємодіє з розчинами солей менш активних металів:( Слайд №17 Відео 4)
2Al+3CuSO4=3Cu+Al2(SO4)3.
Учитель повідомляє про те, що алюміній помітно розчиняється в розчинах солей, які внаслідок гідролізу дають кислу або лужну реакцію.( Дослід
5) Виявляє амфотерні властивості: алюміній реагує з розчинами лугів
2Аl + 2NaOH + 6 H2O = 2Na (Аl (OH)4 ) + 3H2
утворюється комплексна сіль натрій тетрагідроксоалюмінат. Зазначаємо, що властивість алюмінію взаємодіяти з розчинами і кислот, і лугів підтверджує його амфотерність.
6) Взаємодія з оксидами менш активних за нього металів(алюмінотермія)( Слайд №18 Відео №5)
8Al+3Fe3O4=9Fe+4Al2O3.
Висновок
Як більшість металів, алюміній реагує з кислотами, витискуючи водень, але пасивується концентрованою нітратною кислотою. Вступає в реакції з неметалами, але з галогенами реагує за звичайних умов. Алюміній — достатньо активний метал, та його активності перешкоджає оксидна плівка. Характерною відмінністю алюмінію від інших металів є здатність реагувати з розчинами лугів.
5.Застосування алюмінію (Слайд №19 )
Як ви думаєте, з чим пов'язано таке широке застосування алюмінію?
1. Алюміній - найпоширеніший метал в земній корі.
2. Володіє високою корозійною стійкістю.
3. Мала щільність.
4. Сплави на основі алюмінію мають міцність.
5. Висока електропровідність і теплопровідність.
6. Висока хімічна активність використовується в алюмінотермії.
1)Застосування алюмінію зумовлене його властивостями.
2)Розповідь з демонструванням слайдів на мультимедійному екрані:(Слайди №20-25)
Поєднання легкості з достатньо високою електропровідністю дозволяє застосовувати алюміній як провідник електричного струму, замінюючи ним дорожчу мідь. Алюміній використовують як розкисник сталей, бронз та інших сплавів. Алюміній і його сплави (дюралюміній і силумін) використовують практично у всіх галузях сучасної техніки. Основними споживачами алюмінію та його сплавів є: авіаційна й автомобільна промисловості, залізничний і водний транспорт, машинобудування тощо. Ним відновлюють метали з їхніх оксидів.
Завдяки високій корозійній стійкості алюміній широко застосовують при виготовленні апаратури для виробництва та зберігання концентрованої нітратної кислоти, гідроген пероксиду, органічних речовин і харчових продуктів.
Високу відбивну здатність полірованого алюмінію використовують для виготовлення поверхонь нагрівальних і освітлювальних рефлекторів і дзеркал. Рубіни і інші пофарбовані різновиди оксиду алюмінію застосовують у ювелірній промисловості і в техніці, наприклад у виробництві лазерів, механічних годинників; в даний час рубіни, сапфіри, аметисти і ін одержують штучним шляхом.
3) Учні заповнюють таблицю "Застосування алюмінію", виконують самостійну роботу, використовуючи інформацію з слайда екрана «Застосування алюмінію».
|
ГАЛУЗЬ ЗАСТОСУВАННЯ |
НА ОСНОВІ ЯКОЇ ВЛАСТИВОСТІ ГРУНТУЄТЬСЯ |
|
|
|
Сплави: дюралюміній, силумін, магналій;
Електричні проводи;
Хімічна апаратура;
Алітування сталі й чавуну;
Труби для нафтопромисловості;
Виготовлення металевих конструкцій;
Добування менш активних металів;
Порошок АІ для виготовлення сріблястих фарб;
Порошок АІ як добавка до реактивних палив;
Алюмінієва фольга для харчової промисловості;
Збірні башти для зберігання зерна;
Високоякісні дзеркала;
Авіа-, корабле-, побутове приладобудування.
4)Повідомлення учня, який мав випереджальне домашнє завдання на тему «Значення алюмінію в історії людства».
«Крилатим металом» називають алюміній у наші дні. Воно й не дивно. Коли в безкраї простори неба здіймаються надшвидкісні літаки, а навколо Землі проносяться штучні супутники – дякуйте алюмінію. Це він, утричі легший від заліза й сталі, надав міці сріблястим крилатим небесним велетам.
Алюміній – метал дуже м’який. Тому він добре піддається механічній обробці – литтю, ковці, витягуванню. З нього можна витягнути нитки тонкі, як павутиння. З алюмінієвого волокна виготовляють тканини. Міцні й легкі, вони не бояться вогню, на них не залишається жодних плям. А сукня, пошита з такої тканини, нагадує парчову. До речі, якщо тканина з алюмінію нагадує парчу, то різні технічні конструкції з цього легкого і водночас міцного металу схожі на тонке мереживо.
Усе, що досі розповідалось про алюміній - його сьогодення. Та яке цікаве майбутнє чекає на нього! Якщо зазирнути до лабораторії учених, можна пересвідчитися, що пошуки нових і досить несподіваних шляхів застосування алюмінію безперервно тривають. Усі ви, напевне, чули про чудовий матеріал сучасності – пінопласти, що дуже легкі, мов піна. Відмінні ізоляційні якості мають будівельні матеріали, виготовлені з різних пластмас. Проте пінопласти не скрізь можна використовувати:вони не достатньо міцні. Ось чому інженери давно мріють про пінометали. І тут пальма першості належить алюмінію. Піноалюміній – це завтрашній день. Технологія виготовлення першого пінометалу – піно алюмінію – розробляється.
І ще одне використання цієї речовини. В алюмінію малий захват нейтронів, тому в поєднанні з корозійною стійкістю це робить його одним із найважливіших металів атомної техніки.
5) Вплив сполук алюмінію на навколишнє середовище (Слайд №23)
V.Узагальнення та систематизація знань
1) Бесіда за питаннями.
1.Чому Алюміній трапляється у природі тільки у вигляді сполук?
2. Назвіть мінерали та руди, що містять Алюміній.
3. У чому полягає цінність алюмінію?
4.Назвіть фізичні властивості алюмінію, що сприяють його застосуванню як конструкційного матеріалу та в електротехніці.
5. Як пояснити те, що побутові вироби з алюмінію не реагують із водою?
2) Добудова асоціативного куща «Алюміній»
Узагальніть ваші знання про те, у чому полягає цінність алюмінію і повернемося до асоціативного куща про алюміній та доповнимо його новими відомостями, які ви отримали на уроці.
3) Тест- доповнення
Доповніть речення та закінчіть рівняння реакцій
(Слайд №26)
1.У Періодичній системі Алюміній розташований у ____ періоді.
2. В електронній оболонці атомів Алюмінію заповнюється ____ електронних шарів.
3.Скільки електронів міститься атом Алюмінію ?
4.Ступінь окиснення Алюмінію в сполуках дорівнює ____
5.У хімічних взаємодіях атоми Алюмінію тільки ________електрони
6. Формула Алюміній оксиду __________
7. Чи зустрічається Алюміній у природі у вільному вигляді _____
8. Алюміній оксид утворює мінерал _____________
9.Спосіб відновлення металів з їх оксидів за допомогою Алюмінію називають ______________
Відповіді перевіряються шляхом взаємоперевірки ( Слайд №27)
4) Встановіть відповідність між реагентами та продуктами реакції:
|
1. |
Al + O2 |
А |
AlСl3 + H2 |
|
2. |
Al + H2O |
Б |
AlСl3 |
|
3. |
Al + Сl2 |
В |
AlСl3 + H2O |
|
4. |
Al + HСl |
Г |
AlСl3 + Hg |
|
5. |
Al + NaOH |
Д |
AlСl3+ HgСl2 |
|
6. |
Al + HgСl2 |
Е |
NaAlO2 + H2 |
|
7. |
Al + Fе3О4 |
Ж |
Al(OH)3 + H2 |
|
|
|
З |
Al(OH)3 + Na |
|
|
|
И |
Al2O3 + Fе |
|
|
|
К |
Al2O3 |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
к |
ж |
б |
а |
е |
д |
и |
VI. Домашнє завдання.
1)Опрацювати матеріал параграфа 22.
2) Виконати завдання 212, 215 на с.161 у підручнику.
3)Підготувати цікаві повідомлення про алюміній (за бажанням).
VII. Підведення підсумків.
1) Вчитель пропонує здійснити рефлексію методом інтерактивної вправи «Займи позицію».
2)Оцінювання роботи учнів на уроці.
Опорний конспект
|
Ar |
№ |
ₑ‾ |
р |
n |
електронна формула |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
Природні сполуки
Боксит__________Польовий шпат_________________
Каолін__________________Корунд________________
Фізичні властивості
Агрегатний стан_______________________________
Колір________________________________________
Блиск_______________________________________
Густина_____________________________________
Пластичність_________________________________
Температура плавлення_______________________
Електропровідність____________________________
Теплопровідність____________________________
На повітрі__________________________________
Хімічні властивості
- АІ + І2 =
- Al + O2 =
- A l+ N2=
- AІ + S =
- A l+ C =
- Al + H2O =
- Al + Н2SO4 =
- Al + СuSО4 =
- Al + Fe2O3 =
1


про публікацію авторської розробки
Додати розробку
