Урок "Кристалічні гратки"
- èα¿ßΓá½. úαáΓ¬¿.docx docx
- èα¿ßΓá½. úαáΓ¬¿.pptx pptx
Тема уроку:
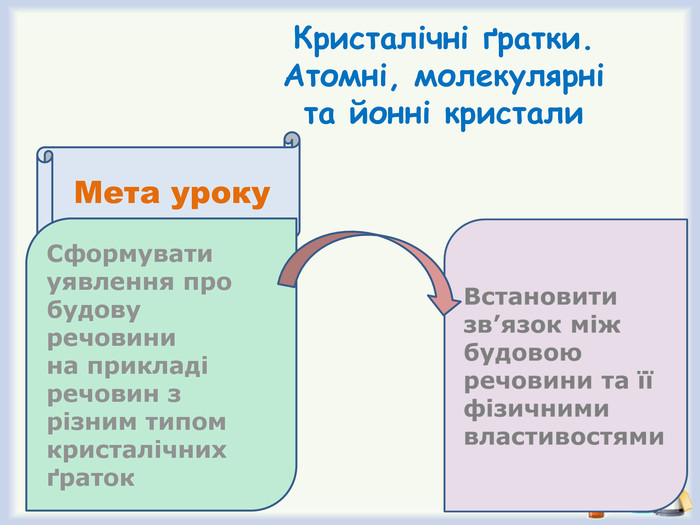
Кристалічні ґратки. Атомні, молекулярні та йонні кристали. Залежність фізичних властивостей речовин від типів кристалічних ґраток.
Мета уроку
Навчальна:
поглибити знання учнів про будову речовин на прикладі речовин з різними типами кристалічних ґраток; розвивати вміння порівнювати властивості речовин та їх будову, аналізувати будову атома й будову речовин та їх зв’язки з фізичними властивостями простих і складних речовин;
Розвивальна:
розвивати вміння аналізувати та структурувати інформацію, встановлювати причинно-наслідкові зв’язки; порівнювати, робити висновки; розвивати пізнавальну активність; стимулювати реалізацію творчих здібностей учнів; удосконалювати вміння проводити дослідження та спостереження;
Виховна:
виховувати навички раціональної організації праці, самостійної діяльності, потребу у розширенні знань; виховувати любов і повагу до природи, до процесів, що відбуваються в ній.
Очікувані результати навчально-пізнавальної діяльності
Учень/учениця
|
Знаннєвий компонент |
Діяльнісний компонент |
Ціннісний компонент |
|
називає типи кристалічних ґраток;
|
характеризує особливості кристалічної будови речовин з різними видами хімічного зв’язку; |
обґрунтовує фізичні властивості речовин залежно від типів кристалічних ґраток; |
|
наводить приклади сполук із атомними, молекулярними та йонними кристалічними ґратками;
|
прогнозує фізичні властивості та практичне використання речовин залежно від виду хімічного зв’язку і типу кристалічних ґраток; |
робить висновки про тип кристалічних ґраток речовин на основі виду хімічного зв’язку в них.
|
Тип уроку: набуття нових знань
Обладнання: інтерактивна дошка, інтерактивна презентація, комп’ютер, моделі кристалічних ґраток, кухонна сіль (натрій хлорид NaCl), цукор (сахароза C12H22O11), пісок (силіцій оксид SiO2), лабораторний посуд, пластилін.
Хід уроку
Девіз уроку
Єдиний шлях, що веде до знань, - це творча діяльність
Бернард Шоу
І. Організаційний етап. (слайд 1-2)
Привітання, створення психологічно комфортної робочої атмосфери у класі.
Інструктаж щодо самооцінювання.
Лист самооцінювання
учня _________________________________
|
Вид роботи |
Бали |
|
Усна відповідь |
|
|
Хімічна розминка |
|
|
Експериментальне завдання |
|
|
Хімічне моделювання |
|
|
Хімічний тренажер |
|
|
Сума балів |
|
ІІ. Актуалізація опорних знань.
Фронтальна бесіда
- Що називають хімічним зв'язком?
- Які електрони беруть участь в його утворенні?
- Які типи хімічного зв'язку вам відомі?
- Дайте визначення ковалентного зв’язку.
- Які його види вам відомі?
- Який зв'язок називають йонним?
Прийом «Хімічна розминка» (слайд 3-5)
Виконайте тестові завдання та оцініть свої відповіді після перевірки.
Після виконання роботи вчитель пропонує бажаючим учням позначити правильну відповідь на інтерактивній дошці.



ІІІ. Мотивація навчальної діяльності
Чи можна розплавити в домашніх умовах цукор? А сіль? Чому?
ІV. Вивчення нового матеріалу
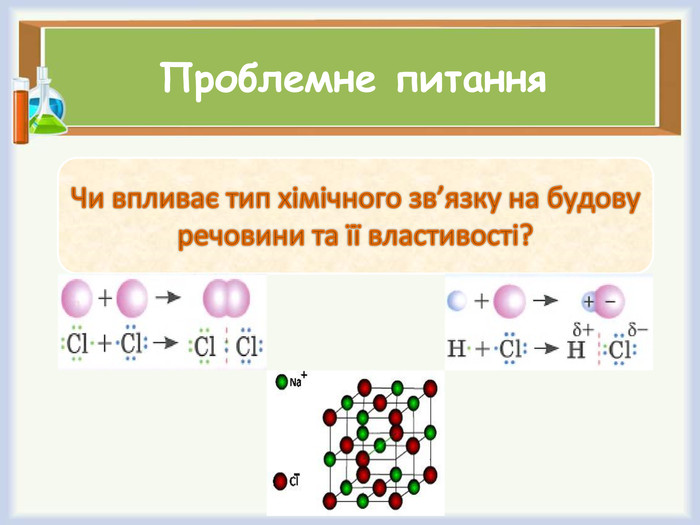
Проблемне питання (слайд 6)
Чи впливає тип хімічного зв’язку на будову речовини та її властивості?
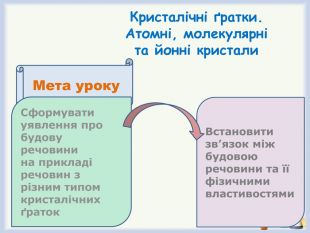
Формулювання разом з учнями мети уроку (слайд 7)
- дослідити будову речовини на прикладі речовин з різним типом кристалічних ґраток,
- встановити зв'язок між будовою речовини та її фізичними властивостями.
План вивчення нового матеріалу
- Аморфні та кристалічні речовини.
- Кристалічні ґратки.
- Типи кристалічних ґраток.
- Фізичні властивості речовин з різними типами кристалічних ґраток.
Аморфні та кристалічні речовини. (слайд 8-9)
- Пригадайте в яких агрегатних станах можуть існувати речовини?
Розповідь учителя
Біля 95% відомих нам сполук як природного, так і штучного походження, за звичайних умов знаходяться в твердому стані. Ще з доісторичних часів тверді речовини були основою матеріалів, які людина використовувала для виготовлення знарядь праці, предметів побуту, будівництва житла тощо і які зумовили розвиток цілих історичних епох людства. Кам’яний вік, бронзовий вік, залізний вік — це етапи становлення цивілізації, що дістали назву від того матеріалу, який лежав в основі життєдіяльності людини.
Залежно від характеру розміщення частинок у просторі тверде тіло може мати кристалічний або аморфний стан.
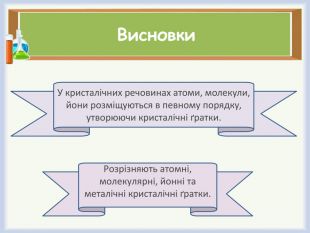
Кристалічні речовини мають впорядковану структуру, яка зберігається у всьому об’ємі речовини. Кристалічний стан характеризується наявністю як ближнього, так і дальнього порядку розміщення частинок.
Аморфні речовини мають тільки ближній порядок розміщення частинок і цим нагадують рідини. Аморфні речовини можна розглядати як переохолоджену рідину з дуже високою в’язкістю.
Характерною особливістю кристалічних речовин є анізотропія їх властивостей. Більшість фізичних властивостей кристалів, таких як електро- і теплопровідність, міцність, оптичні властивості, у різних напрямках неоднакові. Анізотропія властивостей зумовлена внутрішньою будовою кристалів. Аморфні речовини ізотропні, тобто їхні властивості в будь-якому напрямку однакові. Найвідоміша аморфна речовина — скло.
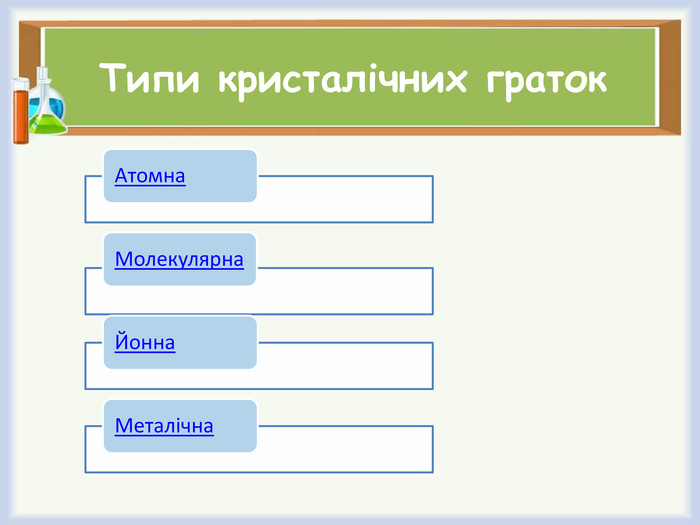
Кристалічні ґратки. (слайд 10)
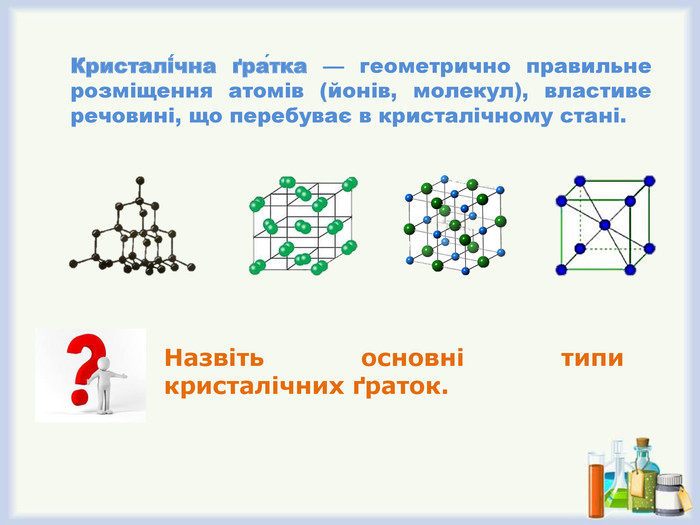
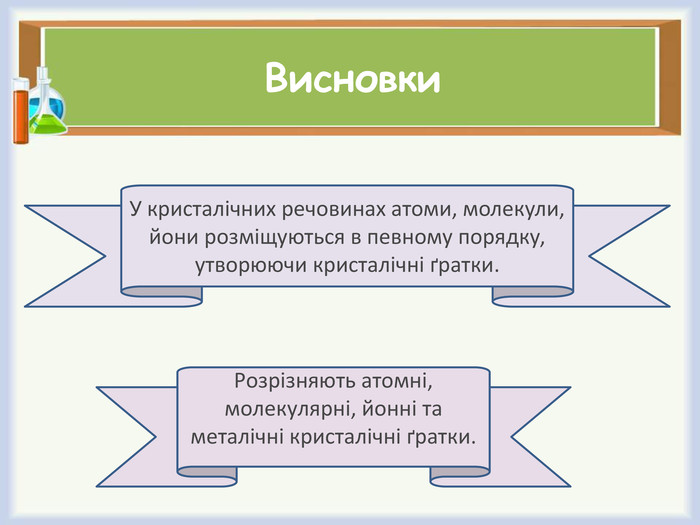
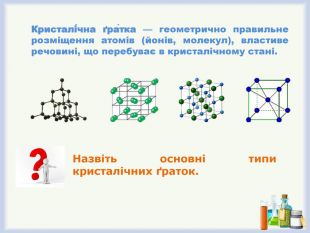
Кристалічна ґра́тка — геометрично правильне розміщення атомів (йонів, молекул), властиве речовині, що перебуває в кристалічному стані.
Демонстрація 4. Моделі кристалічних ґраток різних типів.
- Які структурні частинки утворюють ґратки?
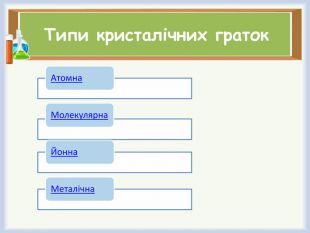
- Назвіть типи кристалічних ґраток.
Типи кристалічних ґраток. Фізичні властивості речовин з різними типами кристалічних ґраток.
Завдання
Самостійно опрацюйте матеріал підручника та заповніть таблицю
|
|
Атомна |
Молекулярна |
Йонна |
|
Структурні частинки |
|
|
|
|
Тип хімічного зв'язку |
|
|
|
|
Міцність зв'язку |
|
|
|
|
Температура кипіння і плавлення |
|
|
|
|
Леткість |
|
|
|
|
Твердість, крихкість |
|
|
|
|
Електропровідність |
|
|
|
|
Розчинність у воді |
|
|
|
Обговорення самостійно вивченого матеріалу (слайд 11-14) за планом:
- визначення типу кристалічної ґратки,
- характерні фізичні властивості речовин,
- зв'язок: властивості – будова речовини,
- приклади речовин.
V. Експериментальне завдання.
Лабораторний дослід 1. Ознайомлення з фізичними властивостями речовин атомної, молекулярної та йонної будови.
Завдання
Дослідіть фізичні властивості виданих речовин:
- кухонна сіль (натрій хлорид NaCl),
- цукор (сахароза C12H22O11),
- пісок (силіцій оксид SiO2).
- Повторення правил БЖД.
- Складання плану дослідження.
Результати занесіть у таблицю:
|
Речовина (назва, формула) |
|
|
|
|
Тип кристалічної ґратки |
|
|
|
|
Тип хімічного зв’язку |
|
|
|
|
Агрегатний стан |
|
|
|
|
Колір |
|
|
|
|
Запах |
|
|
|
|
Розчинність у воді |
|
|
|
|
Крихкість |
|
|
|
|
Температура плавлення |
|
|
|
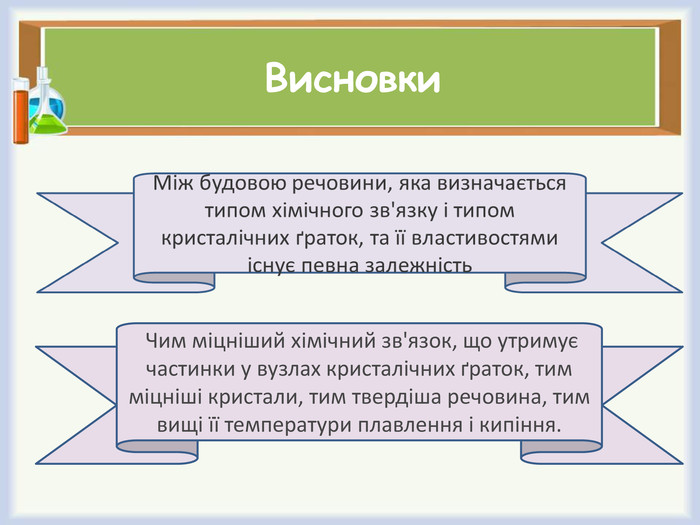
Зробіть висновок щодо залежності фізичних властивостей речовин від структури їх кристалічних ґраток.
Дайте обґрунтовану відповідь на питання, яке ми поставили на початку уроку:
- Чи можна розплавити в домашніх умовах цукор? А сіль? Чому?
Обговорення попередньо підготовленої учнями інформації:
- Соляна промисловість України.
- Сіль і її вплив на організм людини.
- Природні джерела сахарози.
- Галузі використання піску.
VІ. Узагальнення, систематизація знань, застосування їх в різних ситуаціях
Хімічне моделювання. Складання моделей молекул з різними типами хімічного зв’язку.
Робота в групах (парах) над завданнями різного рівня складності
Завдання для групи 1
1. Із різнокольорового пластиліну зробіть кульки – моделі атомів Хлору, Гідрогену.
2. Складіть кулестрижневі моделі молекул речовин хлору Cl2, водню H2. Назвіть кратність зв’язку та тип хімічного зв’язку.
3. Складіть кулестрижневу модель молекули гідроген хлориду HCl. Назвіть тип хімічного зв’язку.
Завдання для групи 2
1. Із різнокольорового пластиліну зробіть кульки – моделі атомів Оксигену, Гідрогену.
2. Складіть кулестрижневі моделі молекул речовин водню H2, кисню O2. Назвіть кратність зв’язку та тип хімічного зв’язку.
3. Складіть кулестрижневу модель молекули води. Назвіть тип хімічного зв’язку.
Завдання для групи 3
1. Із різнокольорового пластиліну зробіть кульки – моделі атомів Оксигену, Нітрогену, Гідрогену.
2. Складіть кулестрижневі моделі молекул речовин кисню O2, азоту N2. Назвіть кратність зв’язку та тип хімічного зв’язку.
3. Складіть кулестрижневу модель молекули амоніаку NH3. Назвіть тип хімічного зв’язку.
Хімічний тренажер (слайд 15)
VІІ. Підбиття підсумків уроку. Оцінювання. Рефлексія.
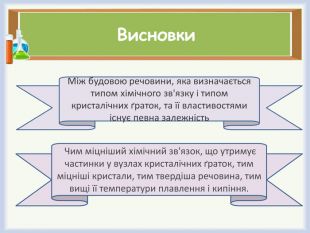
Формулювання висновків (слайд 16-17)
- Як розміщуються структурні частинки у кристалічних речовинах?
- Які типи кристалічних ґраток розрізняють?
- Чи існує зв'язок між будовою речовини та типом кристалічних ґраток?
Оцінювання
Сумуйте бали у Листі самооцінювання.
Чи задоволені ви результатами своєї роботи на уроці?
VІІІ. Домашнє завдання (слайд 18)
- опрацювати параграф,
- скласти кулестрижневу модель натрій хлориду,
- підготувати презентацію навчального проєкту:
- «Використання кристалів у техніці»,
- «Кристали: краса і користь».


про публікацію авторської розробки
Додати розробку