Розробка уроку "Ізопроцеси в газах" 10 клас
Розробка уроку вивчення нового матеріали "Ізопроцеси в газах" для загальноосвітніх класів, рівень стандарту, може використовуватися як цікавий матеріал для підготовки уроку молодим вчителям. Серед моїх матеріалів є також презентація до даного уроку.
УРОК №
ПРЕДМЕТ: фізика
ТЕМА ПРОГРАМИ: Властивості газів, рідин, твердих тіл
ТЕМА УРОКУ: Ізопроцеси в газах.
Тип уроку: урок вивчення нового матеріалу.
МЕТА УРОКУ:
Сформувати поняття про ізопроцеси в газах, зокрема дослідити їх з погляду МКТ, формувати науковий світогляд; сформувати вміння будувати й аналізувати графіки ізопроцесів у різних системах координат; закріпити матеріал за допомогою розв’язування задач, виконання віртуальної лабораторної роботи, перевірочних тестів.
Розвивати вміння встановлювати причинно-наслідкові зв’язки між явищами, виходячи з положень МКТ, формувати розуміння меж застосування моделі ідеального газу; розвивати математичний апарат фізики, вміння систематизувати і описувати результати, сприяти активізації творчого мислення і розвитку мотивації навчання шляхом використання переваг інтерактивних методів навчання.
Показати практичне застосування ізопроцесів у природі, науці й техніці; підвищувати інтерес до предмету, стимулювати пізнавальну активність учнів; сприяти розвитку комунікативних якостей особи в процесі парно-групової роботи
Методи навчання, прийоми: елементи бесіди, проблемні питання, експеримент-дослідження, робота в парах
Форма організації навчальної діяльності: урок-дослідження з використанням комп’ютерної техніки
Дидактичне забезпечення: опорний конспект, ілюстративний матеріал, роздатковий матеріал
Матеріально-технічне забезпечення: комп’ютер, презентація
Міжпредметні зв’язки: інформатика, математика, природознавство, українська мова.
Епіграф уроку
Існує лише те, що можна виміряти.
Макс Планк
В кожній людині є Сонце.
Тільки дайте йому світити.
Сократ
Хід уроку
- Актуалізація знань
- Фізичний диктант
- Бліц турнір:
1.Що є об’єктом вивчення МКТ
2.Що в МКТ називається ідеальним газом?
3.Що ви розумієте під параметрами газу?
4.Які термометричні параметри характеризують стан газу?
5.Яке рівняння пов’язує між собою всі три термодинамічні параметри? 6.Записати рівняння Менделєєва-Клапейрона
7.Який фізичний зміст рівняння стану газу?
8.Що таке абсолютний нуль температури? Абсолютна шкала температур?
9.Назвіть одиницю абсолютної температури.
10.Який зв’язок існує між температурою і абсолютною температурою?
11.Чому дорівнює універсально газова стала?
3.Використовуючи рівняння стану ідеального газу, обчисліть невідомий параметр. ( робота в групах)
IІ. Мотивація навчальної діяльності
Багато процесів зміни стану газів у природі й у теплових машинах відбуваються так, що один із трьох макроскопічних параметрів (V, P або T) залишається або спеціально підтримується постійним. Два інших параметри при цьому змінюються.
Такий перехід називається ізопроцесом, а рівняння його закономірності - газовим законом.
Ізопроцеси - процеси, які відбуваються при незмінному значенні одного із параметрів.
Газовий закон – кількісна залежність між двома термодинамічними параметрами газу при фіксованому значенні третього.
Газових законів, як і ізопроцесів – три. Використовуючи рівняння стану ідеального газу, можна вивести всі три закони за 10 хвилин. Але в історії фізики ці відкриття були зроблені в зворотному порядку: спочатку експериментально було отримано газові закони, і лише потім вони були узагальнені в рівняння стану. Цей шлях зайняв майже 200 років: перший газовий закон було отримано у 1662 році фізиками Бойлем та Маріоттом, рівняння стану – в 1834 році Клапейроном, а більш загальна форма рівняння – в 1874 році Д.І.Менделєєвим.
ІII. Вивчення нового матеріалу
Наша подальша робота будується в такий спосіб:
Ми повинні заповнити таблицю, що характеризує процес (для прикладу один з процесів характеризуємо разом, а два інших – групами з наступним поясненням і презентаціями).
План викладання матеріалу.
- Визначення процесу
- Історія відкриття закону
- Формула і формулювання закону
- Графічне зображення
|
Ізопроцес |
Сталий параметр |
Газовий закон |
Формула |
Графіки |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
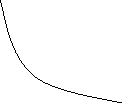
1. Ізотермічний процес – процес зміни стану термодинамічної системи при сталій температурі.
Для ідеального газу ізотермічний процес описується законом Бойля-Маріотта.
Закон встановлено експериментально до створення молекулярно-кінетичної теорії газів англійським фізиком Робертом Бойлем в 1662 році та французьким абатом Едмоном Маріоттом, який описав незалежно від Бойля аналогічні досліди 1676 році.
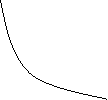
Закон Бойля-Маріотта (ізотермічний процес, T=const)
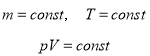
Для газу даної маси при сталій температурі добуток тиску на об’єм сталий.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
ізотерми
Закон Бойля-Маріотта справедливий для всіх газів, а також і для їх сумішей, наприклад, для повітря. Лише при тисках, в кілька сотень раз більших атмосферного, відхилення від цього закону стають суттєвими.
Ізотермічним можна приблизно вважати процес повільного стиску повітря або розширення газу під поршнем насосу при відкачуванні його з посудини. Правда температура газу при цьому змінюється, але в першому наближенні цими змінами можна знехтувати. Використовують закон Бойля-Маріотта у повітряних двигунах.
Газові закони активно працюють не лише в техніці, але й в живій природі, широко застосовуються в медицині.
2. Ізобарний процес – процес зміни стану термодинамічної системи, що протікає при сталому тиску.
Для ідеального газу ізобарний процес описується законом Гей-Люссака.
Закон встановлений в 1802 році французьким фізиком Гей-Люссаком, який визначав об’єм газу при різних значеннях температур в межах від точки кипіння води. Газ тримали в балончику, а в трубці знаходилась крапля ртуті, що закривала газ, який розміщувався горизонтально.
Закон Гей-Люссака (ізобарний процес p=const)
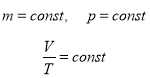
![]() Для газу даної маси при сталому тиску відношення об’єму до температури є сталою величиною.
Для газу даної маси при сталому тиску відношення об’єму до температури є сталою величиною.
![]()
![]()
![]()


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
ізобари
Ізобарним можна вважати розширення газу при нагріванні його в циліндрі з рухомим поршнем. Сталість тиску в циліндрі забезпечується атмосферним тиском на зовнішню поверхню поршня.
3. Ізохорний процес – процес зміни стану термодинамічної системи, що протікає при сталому об’ємі.
Для ідеального газу ізохорний процес описується законом Шарля.
В 1787 році французький вчений Жак Шарль виміряв тиск різних газів при нагріванні при сталому об’ємі і встановив лінійну залежність тиску від температури, але не публікував дослідження. Через 15 років до таких же результатів прийшов і Гей-Люссак і, будучи на рідкість благородним, настояв, щоб закон називався на честь Шарля.
Закон Шарля (ізохорний процес, V=const)
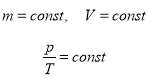
Для газу даної маси при сталому об’ємі відношення тиску до температури є величиною сталою.
![]()
![]()
![]()

![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
ізохори
Ізохорним можна вважати збільшення тиску газу в довільній ємності або в електричній лампочці при нагріванні.
IV. Закріплення знань, умінь, навичок.
1. Дано графіки процесів в різних системах координат
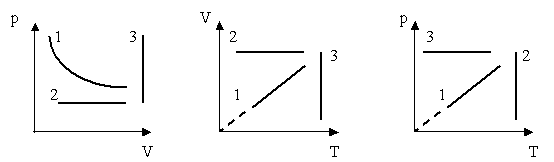
Знайти у всіх трьох системах координат:
- ізотерми;
- ізохори;
- ізобари.
2. Чим відрізняються стани А і Б газу даної маси?
![]()
![]()
![]()
![]()
![]()
![]()
![]()
3. При температурі 27оС тиск газу в закритій посудині був 75кПа. Яким буде тиск цього газу при температурі - 13оС?
|
Дано: V = const t1 = 27oC p1 = 75кПа t2 = -13oC |
300oK 75∙103Па 263oC |
|
p2 – ? |
Розв’язання:
За законом Шарля: р/Т = const.
р1/Т1 = р2/Т2,
р1Т2 = р2Т1,
р2 = р1Т2/Т1,
р2 = 75∙103∙263/300 = 65кПа.
Відповідь: 65кПа.
V. Підведення підсумків.
- Підсумок уроку.
- Рефлексія.
Інтерактивна вправа «Сходинки успіху»

Дайте оцінку роботи на уроці з позиції:
«Я» 0_____________12
«Ми» 0_____________12
«Урок» 0_____________12
- Про що нове дізнались? Чого навчились?
- Домашнє завдання: Вивчити конспект, п.42-45
-
-
-
дуже добре


про публікацію авторської розробки
Додати розробку
