Розробка уроку на тему: "Нітрогеновмісні органічні сполуки"
Мета уроку: формувати знання учнів про нітрогеновмісні сполуки; показати склад і будову амінів, білків, та амінокислот на прикладі амінооцтової кислоти; ознайомити учнів з молекулярною та структурною формулами амінооцтовоїкислоти її амфотерними властивостями; показати поширення амінокислот у природі, їх біологічну роль, застосування.
Нова програма 2018!!!
Тема уроку: Нітрогеновмісні органічні сполуки
Мета уроку: формувати знання учнів про нітрогеновмісні сполуки; показати склад і будову амінів, білків, та амінокислот на прикладі амінооцтової кислоти; ознайомити учнів з молекулярною та структурною формулами амінооцтовоїкислоти її амфотерними властивостями; показати поширення амінокислот у природі, їх біологічну роль, застосування.
Тип уроку: комбінований.
Хід уроку
I Організація класу
II Перевірка домашнього завдання.
ІІІ Актуалізація опорних знань.
IV Мотивація навчальної діяльності
V. Вивчення нового матеріалу
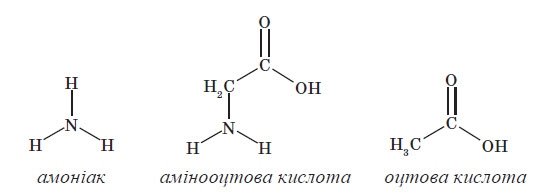
Органічні сполуки, до складу яких входить атом Нітрогену називають нітросполуками. До них належать: аміни, амінокислоти, білки.
Аміни – нітрогеновмісні органічні хімічні сполуки, похідні амоніаку (NH3), в якому атоми гідрогену заміщені однією чи багатьма групами інших атомів – вуглеводневими радикалами.
Загальна формула насичених амінів: CnH2n+1 — NH2 або CnH2n+3N.
Простий представник цього класу — метиламін (CH3 — NH2 ).
Білки – це біополімери складної будови, макромолекули (протеїни) яких, складаються із залишків амінокислот, сполучених між собою амідним (пептидним) зв'язком.
За складом білки поділяють на:
— протеїни — прості білки, що складаються із залишків амінокислот;
— протеїди — складні білки, що складаються із залишків амінокислот та різних небілкових речовин.
Амінокислоти – органічні сполуки, в молекулі яких одночасно містяться карбоксильні і аміно групи. Амінокислоти є мономерними одиницями білків, у складі яких залишки амінокислот з'єднані пептидними зв'язками. Більшість білків побудовані із комбінації дев'ятнадцяти «первинних» амінокислот, тобто таких, що містять первинну аміногрупу, і однієї «вторинної» амінокислоти або імінокислоти (містить вторинну аміногрупу) проліну, що кодуються генетичним кодом. Їх називають стандартними або протеїногенними амінокислотами. Крім стандартних в живих організмах зустрічаються інші амінокислоти, які можуть входити до складу білків або виконувати інші функції.
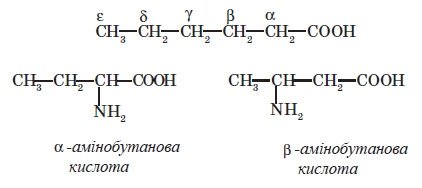
Назви амінокислот походять від назв відповідних карбонових кислот із зазначенням положення аміногрупи. У сполуках, в яких присутні дві різні функціональні групи, їхнє взаємне розташування зазначають грецькими літерами. Так, залежно від того, до якого атома вуглецю приєднана аміногрупа, амінокислоти поділяють на а , b , y. тощо
Деякі найважливіші а-амінокислоти
|
Формула |
Назва |
Позначення |
|
Н2N - СН2 - СООН |
Гліцин |
Gly (Глі) |
|
СН3 - СН(NH2)- СООН |
Аланін |
Ala (Ала) |
|
C6H5CH2 - CH (nh2 ) - COOH |
Фенілаланін |
Phe (Фен) |
|
(CH3) CH - CH(NH2 ) - COOH |
Валін |
Val (Вал) |
|
(CH3)2CH - CH2 - CH(NH2 ) - COOH |
Лейцин |
Leu(Лей) |
|
HOCH2 - CH(NH2 ) - COOH |
Серин |
Ser (Сер) |
|
H2N - CO - CH2 - CH(NH2) - COOH |
Аспарагін |
Asn (Асн) |
Якщо в молекулі амінокислоти містяться дві аміногрупи, то в її назві використовується префікс діаміно-, три групи NH2 — триаміно- і т. д.
Наприклад:
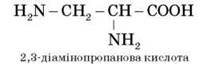
Наявність двох або трьох карбоксильних груп позначається в назві суфіксом -діова або -тріова кислота:
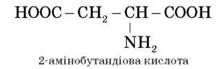
Найпростіший представник класу амінокислот має формулу H2N - CH2 - COOH — аміноетанова (або амінооцтова) кислота — перший член гомологічного ряду одноосновних насичених амінокислот.
Фізичні властивості амінокилот. Білі кристалічні речовини, добре розчинні у воді, багато які з них мають солодкий смак.
Амінокислоти дуже поширені в природі. Це цеглинки, з яких побудовані всі рослинні й тваринні білки.
2. Хімічні властивості амінооцтової кислоти
Особливості хімічних властивостей зумовлені одночасною наявністю в молекулах двох функціональних груп: основної H2N- і кислотної COOH, тому амінокислоти за хімічними властивостями — амфотерні органічні сполуки.
Як основи амінокислоти взаємодіють із кислотами (реакція приєднання):
![]()
Важлива властивість амінокислот — здатність взаємодіяти одна з одною завдяки наявності двох функціональних груп.
Міжмолекулярна взаємодія а-амінокислот приводить до утворення пептидів. У результаті взаємодії двох а-амінокислот утворюється дипептид.
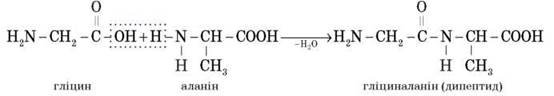
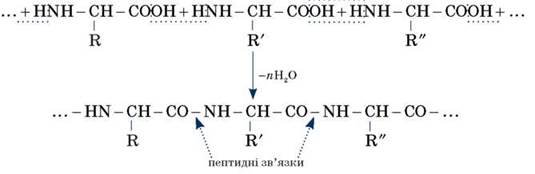
Міжмолекулярна реакція за участі трьох α-амінокислот приводить до утворення трипептиду і т. д.
Фрагменти молекул амінокислот, що утворюють пептидний ланцюг, називаються амінокислотними залишками, а зв’язок CO - NH — пептидним зв’язком.
Найважливіші природні полімери — білки — належать до поліпептидів, тобто являють собою продукт поліконденсації а-амінокислот.
3. Одержання амінокислот
• Гідроліз білків.
• Дія амоніаку на галогенозаміщені карбонові кислоти:
ClCH2 - COOH + 2H3N ![]() H2N - CH2 - COOH + NH4Cl
H2N - CH2 - COOH + NH4Cl
IV. Первинне застосування одержаних знань
1. Запишіть рівняння одержання трипептиду амінооцтової кислоти.
2. Запишіть рівняння одержання дипептиду з гліцину й валіну.
VI. Домашнє завдання


про публікацію авторської розробки
Додати розробку