Розробка уроку на тему: "Теорія хімічної будови органічних сполук О.М. Бутлєрова. Явище ізомеризації"
Метою уроку є розширити знання учнів про взаємозв'язок між складом, будовою і властивостями речовин, про хімічний зв'язок на прикладі органічних сполук; показати значення теорії як вищої форми наукових знань, етапи формування і значення теорії хімічної будови для розвитку органічної хімії; ознайомити учнів з теорією хімічної будови О. М. Бутлерова, головними положеннями теорії на прикладі будови органічних речовин; сформувати уявлення учнів про структурні формули органічних речовин.
Тема уроку: Теорія хімічної будови органічних сполук О.М. Бутлєрова. Явище ізомеризації
Мета уроку: розширити знання учнів про взаємозв’язок між складом, будовою і властивостями речовин, про хімічний зв’язок на прикладі органічних сполук; показати значення теорії як вищої форми наукових знань, етапи формування і значення теорії хімічної будови для розвитку органічної хімії; ознайомити учнів з теорією хімічної будови О. М. Бутлерова, головними положеннями теорії на прикладі будови органічних речовин; сформувати уявлення учнів про структурні формули органічних речовин.
Тип уроку: комбінований.
Хід уроку
І Організація класу. Перевірка домашнього завдання
ІІ Актуалізація опорних знань
- Чому органічну хімію називають хімією сполук Карбону?
- Чому атоми Карбону можуть утворювати хімічні зв’язки між собою?
- Які елементи, крім Карбону, найчастіше трапляються в органічних сполуках?
ІІІ Мотивація навчальної діяльності
Коли була відкрита та вивчена велика кількість різноманітних сполук, виникла необхідність в їх визначенні та класифікації. В середині XVII століття англійські хіміки Юнгіус та Бойль сформулювали поняття елемента. Елементами вони назвали прості речовини, які не розкладаються на більш прості. Із окремих елементів утворюються сполуки. Елементів порівняно небагато зараз їх існує трохи більше ста.
І є серед них один, гідний особливого шанування. Ні, це не золото, “цар металів”, що претендувало на роль володаря душ людських. І не залізо, яке дозволило людині вибратись із кам’яного віку. Навіть не уран, розщеплення якого відкрило вік атомний. Ні! Йдеться про звичайний вуглець, із якого майже цілком складається не тільки кам’яне та деревне вугілля, але і вся жива природа. Ось чому вуглецю, патріарху органічних речовин, елементу життя, ми віддали першість серед сотень інших.
ІV Вивчення нового матеріалу
Органічна хімія як наука оформилася на початку XIX ст. Перша теорія в органічній хімії – теорія радикалів. Хіміками було виявлено, що при хімічних перетвореннях групи з кількох атомів в незмінному вигляді переходять з молекули однієї речовини в молекулу іншої речовини, подібно до того як переходять з молекули в молекулу атоми елементів. Такі «незмінні» групи атомів і отримали назву радикалів.
Однак далеко не всі вчені були згодні з теорією радикалів. Багато хто взагалі відкидали ідею атомістики – уявлення про складну будову молекули і існуванні атома як її складової частини. Те, що незаперечно доведено в наші дні і не викликає ні найменших сумнівів, у XIX ст. було предметом запеклих суперечок.
Теорію радикалів змінила теорія типів, відповідно до якої передбачалося, що реакції органічних речовин подібні з реакціями найпростіших неорганічних сполук. Основоположник цієї теорії Ш. Жерар запропонував розділити органічні речовини на групи, близькі за своїм типом до води, хлороводню, аміаку і т. д. У багатьох випадках одне і те ж з’єднання зображували десятками типових формул. У міру накопичення експериментального матеріалу теорія типів зайшла в глухий кут.
Зазнало поразки і вчення про віталізмі, яке, як ви вже знаєте, що не встояло перед досягненнями практичної хімії.
Органічна хімія накопичувала все більше фактів про з’єднаннях вуглецю, число яких постійно зростала.
Пояснити причини різноманіття органічних речовин вчені не могли. Ще більше питань викликало існування ізомерів. Ці речовини мали зовсім однаковий склад, але проявляли при цьому різні фізичні і хімічні властивості. Вже відомий вам Ф. Велер в одному з листів Й. Я. Берцелиусу так описував органічну хімію того часу: «Органічна хімія може зараз кого завгодно звести з розуму. Вона здається мені дрімучим лісом, повним дивних речей, безмежної хащами, з якої не можна вибратися, куди не наважуються проникнути … »
Великий вплив на розвиток хімії в цей час надали роботи англійського хіміка Е. Франкланда, який, спираючись на ідеї атомістики, у 1853 р ввів поняття «валентність». Однак валентність вуглецю у багатьох з’єднаннях, наприклад в етан С2Н6 і пропані С3Н8, викликала ще більше питань. У 1857 р німецький хімік Ф. А. Кекуле відніс вуглець до чотиривалентність елементам, а в 1858 р він одночасно з шотландським хіміком А. Купером (1831-1892) відзначив, що атоми вуглецю здатні з’єднуватися один з одним в різні ланцюги.
Однак за вже встановленими фактами і приватними висновками і Франкланд, і Кекуле не побачили загальної концепції. Залишався відкритим питання, як визначати будова молекули. Була необхідна наукова теорія органічних сполук. Така теорія була створена російським ученим Олександром Михайловичем Бутлеровим. Саме його допитливий розум «насмілився проникнути» в «дрімучий ліс» органічної хімії і почати перетворення цієї «безмежної хащі» в залитий сонячним світлом регулярний парк з системою доріжок і алей.
Основні ідеї нової теорії вперше були висловлені Бутлеровим в 1861 р у доповіді «Про хімічному будову речовин» на з’їзді німецьких природознавців і лікарів у м Шпейере.
Основні положення та поняття теорії хімічної будови утворюють струнку логічну систему, без якої неможлива робота сучасного хіміка-органіка.
До цієї системи входять такі положення:
1. Атоми в молекулах з’єднані один з одним попарно хімічними зв’язками у відповідності з їх валентністю;
2. Молекули мають визначений порядок (або послідовність) в розподілу зв’язків між атомами, тобто визначену хімічну будову;
3. Властивості хімічних сполук залежать від хімічної будови їх молекул; із цього положення випливає ряд висновків:
а) вивчаючи властивості речовин, можна скласти уявлення про їх хімічну будову, а знаючи хімічну будову навіть неодержаних речовин, можна передбачити, які вони матимуть властивості;
б) причиною ізомерії є різниця в хімічній будові речовин, що мають однаковий склад;
в) формули хімічної будови дають уявлення і про властивості сполук.
- Атоми в молекулах впливають один на одного, ця дія неоднаково позначається на властивостях атомів одних і тих же елементів, якщо хімічна будова молекул різна.
Розглянемо докладніше положення теорії будови органічних сполук. Властивості речовини залежать від того, з яких атомів складається його молекула. Цей склад відображає молекулярна формула. Молекула метану СН4 складається з атомів вуглецю і водню. Ця речовина при звичайних умовах – газ, який вступає в хімічні реакції з роботою. До складу молекул метилового спирту СН3ОН, крім атомів вуглецю і водню, входить атом кисню. Метиловий спирт в тих же умовах – це вже рідина, яка здатна реагувати з різними речовинами, наприклад з сірчаною кислотою, металевим натрієм. Різні властивості цих сполук обумовлені їх різним якісним складом.
Етилен, що має молекулярну формулу С2Н4, легко полімеризується (всім добре знайомий продукт цієї реакції – поліетилен), у той час як метан СН4 до такого перетворення не здатний. Зауважте, що молекули обох цих речовин мають однаковий якісний склад, тобто складаються з атомів вуглецю і водню. Бути може, визначальним чинником реакційної здатності є кількісне співвідношення атомів у молекулі?
Порівняємо властивості ацетилену С2Н2 і бензолу С6Н6. Крім однакового якісного складу кількісне співвідношення числа атомів в молекулах цих речовин також збігається: на один атом вуглецю припадає один атом водню, найпростіша (емпірична) формула ацетилену і бензолу СН. Однак ацетилен легко приєднує галогени (знебарвлює бромную воду), а бензол вступає в реакцію з бромом тільки в присутності каталізатора. Отже, однакове кількісне співвідношення числа атомів в молекулах органічних речовин також не гарантує збіг їх хімічних властивостей.
При обробці етану азотною кислотою утворюється нітроетан – речовина складу C2H5NO2, безбарвна рідина з різким запахом, нерозчинна у воді. У 1820 р французький хімік А. Браконно (1780 1855) з продуктів гідролізу тваринних тканин виділив безбарвну кристалічну речовину, без запаху, солодкуватого смаку, легко розчинну у воді. Сьогодні цю речовину називають гліцином. Той факт, що гліцин має таку ж молекулярну формулу, як і нітроетан, – C2H5NO2, руйнує гіпотезу про збіг властивостей речовин з однаковим якісним і кількісним складом. Як виявилося, не тільки фізичні, але й хімічні властивості нітроетан і гліцину докорінно різняться. Як ви, напевно, здогадалися, ми зіткнулися з дуже поширеним в органічній хімії явищем, яке називається ізомерією.
Речовини однакового складу, а отже, мають і однакову молекулярну масу, також можуть відрізнятися за властивостями, якщо вони мають різну хімічну будову. Такі речовини, як ви знаєте, називаються ізомерами, а явище – ізомерією. Причиною ізомерії є різний порядок розташування атомів в молекулі. Молекулярна формула показує тільки якісний і кількісний склад з’єднання, але не несе інформації про порядок зв’язків атомів в молекулі. Так, для молекул формули С4Н10 можливі два різних порядку зв’язку атомів вуглецю в ланцюзі. До ланцюга з трьох атомів вуглецю четвертий вуглецевий атом може бути приєднаний двома способами: або до одного з крайніх атомів, або до середнього атому. Дійсно, молекулярна формула С4Н10 відповідає двом різним з’єднанням, що відрізняється розташуванням атомів в молекулах: нормальному бутану (н – бутану), тобто Сполуки, що містяться нерозгалужений ланцюг атомів вуглецю, в ізобутані, молекула якого має розгалужену будова.
Фізичні властивості цих сполук відрізняються: ізобутан має більш низькі температури кипіння і плавлення, ніж н-бутан. Хімічні властивості даних ізомерів розрізняються незначно, так як вони мають однакові якісний склад і характер зв’язку між атомами в молекулі.
Ізомерія та гомологія органічних сполук
Ізомерія. Хімікам давно відомі речовини, що мають однаковий склад, але різні властивості. Такі речовини отримали назву ізомерів, тобто речовин, які складаються з однакових частин. Пояснення причин ізомерії було дуже важким завданням, що стояло перед вченими більш 30 років. Тільки Бутлерову вдалось вперше пояснити це явище. Відповідно його теорії, хімічні властивості речовин визначаються їх складом та будовою. Різницю у властивостях двох або більше органічних речовин, що мають однаковий склад, можна пояснити різницею в їх хімічній будові. Таке геніально просте вирішення проблеми ізомерії намічене Бутлеровим ще в 1862 році в статті “Про різні пояснення деяких випадків ізомерії”.
На основі праць Бутлерова стало можливим систематичне і вичерпне виведення структурних формул органічних сполук, що відповідають емпіричній формулі. Схема таких висновків, що базується на поняттях хімічної будови молекул і ва-лентності елементів, була дана Бутлеровим в 1864 році. Застосовуючи цю схему, він прийшов до висновку про існування трьох ізомерних пентанів:
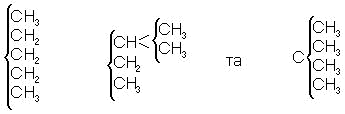
Виведення формул теоретично можливих ізомерів допомогло визначити будову багатьох вже відомих сполук, а в ряді випадків виявити тотожність речовин, що вважались раніше різними; він полегшив планомірний синтез органічних сполук і, що особливо важливо, дозволив виявити факти, які суперечать теорії і призводять до її подальшого розвитку.
Серед органічних сполук зустрічаються такі основні класи ізомерії.
- Вуглецевий скелет ізомерів однаковий.
А. Однакова і функціональна група, але вона знаходиться в різних положеннях молекули, що спостерігається, наприклад, для гліцеринового альдегіду та діоксіацетону:

В. Різна функціональна група ізомерів, як це видно при порівнянні оцтової кислоти та гліколевого альдегіду:
![]()
оцтова кислота
гліколевий альдегід
- Ізомери відрізняються будовою вуглецевого скелету молекул А. Ізомери мають спільне вуглецеве ядро:

Б. Метамерія сполук, що містять різні вуглецеві радикали, зв'язані через гетероатом. Класичним прикладом метамерів можуть служити етилформіат та метилацетат:

В. Структурно- іонізаційна ізомерія, до якої може бути віднесена і стехіометрія Уеланда, пов’язана з утворенням ізомерних речовин по іонному типу:
[CH3NH3]+[HCOO] - [NH4]+[CH3COO] -
форміат метиламонію ацетат амонію

Таким чином, з точки зору теорії А. М. Бутлерова існування ізомерів – НЕ загадкове явище, яке суперечить уявленням людей про навколишній світ, а закономірний результат варіативності з’єднання атомів в молекулі.
Очевидно, що здатність атомів вуглецю з’єднуватися один з одним і утворювати «ланцюга» легко пояснює «неправильну» формальну валентність вуглецю в етан С2Н6 (формальна валентність 3), пропані С3Н8 (формальна валентність 8/3) та інших органічних сполуках. Структурні формули, наприклад бутану й ізобутану, лише підтверджують це.
Різну кількість атомів вуглецю в молекулах і їх здатність, з’єднуючись один з одним, утворювати різні комбінації («скелети» молекул) роблять зрозумілою причину різноманіття органічних речовин.


про публікацію авторської розробки
Додати розробку
