Розробка уроку Тема уроку: «Перший закон термодинаміки. Адіабатний процес»
Опорний конспект учня 10-го класу (№28)
Тема уроку: «Перший закон термодинаміки. Адіабатний процес»
Мета: сформувати поняття адіабатного процесу; ознайомити з першим законом термодинаміки та його застосуванням для різних ізопроцесів.
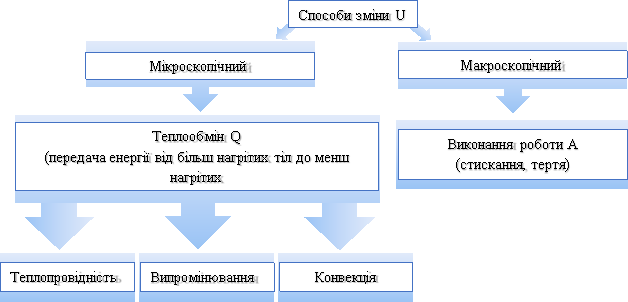 Пригадуємо!
Пригадуємо!
Газ циліндрі під поршнем може нагріватися за рахунок передачі йому певної кількості теплоти, і одночасно може виконуватися робота на його розширення і стискання.
![]()
![]()


Історична довідка
|
1842 р. німецький лікар Роберт Маєр теоретично, а згодом в 1843 р. англійський фізик Джеймс Джоуль експериментально довели еквівалентність кількості теплоти Q і роботи A як міри внутрішньої енергії U. |
Спираючись на проведені досліди, вчені встановили закон згідно з яким:
![]() Кількість енергії в природі незмінна, вона лише переходить від одних тіл до інших або перетворюється з одного виду в інший.
Кількість енергії в природі незмінна, вона лише переходить від одних тіл до інших або перетворюється з одного виду в інший.
Це твердження ще називають законом збереження і перетворення енергії. Воно є універсальним і може бути застосоване до всіх явищ природи.
Дізнаємося!
У теплових процесах закон збереження і перетворення енергії отримав назву першого закону термодинаміки!
 Слід зауважити, що при теплообміні з навколишнім середовищем газ, нагріваючись, виконує роботу проти зовнішніх сил. А коли газ охолоджується – зовнішні сили виконують роботу над газом.
Слід зауважити, що при теплообміні з навколишнім середовищем газ, нагріваючись, виконує роботу проти зовнішніх сил. А коли газ охолоджується – зовнішні сили виконують роботу над газом.
Введемо позначення: ![]() - робота газу проти зовнішніх сил;
- робота газу проти зовнішніх сил;
![]() - робота зовнішніх сил, що діють на газ;
- робота зовнішніх сил, що діють на газ;
Робота А/ відрізняється від А лише знаком: ![]()
Формулювання першого закону термодинаміки:


Проблема створення вічного
двигуна першого роду:
будучи раз запущеним у процес, такий двигун здійснював би
роботу необмежено довго, не беручи енергію ззовні.
Чи можливий такий процес в реальному житті?
![]()
Дане твердження суперечить закону збереження і перетворення енергії!
Бо тоді Q = 0, а робота виконувалася б лише
за рахунок зменшення внутрішньої енергії.
![]()
Тому, неможливо побудувати «вічний двигун першого роду» - оскільки неможливо нескінченно довго виконувати роботу за рахунок скінченної внутрішньої енергії будь-якої системи.
Важливо!
![]() У природі можливий процес при якому Q = 0.
У природі можливий процес при якому Q = 0.
Процес, що відбувається без теплообміну з навколишнім середовищем (в теплоізольованій системі), називають адіабатним процесом.
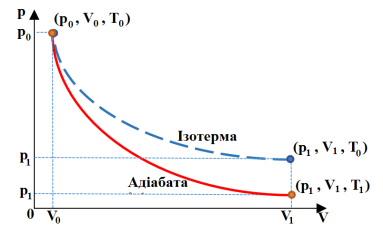 Графічно адіабатний процес представляться на координатній площині р(V). Криву даного процесу називають адіабатою. Її порівнюють з ізотермою ідеального газу.
Графічно адіабатний процес представляться на координатній площині р(V). Криву даного процесу називають адіабатою. Її порівнюють з ізотермою ідеального газу.
Адіабата спадає стрімкіше, ніж ізотерма, оскільки при адіабатному процесі зміна тиску відбувається за рахунок одночасного збільшення об’єму і зменшення температури.
Реальні процеси дуже близькі до адіабатних. Для цього вони мають здійснюватися дуже швидко, щоб за час їх перебігу не відбувалося теплообміну з навколишнім середовищем. Тому будь-який газ при швидкому стисканні нагрівається, а при швидкому розширенні – охолоджується.
Демонстрація: перегляньте відеопосилання https://youtu.be/lQ3yUkAYBpo.
Дайте відповідь на запитання: Чому в бутлі утворюється туман?
Міркуємо!
Як же застосувати перший закон термодинаміки до ізопроцесів?
Пригадаємо вирази для знаходження Q, А та U
![]() ,
, ![]() ,
,
![]() ,
, ![]() ,
,
Демонстрація: перегляньте наступні відеопосилання для повторення та закріплення знань:
https://youtu.be/VxUbA1AGcyM - ізотермічний процес;
https://youtu.be/toF9V4V6WWA - ізобарний процес;
https://youtu.be/ti7qrhTEopE - ізохорний процес;
https://youtu.be/D12l3GqpNUM - адіабатний процес.
Отже, враховуючи наведені вище закономірності, маємо:
|
Ізотермічний |
Ізобарний |
Ізохорний |
Адіабатний |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Уся передана газу кількість теплоти йде на виконання ним роботи. |
Підведена до газу кількість теплоти йде на зміну його внутрішньої енергії і виконання роботи. |
Вся підведена до газу кількість теплоти йде на зміну його внутрішньої енергії. |
При розширенні газу виконується робота за рахунок внутрішньої енергії газу. |
Домашнє завдання: §24 читати, вивчити опорний конспект уроку. Переглянути приклади розв’язування задач на ст. 157-158.


про публікацію авторської розробки
Додати розробку
