Розробки уроків "Будова атома, періодична система 8 клас"
Шишацький ліцей Полтавської обласної ради
Навчальний посібник
Розробка циклу уроків з теми:
періодичний закон і будова атома
Підготував:
Бородавка Олександр Миколайович
учитель хімії
учитель вищої кваліфікаційної категорії
Шишацького ліцею
Полтавської обласної ради
Шишаки – 2022
Анотація
У даній роботі логічно і послідовно викладено одну із найважливіших тем із шкільного курсу хімії. Правильне розуміння будови атома дозволить учням краще і легше засвоювати наступні теми, які безпосередньо базуються на знанні структури періодичної системи, та будові електронної оболонки атома.
Дана тема обумовлена необхідністю формування в учнів єдиної загальнонаукової картини світу за умов постійного збільшення обсягу навчальної інформації та браку часу на їх засвоєння, а також розкриття важливості міжпредметних зав’язків на уроках хімії як засобу формування творчого мислення та активізації розумової діяльності.
Цілісність у викладанні предметів загальноосвітніх, спеціальних дисциплін, практичної підготовки, спрямовується на розвиток особистості здобувача освіти, його задатків, інтелекту, пам’яті, здатності до самоосвіти, формування наукового світогляду, навчання впродовж життя.
Зміст
ВСТУП………………………………………………………...……………….….4
РОЗДІЛ 1. БУДОВА АТОМА…………………………...…………………….…5
1.1.Тема: стан електронів у атомі……………………………………...….5
1.2.Тема: будова електронних оболонок атомів…………………………8
1.3.Тема: будова електронних оболонок атомів. Енергетичні рівні та підрівні…………………………………………………………………….14
РОЗДІЛ 2. ПЕРІОДИЧНА СИСТЕМА……………………………………...….17
2.1.Тема: структура періодичної системи у світлі теорії будови атома.17
2.2.Тема: взаємозв’язок між розміщенням елементів у періодичній….23
2.3.Тема: характеристика елементів за положенням у періодичній системі і будовою атома та властивостями (частина 1)………………..25
2.4.Тема: характеристика елементів за положенням у періодичній системі і будовою атома та властивостями (частина 2)………………..27
2.5.Тема: значення періодичного закону. Життя і діяльність Д.І. Менделєєва……………………………………………………………..…29
ВИСНОВКИ……………………………………………………………………..33
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ……………………………………….34
Вступ
Пропонований посібник призначається для використання на уроках з хімії у 8 класі. Він містить матеріали та вправи, передбачені програмою курсу для загальноосвітніх навчальних закладів. Хімія. 7-9 класи. Навчальна програма для загальноосвітніх навчальних закладів»// Наказ МОН №804 від 07.06.2017 р.
Завданнями посібника є полегшення роботи вчителя при підготовці до уроку, та систематизація інформації з даної теми.
У збірнику вміщено різноманітні завдання, які охоплюють тему курсу хімії 8 класу. Вони в логічній послідовності розкривають основні поняття та закони хімії, будову і властивості неорганічних сполук , їх генетичний зв’язок на основі періодичного закону і будови атома.
Весь матеріал розділений за темами. Також ним можуть користуватися учні для самопідготовки і самоперевірки набутих знань по неорганічній хімії.
РОЗДІЛ 1. БУДОВА АТОМА
1.1.Тема: СТАН ЕЛЕКТРОНІВ У АТОМІ
Цілі уроку: ознайомити учнів з рухом електронів у атомах; увести нові
поняття (електронна орбіталь, енергетичний рівень, квантові числа,
напрямок орбіталі в просторі, спін); показати учням двоїсту природу електрона, утворення орбіталей під час руху електронів навколо ядра; пояснити істотну відмінність між хімічною та ядерною реакціями.
Тип уроку: засвоєння нових знань.
Форми роботи: фронтальне опитування, розповідь учителя, робота з навчальною схемою.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, навчальна схема.
ХІД УРОКУ
II. Актуалізація опорних знань, постановка завдання
Звернемося до сучасного формулювання періодичного закону. (Учні наводять формулювання.)
Положення кожного елемента в періодичній системі суворо регламентовано будовою атома.
Електрон — це частинка, маса спокою якої — m(e) = 9,1 10-31 кг, заряд —
e =-1,6 10-19 Кл.
У теорії будови атома Резерфорда передбачалося, що рух електрона навколо ядра відбувається за певною траєкторією — орбітою, і в кожен момент часу ми можемо знайти його. Але насправді це було помилкою. Виявилося, що рух електрона значно складніший. Швидкість його обертання навколо ядра настільки велика, що в масштабах атома поняття траєкторії втрачає зміст. Тому не можна розглядати електрон як частинку, що рухається та положення якої в просторі точно відоме в будь-який момент часу. Можна лише вказати деяку частину простору навколо ядра, в якому перебування електрона є найбільш імовірним. Ця частина простору навколо ядра називається електронною хмариною, або електронною орбіталю. (Проектуємо на екран або показуємо на плакаті зображення електронної хмарини атома Гідрогену.)
Електронна орбіталь — це простір навколо ядра атома, в якому найбільш імовірне перебування електрона.
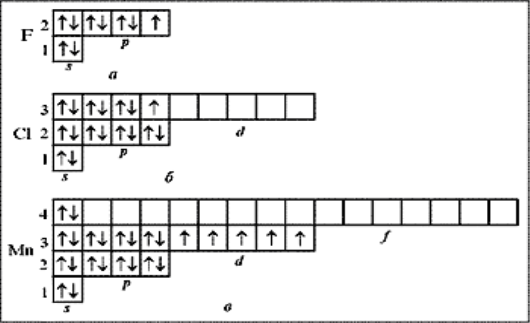
Електронні орбіталі різняться за формою й напрямком у просторі. Ці електронні орбіталі різної форми позначаються літерами s — сферична, p — гантелеподібна, d, f.
Електронні орбіталі, що є більш складними, ніж f-орбіталі, в атомах, описаних у періодичній системі на сьогодні, не використовуються.
На s-підрівні така квантова комірка лише одна, умовно позначається або _.
На р-підрівні їх три або _ _ _.
На d-підрівні їх п’ять або _ _ _ _ _.
На f-підрівні їх сім .
Кожна квантова комірка може розмістити лише два електрони з протилежно напрямленими спінами.
Крім руху навколо ядра, електрон має ще і власний обертовий рух навколо своєї осі. Спін – це рух електрона навколо своєї осі. Цей рух описує спінове квантове число (або спін, від слова «веретено»). Набуває два значення: +![]() або -
або -![]() Для запису ми використовуємо умовну позначку електронів ↑ або ↓.
Для запису ми використовуємо умовну позначку електронів ↑ або ↓.
У квантовій комірці можуть знаходитись або один електрон, або два електрони, але з протилежними спінами ↑↓.
• Чому негативні електрони не падають на позитивно заряджене ядро? (Тому що електрони обертаються навколо ядра з величезною швидкістю)
• Що необхідно електрону, щоб обертатися з такою швидкістю й утримуватися біля ядра, а не полетіти? (Відповідний запас енергії)
Моделі атомів передбачають розташування електронів на різних відстанях від ядра. Електрони з більшими чи меншими запасами енергії розташовуватимуться ближче до ядра?
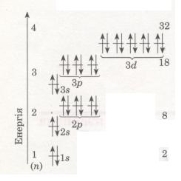
Енергія розподіляється між електронами порціями. Тому розташування електронів навколо ядра обмежується енергетичними рівнями. Кількість енергетичних рівнів у атомі описується головним квантовим числом n і дорівнює номеру періоду, в якому знаходиться атом.
![]() Наприклад:
Наприклад:
ІV. Узагальнення й систематизація
1. Як визначити кількість електронів у атомі?
2. Де розподіляються електрони в атомі?
3. Які форми мають електронні орбіталі?
4. Як розподіляються електрони в атомі на різних енергетичних рівнях?
5. Якими квантовими числами описується стан електронів у атомі?
1.2.Тема: БУДОВА ЕЛЕКТРОННИХ ОБОЛОНОК АТОМІВ. ЕНЕРГЕТИЧНІ РІВНІ ТА ПІДРІВНІ
Цілі уроку: розширити уяву учнів про будову атомів, навчити складати електронні формули, схеми розподілу електронів по квантових комірках для елементів I-III періодів, сформувати вміння учнів визначати електронну будову атома за його положенням у період. системі, формувати уявлення про єдність природи матеріального світу.
Тип уроку: вивчення нового матеріалу.
Форми роботи: бесіда, опитування, робота зі схемами.
Обладнання: періодична система хімічних елементів, моделі електронних оболонок.
ХІД УРОКУ
1.Організаційний момент
2. Повторення попередньої теми
- Що таке електрон?
- Що таке електронна орбіталь?
- Форми електронних орбіталей?
- Максимальна кількість електронів на кожній з орбіталей?
- Що таке спін? Які вони бувають?
3. Основна частина
Ви вже знаєте, що атом складається з ядра і електронів, які утворюють електронну оболонку атома.
Число електронів на оболонці атома дорівнює числу протонів у ядрі і визначається за порядковим номером елемента у період. системі.
Електрони в атомі розміщуються на різній відстані від ядра. Це пояснюється тим, що електрони мають різний запас внутрішньої енергії.
Одні з них сильніше притягуються до ядра і розміщуються ближче до нього, їх важче відірвати з електронної оболонки. Інші слабше притягуються і перебувають далі від ядра.
Число енергетичних рівнів у атомі дорівнює номеру періода, в якому він знаходиться.
Електронна оболонка 1 періоду – 1 енергетичний рівень, другого періоду – 2 енергетичних рівні…
Кожний енергетичний рівень складається з орбіталей певної форми: перший містить s – орбіталь, другий – s і p-орбіталі, третій – s, p, d-орбіталі.
Число орбіталей на енергетичних рівнях різне, воно визначається за формулою n2, де n – номер рівня.
На першому рівні (n=1) одна s-орбіталь, на другому (n=2) містяться одна s і три p-орбіталі, на третьому - одна s, три p, п'ять d-орбіталей.
S
|
І |
|
|
P
|
ІІ |
|
|
|
|
|
|
D
|
ІІІ |
|
|
|
|
|
|
|
|
|
|
|
|
F
|
ІІІ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
Зважаючи на те, що на кожній з орбіталей може перебувати не більше 2електронів, максимальна кількість електронів на кожному рівні дорівнює 2n2.
Число ж електронів на зовнішньому енергетичному рівні електронної оболонки атома дорівнює номеру групи для елементів головних підгруп. Ці електрони називаються валентними. Саме вони визначають властивості елемента.
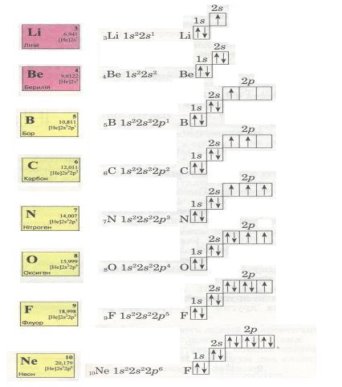
Тепер розглянемо конкретні приклади. Атом Гідрогену має найменший заряд ядра (+1), отже, й один електрон. Він розмішується на єдиній s-орбіталі, утворюючи перший енергетичний рівень. Таке уявлення можна передати за допомогою схеми
і за допомогою електронної формули 1s1, де
За Гідрогеном іде Гелій. Його атом містить ядро із зарядом +2, біля якого рухаються два електрони на тому самому першому енергетичному рівні:
Оскільки на першому енергетичному рівні може перебувати тільки два електрони, то в атомі Гелію перший рівень є завершеним.
В елементів другого періоду починає формуватися другий енергетичний рівень, на якому може перебувати не більше 8 електронів.
Спробуй самостійно записати електронні формули елементів другого періоду і покажи розподіл електронів за енергетичними комірками. Ось що виходить:
Електрони заповнюють енергетичні рівні в порядку послаблення притягання їх до ядра: спочатку s-, потім р-орбіталі, далі по одному, а якщо їх більше за число орбіталей, то по два, утворюючи електронні пари з протилежними спінами.
Оскільки на зовнішньому енергетичному рівні не може бути більше 8 електронів, то в атомі Неону другий рівень є завершеним.
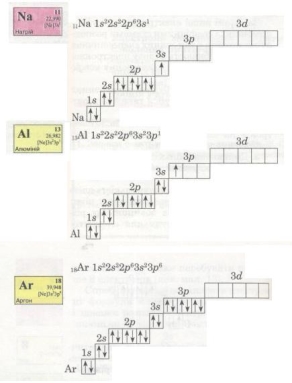
В електронній оболонці атомів елементів третього періоду починає формуватися третій енергетичний рівень. Згідно з формулою 2n2 на ньому може бути максимально 18 електронів, але повністю забудуватися він не встигає (чому?).
В атомі Аргону зовнішній енергетичний рівень містить 8 електронів, отже, він завершений. Проте забудова третього рівня цим не вичерпується, бо він може містити загалом 18 електронів, тобто ще 10 електронів на d-підрівні. Цей підрі-вень формуватиметься далі, у наступному періоді (вивчатиметься пізніше).
Записані вище електронні формули у поєднанні з графічними схемами розподілу електронів у так званих енергетичних комірках відбивають будову електронної І оболонки атома, його електронну конфігурацію.
Складаючи схеми будови електронних оболонок атомів, керуйся таким алгоритмом:
1. Спершу визнач загальне число електронів на електронній оболонці за протонним числом елемента.
2. Далі визнач кількість енергетичних рівнів у електронній оболонці за номером періоду.
3. Визнач максимальну кількість електронів на кожному енергетичному рівні за формулою 2n2 (на зовнішньому рівні — за номером групи для елементів головних підгруп).
4. Пригадай, що кількість форм орбіталей, які утворюють даний енергетичний рівень, дорівнює номеру цього рівня.
5. Не забудь, що на кожній орбіталі може перебувати максимум два електрони (з протилежними спінами).
ВИСНОВКИ
Електрони в атомі мають різну енергію зв'язку з ядром: чим вона більша, тим ближче до ядра розміщується електрон. У результаті електрони в атомі розподіляються шарами, на різних енергетичних рівнях. Максимальна кількість електронів на даному рівні дорівнює 2n2: на першому рівні може бути тільки два електрони, на другому — вісім. Такі рівні є завершеними.
Число енергетичних рівнів дорівнює номеру періоду, в якому перебуває елемент.
Число електронів на зовнішньому рівні атома хімічного елемента дорівнює номеру групи (для елементів головних підгруп).
Електрони заповнюють енергетичні рівні в порядку послаблення притягання їх до ядра (від 1-го до наступних): спочатку s-орбіталі, потім р-орбіталі, далі по одному, а якщо їх більше за число орбіталей — то по два, утворюючи електронні пари з протилежними спінами. Розподіл електронів у атомі по орбіталях показує електронна формула.
Домашнє завдання:
1.3.Тема: БУДОВА ЕЛЕКТРОННИХ ОБОЛОНОК АТОМІВ. ЕНЕРГЕТИЧНІ РІВНІ ТА ПІДРІВНІ
Цілі уроку: розширити уяву учнів про будову атомів, навчити складати електронні формули, схеми розподілу електронів по квантових комірках для елементів I-III періодів, сформувати вміння учнів визначати електронну будову атома за його положенням у період. системі, формувати уявлення учнів про завершений і незавершений енергетичний рівень, заповнену та вільну квантову орбіталь
Тип уроку: самостійна робота.
Форми роботи: бесіда, опитування, робота з таблицею.
Обладнання: періодична система хімічних елементів, моделі електронних оболонок.
ХІД УРОКУ
1.Організаційний момент
2. Повторення попередньої теми у вигляді самостійної роботи
- Період – це вертикальний ряд хімічних елементів.
- Група – це вертикальний ряд хімічних елементів.
- Лужні метали знаходяться у II групі періодичної системи.
- Атом має заряд.
- Протон – це позитивно заряджена частинка.
- Електрон має подвійну природу.
- Електронна оболонка має чіткі межі.
- На s-орбіталі може перебувати 6 електронів.
- На р-орбіталі може перебувати 6 електронів.
- Спін – це рух електрона навколо своєї осі.
- На одній орбіталі можуть знаходитися електрони з паралельними спінами.
- Нуклонне число – це сума протонів і нейтронів.
- Заряд нейтрона +1.
- d-орбіталь містить 3 енергетичні комірки.
Правильне твердження +, не правильне –.
3. Побудова електронних оболонок атомів
|
№ елемента |
Хімічний символ |
Назва елемента |
Електронна формула |
|
1 |
H |
гідроген |
1s 1 |
|
2 |
He |
гелій |
1s 2 |
|
II період |
|||
|
3 |
Li |
літій |
1s 22s 1 |
|
4 |
Be |
берилій |
1s 22s 2 |
|
5 |
B |
бор |
1s 22s 22p 1 |
|
6 |
C |
карбон |
1s 22s 22p 2 |
|
7 |
N |
нітроген |
1s 22s 22p 3 |
|
8 |
O |
оксиген |
1s 22s 22p 4 |
|
9 |
F |
фтор |
1s 22s 22p 5 |
|
10 |
Ne |
неон |
1s 22s 22p 6 |
|
III період |
|||
|
11 |
Na |
натрій |
1s 22s 22p 63s 1 |
|
12 |
Mg |
магній |
1s 22s 22p 63s 2 |
|
13 |
Al |
алюміній |
1s 22s 22p 63s 23p1 |
|
14 |
Si |
силіцій |
1s 22s 22p 63s 23p2 |
|
15 |
P |
фосфор |
1s 22s 22p 63s 23p3 |
|
16 |
S |
сульфур |
1s 22s 22p 63s 23p4 |
|
17 |
Cl |
хлор |
1s 22s 22p 63s 23p5 |
|
18 |
Ar |
аргон |
1s 22s 22p 63s 23p6 |
|
IV період |
|||
|
19 |
K |
калій |
1s 22s 22p 63s 23p64s 1 |
|
20 |
Ca |
кальцій |
1s 22s 22p 63s 23p64s 2 |
|
21 |
Sc |
скандій |
1s 22s 22p 63s 23p64s 23d1 |
|
22 |
Ti |
титан |
1s 22s 22p 63s 23p64s 23d2 |
|
23 |
V |
ванадій |
1s 22s 22p 63s 23p64s 23d3 |
|
24 |
Cr |
хром |
1s 22s 22p 63s 23p64s 13d5 |
|
25 |
Mn |
манган |
1s 22s 22p 63s 23p64s 23d5 |
|
26 |
Fe |
ферум |
1s 22s 22p 63s 23p64s 23d6 |
|
27 |
Co |
кобальт |
1s 22s 22p 63s 23p64s 23d7 |
|
28 |
Ni |
нікель |
1s 22s 22p 63s 23p64s 23d8 |
|
29 |
Cu |
купрум |
1s 22s 22p 63s 23p64s 13d10 |
|
30 |
Zn |
цинк |
1s 22s 22p 63s 23p64s 23d10 |
Особливості заповнення d-орбіталей.
4. Домашнє завдання конспект, параграф, розбір елемента по варіантах.
РОЗДІЛ 2. ПЕРІОДИЧНА СИСТЕМА
2.1.Тема: СТРУКТУРА ПЕРІОДИЧНОЇ СИСТЕМИ У СВІТЛІ ТЕОРІЇ БУДОВИ АТОМА
Мета: узагальнити та систематизувати знання учнів про порядок заповнення електронних шарів атомів хімічних елементів; визначити зв’язок між структурою Періодичної системи та електронною будовою атомів; розвинути вміння складати формули електронних конфігурацій та записувати схеми будови електронної оболонки атомів хімічних елементів; виховати позитивне ставлення до оточуючого середовища.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, Будова електронних оболонок атомів хімічних елементів.
Тип уроку: узагальнення знань.
Методи навчання: пояснювально – ілюстративні – бесіда, розповідь; практичні – розв’язування вправ, репродуктивні, частково пошукові.
Хід уроку
І. Організаційний етап.
ІІ. Перевірка домашнього завдання.
Тестування. (10 хв.)
ІІІ. Узагальнення та систематизація знань.
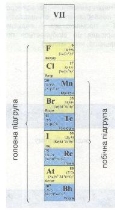
Існує понад 500 різних видів зображення періодичної системи — у вигляді таблиць, графіків, схем тощо. Найпоширенішими є табличні варіанти. Один із них ви вже знаєте. Це — короткоперіодний варіант, або коротка форма періодичної системи. Використовується ще довгоперіодний варіант, або довга форма періодичної системи. Він також був розроблений Д. І. Менделєєвим.
Нині у світі великого поширення набула довга форма. Вона дедалі стає популярнішою, оскільки краще узгоджується з будовою атомів хімічних елементів. Але за своєю суттю і коротка, і довга форми періодичної системи в цілому ідентичні (тотожні, рівнозначні). Вони доповнюють одна одну. Але в їх структурі є деякі відмінності. У довгій формі періоди займають лише одну горизонталь, на два ряди не поділяються. Ліворуч розміщуються s-елементи (позначені рожевим кольором), в атомах яких заповнюються s-орбіталі (порівняй з короткою формою періодичної системи). Праворуч розміщуються р-елементи (позначені жовтим кольором). У s- і р-елементів заповнюється зовнішній енергетичний рівень. У середній частині періодів розміщуються перехідні елементи (синій колір), в атомах яких заповнюються d –орбіталі передзовнішнього рівня. Родини лантаноїдів та актиноїдів (зелений колір) — це f-елементи. В їх атомах заповнюється третій зовнішній рівень. Як правило, ці родини виносять за межі таблиці, як у короткій, так і в довгій формах. Відмінність у послідовності заповнення енергетичних рівнів (зовнішніх і розміщених глибше) пояснює причину різної довжини періодів.
Яка ж структура короткої форми періодичної системи? Основними структурними одиницями є періоди і групи.
Період — це горизонтальний ряд хімічних елементів, розміщених у порядку зростання їх відносних атомних мас, що починається лужним металом і закінчується інертним газом.
• Визнач за періодичною системою, які періоди є винятком з цього правила (чому?).
Усього періодів сім. Із них перші три — малі періоди, бо кожний складається з одного ряду хімічних елементів. Починаючи з четвертого, ідуть великі періоди (кожний складається з двох рядів). Усього рядів десять. Кожний період містить певне число хімічних елементів:
1- й період (малий) — 2 елементи;
2- й період (малий) — 8 елементів;
3- й період (малий) — 8 елементів;
4- й період (великий) — 18 елементів;
5- й період (великий) — 18 елементів;
6- й період (великий) — 32 елементи;
7- й період (великий) — досі ще не завершений, містить поки що 24 елементи.
 .
.
Група — це вертикальний стовпчик, в якому один під одним розміщені подібні за властивостями хімічні елементи.
Усього груп вісім. Кожна з них поділяється на дві підгрупи: А — головну, до складу якої входять елементи малих періодів (типові) і Б — побічну, яка складається тільки з елементів великих періодів, вони є неповними аналогами типових елементів і навіть можуть дуже відрізнятися від них за властивостями. Так, сьома група складається з головної підгрупи — Флуор, Хлор (типові елементи) та їх аналоги — Бром, Йод, Астат, і побічної, до складу якої входять елементи тільки великих періодів — Манган,
Технецій, Реній. Елементи головної підгрупи — активні неметали, а елементи побічної — метали. У елементів однієї групи подібна електронна конфігурація атомів. В атомах Літію і Натрію, що розташовані в першій групі Періодичної системи, на завнішньому шарі міститься по одному електрону на s-орбіталях. Відмінність тільки в тому, що у Літію зовнішнім є другий енергетичний рівень, а у Натрію – третій. Так само і в атомів Оксигену і Сульфуру. Ці обидва елементи входять до шостої групи і на зовнішніх рівнях у їх атомах по шість електронів, що однаково розподілені по s- i p-підрівнях. Одже ці дві пари є електронними аналогами.
Якщо розглядати електронні конфігурації двох елементів однієї побічної групи, то ми бачимо таку саму подібність. Наприклад. Елементи побічної підгрупи четвертої групи Ті (1s2 2s2 2p6 3s2 3p6 4s23d2) i Zr (1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d2) мають різну кількість енергетичних рівнів, але подібну будову зовнішнього енергетичного рівня.
Коли ви знайомилися із структурою Періодичної системи, то вивчали, що в групи об’єднані хімічні елементи з подібними властивостями. Тепер на підставі електронної будови атомів можна стверджувати, що ця подібність, а першу чергу, обумовлюється електронною аналогією. Будова зовнішнього енергетичного шару атомів хімічний елементів, що входять до однієї підгрупи, подібна.
Розподілення елементів по головних і побічних підгрупах також обумовлюється будовою електронних оболонок. До головних підгруп входять тільки елементи, у яких заповнюється зовнішній енергетичний рівень, а в побічні підгрупи входять елементи, у яких заповнюється перед зовнішній енергетичний шар.
Знаючи положення елемента в Періодичній системі, можна визначити його електронну конфігурацію і записати електронну формулу.
Зв’язок між положенням хімічних елементів у Періодичній системі та будовою їхніх атомів
|
Періодична система хімічних елементів |
Будова атома
|
|
Порядковий номер елемента |
а) величина заряду атома; б) кількість протонів у ядрі; в) кількість електронів в атомі. |
|
Номер періоду |
Кількість енергетичних рівнів в атомі |
|
Номер групи |
а) для елементів головних підгруп – кількість електронів на зовнішньому енергетичному рівні (валентних електронів); б) максимальна кількість електронів, що можуть брати участь в утворенні хімічних зв’язків. |
ПОНЯТТЯ ПРО РАДІУС АТОМА
Вам вже відомо, що в періодах у міру зростання заряду ядра атомів елементів послідовно змінюється структура зовнішнього енергетичного рівня (кількість валентних електронів). Саме з цим пов'язана зміна властивостей елементів, тобто тих ознак, які становлять їх відмінну особливість. Такими ознаками можуть бути радіус атома, електронегативність, металічний або неметалічний характер елемента та його сполук тощо.

Порівняльний розмір йонів.
Радіус атома – це відстань від центра ядра до сферичної поверхні, якої торкаються орбіталі з електронами останнього енергетичного рівня. У періодах із зростанням зарядів ядер атомів елементів притягання ядром електронної оболонки посилюється — відбувається своєрідне «стискання» їх, і радіус атомів і йонів зменшується. Наприклад, у разі переходу від Літію до Неону заряд ядра поступово збільшується (від +3 до +10), що зумовлює зростання сил притягання електронів до ядра. Розміри атомів при цьому зменшуються. Тому на початку періодів розміщуються елементи, в яких невелике число валентних електронів (на зовнішньому енергетичному рівні) і великий радіус атома. А в групах навпаки: зі збільшенням кількості енергетичних рівнів радіус атома збільшується.
У періодах із зростанням протонного числа радіус атомів елементів зменшується, а в групах (головних підгрупах) — збільшується.
Зрозуміло, чим більший радіус атома, тим далі від ядра перебувають валентні електрони і тим слабкіше вони зв'язані з ядром, отже, легше від нього відриваються. Така структура атома характерна для елементів-металів. (В підручнику мал. 69, 70)
• Схарактеризуй електронну будову атомів елементів, розміщених у періодичній системі на- І прикінці періодів, наприклад 2-го чи 3-го. До яких родин елементів вони мають належати?
Електронегативність. Відносна легкість відривання електронів є головною особливістю елементів з металічними властивостями. Атоми металів порівняно легко віддають валентні електрони і не можуть приєднувати їх для добудови свого зовнішнього енергетичного рівня до його завершення. В цьому разі говорять, що для атомів металів електронегативність не характерна.
Електронегативністю елемента називають властивість його атомів відтягувати на себе електронну густину (порівняно з іншими елементами сполуки).
Чим вище електронегативність елемента, тим яскравіше виявлені у нього неметалічні властивості. За зниженням електронегативності елементи розміщуються у такий ряд:
F > O > N > Cl > Br > S > P > C > H > Si > Al > Mg > Ca > Na > K > Cs
Отже, найбільша здатність до притягання електронів у Флуору, а найменша у Цезію.
Уперше шкалу електронегативностей елементів розробив американський хімік Лайнус Полінг (1932 p.). Він виявив загальну тенденцію зміни електронегативностей елементів у періодичній системі:
у періодах електронегативність елементів зростає зліва направо, а в групах — знизу вгору.
Як пояснити таку закономірність? Вона пояснюється тим, що в періодах у міру зростання зарядів ядер атомів кількість валентних електронів збільшується, радіус атомів зменшується, а їх здатність до приєднання електронів, яких не вистачає до завершення зовнішнього рівня, зростає. Отже, електронегативність збільшується. А в головних підгрупах навпаки: радіус атомів зростає, зв'язок валентних електронів з ядром послаблюється і приєднання нових електронів утруднюється, тобто електронегативність зменшується.
Зміна металічних і неметалічних властивостей елементів. Металічний або неметалічний характер елемента залежить від електронної будови його атома. Розглянемо, наприклад, елементи 3-го періоду. Зверни увагу, як закономірно змінюється електронна конфігурація їх атомів. (Елементи третього періоду):
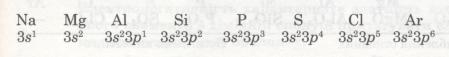
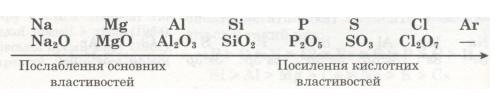
В атомах елементів від Na до Аl на зовнішньому рівні мало електронів (1, 2, 3). Радіус атомів зменшується. Отже, зв'язок зовнішніх електронів з ядром поступово посилюється за рахунок притягання до ядра, і здатність атомів віддавати ці електрони зменшується. Це означає, що металічні властивості елементів від Na до Аl послаблюються (Алюміній — перехідний елемент). Неметалічні ж властивості навпаки посилюються від Силіцію до Фосфору і Сульфуру. Найяскравіше вони виражені у Хлору — галогену. Це пояснюється тим, що зростає кількість електронів зовнішнього рівня, радіус атомів зменшується, отже, притягання до ядра посилюється й посилюється електронегативність, тобто здатність до приєднання електронів. А це означає, що неметалічні властивості посилюються. Завершується 3-й період інертним елементом Аргоном, який повторює головним чином властивості Неону. В атомі Аргону зовнішній енергетичний рівень (8 електронів) так само завершений. Тому при переході до наступного періоду властивості елементів різко змінюються, і 4-й період знову починається лужним металом Калієм, який повторює переважно властивості Натрію. Відповідно змінам електронної будови зовнішнього енергетичного рівня закономірно змінюється значення вищої валентності елементів, отже, й склад їх оксидів:
Завдання для контролю
1. Поясни причину періодичності в зміні властивостей хімічних елементів, розміщених у порядку зростання заряду ядра їх атомів.
2. Як пояснити з погляду теорії будови атома зміну властивостей елементів у періодах від металічних до неметалічних?
3. Як пояснити хімічну пасивність інертних газів?
4. Зростання атомних радіусів спостерігається в ряду елементів:
(а) Na, Mg, Al, Si; (в) О, S, Se, Те;
(б) C, N, О, R (г) l, Br, CI, F.
5. Максимальний радіус атома має елемент:
(a) Be; (б) Mg; (в) Са; (г) Ra.
6. Найінтенсивніше реагуватимуть між собою:
(а) Fe і Р; (в) Na і СІ2;
(б) Bi i Br2; (г) Аu і I2.
7. Серед наведених електронних конфігурацій атома Оксигену неправильною є: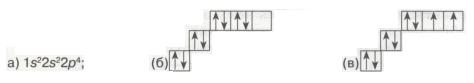
Електронні конфігурації атома.
ІV. Домашнє завдання.
2.2.Тема: ВЗАЄМОЗВ'ЯЗОК МІЖ РОЗМІЩЕННЯМ ЕЛЕМЕНТІВ У ПЕРІОДИЧНІЙ СИСТЕМІ ТА ВЛАСТИВОСТЯМИ ХІМІЧНИХ ЕЛЕМЕНТІВ, ПРОСТИХ РЕЧОВИН, СПОЛУК ЕЛЕМЕНТІВ З ГІДРОГЕНОМ ТА ОКСИГЕНОМ
Мета: розширити знання про взаємозв'язок між положенням хім. елементів у періодичній системі, будовою атома та їх фізичними і хімічними властивостями, показати залежність між положенням елемента у періодичній системі і складом, будовою, властивостями простих речовин, утворених цими сполуками.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва.
Тип уроку: вивчення нового матеріалу.
Методи навчання: пояснювально – ілюстративні – бесіда, розповідь; репродуктивні, частково пошукові.
Хід уроку
І. Організаційний етап.
ІІ. Перевірка домашнього завдання.
ІІІ. Основна частина
Основні закономірності періодичної системи:
1. У малих періодах із зростанням відносних атомних мас елементів спостерігається поступове послаблення металічних і наростання неметалічних властивостей.
2. У великих періодах спостерігається деяка періодичність у зміні властивостей всередині самих періодів. У парних рядах великих періодів металічні властивості елементів послаблюються повільно, в результаті всі елементи парних рядів — метали. У непарних рядах великих періодів властивості елементів змінюються так само, як і в елементів малих періодів: металічні властивості послаблюються, а неметалічні — посилюються.
3. Особливу подібність властивостей виявляють елементи, розміщені всередині великих періодів, наприкінці кожного парного ряду. Це так звані тріади: Ферум — Кобальт — Нікол, що утворюють родину Феруму, і дві інші: Рутеній — Родій — Паладій та Осмій — Іридій — Платина, що утворюють родину платинових металів (платиноїдів). Виділяють ще родину лантаноїдів (14 елементів шостого періоду) і родину актиноїдів (14 елементів сьомого періоду). Елементи кожної з цих родин за властивостями дуже подібні між собою.

Родина платинових металів
4. У групах у міру зростання відносних атомних мас елементів їх металічні властивості посилюються, а неметалічні — послаблюються (в елементів побічних підгруп бувають винятки).
5. У періодичній системі посилення металічних властивостей елементів у групах зверху вниз і послаблення їх у періодах зліва направо зумовлюють появу діагональної подібності. Так, Берилій більше подібний до Алюмінію, ніж до Магнію, а Бор — до Силіцію, ніж до Алюмінію (див. періодичну систему).
6. У періодах валентність елементів зростає: у малих періодах — від 1 до 8, у великих періодах — двічі, що й дало Д. І. Менделєєву підставу розмістити елементи великих періодів у два ряди.
7. У групах валентність елементів, як правило, відповідає номеру групи. Деякі елементи побічних підгруп можуть виявляти й іншу валентність. Так, Купрум — елемент І групи побічної підгрупи — утворює оксиди Сu2O і CuO та гідроксиди CuOH та Сu(ОН)2, де валентність Купруму дорівнює 1 і 2.
8. Елементи перших трьох груп — метали, вони летких сполук з Гідрогеном не утворюють. Це характерно для елементів головних підгруп IV—VII груп. При цьому валентність елемента дорівнює різниці між числом 8 і номером групи, в якій розмішується елемент.
IV. Підведення підсумків уроку.
V. Домашнє завдання:
2.3.Тема: ХАРАКТЕРИСТИКА ХІМІЧНИХ ЕЛЕМЕНТІВ ЗА ПОЛОЖЕННЯМ У ПЕРІОДИЧНІЙ СИСТЕМІ ЕЛЕМЕНТІВ І БУДОВОЮ АТОМА
Мета: закріпити знання учнів про будову атома, формувати вміння і навички характеризування хімічного елемента за положенням у періодичній системі і будовою атома.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, Будова електронних оболонок атомів хімічних елементів.
Тип уроку: узагальнення знань.
Методи навчання: пояснювально – ілюстративні – бесіда, розповідь; практичні – розв’язування вправ, репродуктивні, частково пошукові.
Хід уроку
І. Організаційний етап.
ІІ. Перевірка домашнього завдання.
ІІІ. Узагальнення та систематизація знань.
План характеристики хімічного елемента
- Символ хімічного елемента.
- Відносна атомна маса.
- Місце елемента у періодичній системі ( номер періоду, номер групи, головна чи побічна підгрупа)
- Склад атома, тобто кількість протонів, електронів, нейтронів.
- Електронна будова атома, тобто розміщення електронів на енергетичних рівнях та підрівнях.
- Тип елемента ( s,p,d,f ), його хімічний характер (метал, неметал).
- Максимальна і мінімальна валентність ( максимальна – номер групи, мінімальна – кількість не спарених електронів на зовнішньому енергетичному рівні).
- Тип простої речовини утвореної елементом (метал, неметал).
- Характер оксидів та гідроксидів.
- Сполуки з Гідрогеном.
Написання характеристик елементів S, P, O, Na, Si, Ca.
Приклад характеристики Оксигену.
- Символ – О.
- Ar(О)=16
- Розташований у 2періоді, VI група, головна підгрупа.
- 8 протонів, 8 електронів, 8 нейтронів.
-
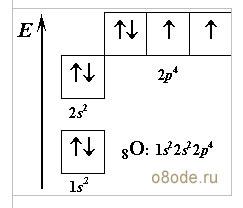
- Р-елемент, неметал.
- Валентність стала II.
- Утворює дві прості речовини O2 та O3, неметали.
- Входить до складу всіх оксидів.
- Сполука з Гідрогеном H2O.
IV. Підведення підсумків уроку.
2.4.Тема: ХАРАКТЕРИСТИКА ХІМІЧНИХ ЕЛЕМЕНТІВ ЗА ПОЛОЖЕННЯМ У ПЕРІОДИЧНІЙ СИСТЕМІ ЕЛЕМЕНТІВ І БУДОВОЮ АТОМА
Мета: закріпити знання учнів про будову атома, формувати вміння і навички характеризування хімічного елемента за положенням у періодичній системі і будовою атома.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, Будова електронних оболонок атомів хімічних елементів.
Тип уроку: узагальнення знань.
Методи навчання: пояснювально – ілюстративні – бесіда, розповідь; практичні – розв’язування вправ, репродуктивні, частково пошукові.
Хід уроку
І. Організаційний етап.
ІІ. Перевірка домашнього завдання.
ІІІ. Узагальнення та систематизація знань.
Усі елементи поділяються на метали і неметали.
Метали містяться в періодичній системі на початку кожного періоду та всередині великих періодів.
На останньому енергетичному рівні атомів цих елементів як правило від 1 до 3 електронів.
Елементи неметали знаходяться в кінці періоду, на останньому енергетичному рівні від 4 до 8 електронів.
Металічні елементи утворюють прості речовини – метали, неметалічні утворюють – неметали.
Хімічний характер елемента визначається передусім за хімічними властивостями його простої речовини.
Активність металів у періоді зменшується зліва на право. Про це можна судити за інтенсивністю виділення водню при взаємодії з кислотами:
![]()
![]()
Інтенсивніше виділяється водень при взаємодії Mg з кислотою, отже він більш активний ніж Al.
Про активність металу можна також судити по взаємодії його з водою.
Якщо метал активний, то він взаємодіє з водою за звичайних умов, менш активний метал – при нагріванні, малоактивний – не взаємодіє.
![]()
![]()
![]()
Металічний характер елементів і хімічна активність посилюється в періодах справа на ліво, а в головних підгрупах згори до низу.
Хімічна активність неметалів посилюється у періодах зліва на право, у головних підгрупах знизу до гори.
IV. Підведення підсумків уроку.
V. Домашнє завдання:
2.5.Тема: ЗНАЧЕННЯ ПЕРІОДИЧНОГО ЗАКОНУ. ЖИТТЯ І ДІЯЛЬНІСТЬ Д.І. МЕНДЕЛЄЄВА
Мета: розкрити роль періодичного закону як фундаментального закону природи, доказу єдності матеріального світу, показати його значення для розвитку природничих наук, у тому числі хімії, ознайомити із життям та діяльністю Д.І. Менделєєва.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, портрет Менделєєва.
Тип уроку: узагальнення знань.
Методи навчання: ілюстративна бесіда, розповідь.
Хід уроку
І. Організаційний етап.
ІІ. Перевірка домашнього завдання.
ІІІ. Основна частина.
Періодичний закон Д. І. Менделєєва — один із найфундаментальніших і найзагальніших законів природи, якому підпорядковані всі хімічні елементи Всесвіту. Адже з хімічних елементів складається вся жива і нежива природа. Отже, періодичний закон — це не тільки основний закон хімії, а й основний закон природи. Його відкриття справило величезний вплив на розвиток хімії та фізики і не втратило свого значення й досі.
Періодичний закон хімічних елементів — один з основних законів природи. Після його створення природознавство пережило наукову революцію, було розроблено нові теорії (будови речовини, відносності, квантової механіки), знайдено нові елементи, але ці відкриття не тільки не зруйнували періодичний закон і періодичну систему, а й розвинули їх, надали їм нового змісту, затвердили їх фундаментальність
Наукове значення. Відомо, що до Д. І. Менделєєва вчення про хімічні елементи являло собою сукупність розрізнених, мало зв'язаних між собою знань. Завдання щодо об'єднання цих знань у струнку цілісну систему блискуче виконав Д. І. Менделєєв, відкривши періодичний закон, який, за визначенням академіка О. М. Баха, послужив і продовжує слугувати провідною зіркою для тисячі нових досліджень і творчих пошуків у найрізноманітніших галузях природознавства. Велич наукового подвигу Д. І. Менделєєва полягає в тім, що він розкрив внутрішній об'єктивний зв'язок між хімічними елементами, закон їх розвитку.
Періодичний закон озброює дослідників надійним засобом для пояснення явищ, у яких беруть участь хімічні елементи, і для передбачення нових фактів. А це є найсуттєвішою ознакою будь-якої наукової теорії.
Передбачувальна сила періодичного закону повною мірою виявилася ще за життя Д. І. Менделєєва. Він указував на можливість існування багатьох невідомих елементів, відкриття яких (особливо Галію, Скандію, Германію) продемонструвало велике прогностичне значення періодичного закону і періодичної системи елементів для подальших досліджень.
На підставі періодичного закону Д. І. Менделєєв виправив відносні атомні маси 9-ти елементів, що були визначені неточно, і передбачив існування 10-ти елементів. Ці прогнози повністю справдилися.
Д. І. Менделєєв усвідомлював об'єктивність відкритого закону і вірив у його майбутнє. Він писав, що «... періодичному законові майбутнє не загрожує руйнуванням, а тільки надбудова і розвиток передбачаються». Так, Д. І. Менделєєв не вважав періодичну систему завершеною 92-м елементом (Ураном). Він передбачав можливість існування зауранових елементів. Усі вони тепер добуті штучно в результаті ядерних перетворень. Сьогодні відомо вже 112 хімічних елементів.
Велику роль відіграв періодичний закон у розвитку теорії будови атома. Вказавши на глибокий внутрішній зв'язок між елементами, він дав змогу зробити висновок, що всі атоми побудовані принципово однаково. Тому створення моделей атомів стало можливим лише після відкриття періодичного закону і створення періодичної системи елементів. У свою чергу, знання будови атома дало змогу глибше зрозуміти суть періодичного закону і періодичної системи елементів, пояснити причину періодичності у зміні властивостей хімічних елементів.
Світоглядне значення. Крім наукового, періодичний закон і періодична система елементів мають суттєве світоглядне значення. Вони показують, що всі елементи як подібні, так і відмінні за властивостями, містяться в єдиній системі, де їх властивості змінюються закономірно, шляхом переходу кількісних змін (заряд ядра) у якісні (властивості елементів). Властивості будь-якого елемента в періодичній системі виявляються у зв'язку з іншими елементами. Отже, періодична система елементів переконливо доводить, що природа не є скупченням речовин, ізольованих одна від одної і не зв'язаних між собою. Вона ясно показує, що існує спорідненість між усіма хімічними елементами, що розвиток має місце не лише у світі тварин і рослин, айв неорганічній природі.
Періодичний закон — провідна зірка для нових відкриттів і в хімії, і в фізиці, для пошуку і добування нових хімічних елементів, для створення речовин і матеріалів із наперед заданими властивостями. Він є тією науковою основою, яка зумовлює подальший розвиток сучасної хімії, теорії будови атома, ядерної фізики та багатьох інших наук. Ось чому добутий групою американських учених під керівництвом Глена Сіборга у 1955 р. хімічний елемент № 101 був названий ними Менделевієм на честь великого вченого.
ЖИТТЯ Й ДІЯЛЬНІСТЬ Д. І. МЕНДЕЛЄЄВА
Дмитро Іванович Менделєєв народився у 1834 р. в Тобольську в родині директора гімназії. Ще гімназистом він виявив великий інтерес до природничих наук, а після закінчення гімназії вступив до природничо-математичного факультету Петербурзького педагогічного інституту. Закінчив інститут із золотою медаллю і був направлений учителем природознавства у Сімферополь.
У цей час йшла Кримська війна (1853—1856), і гімназія не працювала. Д. І. Менделєєв влаштувався в архіві, а згодом переїхав до Одеси і домігся посади викладача Першої одеської гімназії при Ришельєвському ліцеї. Тут він розробив гідратну теорію розчинів, потім блискуче захистив магістерську дисертацію «Про питомі об'єми». Незабаром 23-річний Менделєєв став доцентом і здобув право читати лекції у Петербурзькому університеті. Молодий учений продовжував наукові дослідження стану і властивостей речовин. Він відбув дворічне наукове відрядження до Гейдельберзького університету (Німеччина), де досліджував властивості газів, уперше визначив критичні температури багатьох із них і довів, що за певної температури всі гази можна перетворити на рідини.
У Німеччині Д. І. Менделєєв зблизився з багатьма видатними вченими. Серед них були М. М. Бекетов, О. П. Бородін, І. М. Сеченов та інші. У 1860 р. він узяв участь у Першому Міжнародному конгресі хіміків у Карлсруе. Повернувшись до Петербурга, Менделєєв продовжував наукову і педагогічну роботу в університеті. Після захисту в 1865 р. докторської дисертації «Про сполучення спирту з водою і розуміння розчинів як асоціацій» його було обрано професором Петербурзького технологічного інституту, а потім — університету, в якому він керував кафедрою неорганічної хімії протягом 23-х років. Тут він з великою цікавістю працював над фундаментальним підручником «Основи хімії». Пристрасне бажання об'єднати розрізнені хімічні знання у певну систему породило у Менделєєва ідеїо пошуку спорідненості всіх хімічних елементів. Ця теоретична й експериментальна робота зумовила видатне відкриття всесвітнього значення — відкриття періодичного закону в 1869 p., коли Менделєєву було 35 років. Одночасно Менделєєв проводив велику громадську роботу. За його ініціативи у 1868 р. було створено Російське фізико-хімічне товариство, де він уперше доповів про відкриття періодичного закону. Теорія і практика завжди нерозривно поєднувались у діяльності Менделєєва. Навіть перелік питань, які вирішував учений, показує широчінь і важливість його праці. Менделєєв багато зробив у галузі точних вимірювань, заклав основи теорії розчинів, запропонував промисловий спосіб фракційного розділення нафти, винайшов новий вид бездимного пороху, пропагував використання мінеральних добрив, зрошування посушливих земель. Він є автором фундаментальних досліджень не тільки в хімії, а й у галузях хімічної технології, фізики, метеорології, повітроплавання, метрології, сільського господарства, економіки, народної освіти тощо. Менделєєв турбувався про розумне використання корисних копалин, про економічно доцільне розміщення заводів на території держави. Д. І. Менделєєв був палким патріотом і сміливим захисником прогресивних ідей, що викликало невдоволення серед реакційних кіл Петербурзької академії наук. І хоча Д. І. Менделєєв був обраний почесним членом усіх академій світу, у себе на батьківщині його кандидатура до складу академії була забалотована, незважаючи на величезні заслуги перед наукою.
У 1890 р. під час студентських заворушень Д. І. Менделєєв підтримував студентів, виступив на їх захист, за що дістав грубу одповідь від царського міністра освіти і змушений був залишити університет. Проте його наукова й практична діяльність на цьому не припинилась. Він став організатором і першим директором Головної палати мір і ваги, брав участь у складанні митних тарифів, розробляв питання господарського розвитку країни.
Багатогранна діяльність Д. І. Менделєєва була тісно пов'язана з розвитком науки, освіти та економіки України. Відомі його широкі зв'язки з багатьма передовими українськими хіміками та іншими вченими, особливо Київського і Харківського університетів. Ще у 1871 р. Д. І. Менделєєв брав активну участь у 3-му з'їзді природознавців, що відбувся у Києві. Д. І. Менделєєв приділяв велику увагу організації вищої освіти, зокрема у 1898 р. брав активну участь у створенні Київського політехнічного інституту (тепер — Національний технічний університет «КПІ»), на території якого перед входом до хімічного корпусу йому встановлено пам'ятник. У 1903 р. він був головою екзаменаційної комісії першого випуску інженерів та агрономів цього навчального закладу. Д. І. Менделєєв плідно працював над розвитком вугільної промисловості в Україні. Після перебування на Донбасі, де він вивчав питання видобутку й транспортування кам'яного вугілля, Д. І. Менделєєв висунув нову для того часу ідею підземної газифікації вугілля, яку вперше було втілено в життя лише в 1937 р. у м. Горлівці (Донбас).
1907 р. Д. І. Менделєєв помер. Тисячні юрби народу проводжали його в останню путь. Попереду траурної процесії несли періодичну систему хімічних елементів. В особі Менделєєва світ втратив блискучого різнобічного вченого, ідеї якого продовжують житд. їх розвивають учені нашої Батьківщини і закордонних країн.
IV. Домашнє завдання:
Висновки
Матеріал викладений доступною мовою, містить велику кількість схем і малюнків, що можуть бути роздруковані чи безпосередньо демонструватись на інтерактивній дошці.
Завдання для перевірки можливо коригувати і доповнювати. Такий підхід дозволяє лабільно готуватись до уроків у різних класах.
Обсяг теоретичної інформації достатній для повноцінного розуміння і пояснення теми, спрощує пошук інформації.
Список використаних джерел
- Ахметов Н.С. Неорганическая химия. Москва: высшая школа, 1975.672ст.
- Попель П.П., Крикля Л.С. Хімія: підручник 8 клас. Київ: Академія, 2016. 240с.
- Хаускрофт К., Констебл Е. Современный курс общей химии В 2-х т. Пер. с англ. Москва: Мир, 2002. 540ст.
- Хомченко Г.П. Посібник з хімії. К.: А.С.К., 2006. 480с.
- Програма по хімії. https://cutt.ly/WdNjcoW.
![]()

про публікацію авторської розробки
Додати розробку