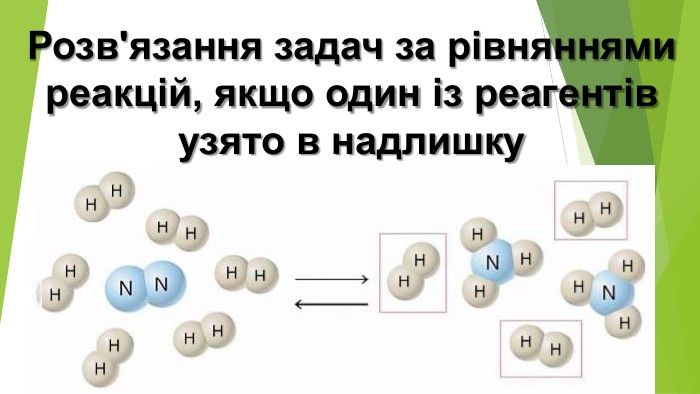
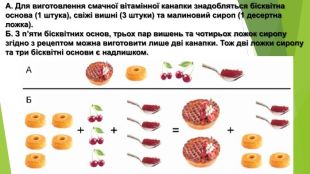
Розв'язування задач за рівняннями реакцій, якщо один із реагентів узято в надлишку
Про матеріал
Розробка містить приклади розв'язування задач за рівняннями реакцій, якщо один із реагентів узято у надлишку Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку