Семестрова контрольна робота за І семестр 9 клас хімія
Даний матеріал містить різнорівневі та різнотипові завдання з тем курсу хімії 9 класу. В розробці представленні різні форми роботи: тестові завдання, вправи на відповідність, теоретичні та розрахункові завдання.
Семестрова контрольна робота
Варіант 1
1. Установіть відповідність.

2. Виберіть формули електролітів:
а) CuS04; б) НС1, в)LiОН, г)С
3. На розчинність речовин у воді впливає:
а) забарвлення розчину;
б)природа речовини;
в) температура;
г) агрегатний стан речовини
4. Речовина, що приєднує електрони в окисно-відновній реакції, називається:
а) відновником;
б) ізотопом;
в) окисником;
г) приймачем.
5. Установіть відповідність.
A. СаСІ2 1. Н+, N03
Б.NaOH 2. Са2+, 2С1"
B. HN03 3. Na+, ОН"
6. Сильні електроліти в розчині:
а) дисоціюють поетапно;
б) дисоціюють повністю;
в) не дисоціюють.
7. Напишіть у йонній формі рівняння взаємодії:
цинк сульфату й натрій гідроксиду;
8.Яку масу води потрібно долити до 150 г розчину з масовою часткою розчиненої речовини 25 %, щоб отримати 10 % розчин?
9. Виставте ступені окиснення та розставте коефіцієнти в рівняннях реакцій методом електронного балансу, вкажіть окисники й відновники, а також процес окиснення та процес відновлення.
1)Со + HNO3→ Co(NO3)2 + N2+ H2O
10. Обчисліть об'єм газу (н. у.), що виділиться внаслідок дії надлишку хлоридної кислоти на розчин натрій карбонату масою 400 г з масовою часткою 37,4%.
Семестрова контрольна робота
Варіанти 2.
1.Установітьвідповідність
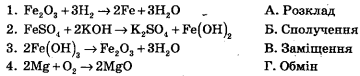
2. Виберіть формули електолітів:
a)NaOH; б) MgCl2; в)С02; г)H2S04.
3. За здатністю проводити електричний струм у розчинах речовини поділяються на типи:
а) насичені й ненасичені;
б) електроліти й неелектроліти;
в) водні й неводні.
4. Речовина, що віддає електрони в окисно-відновній реакції, називається:
а) відновником;
б) ізотопом;
в) окисником;
г) приймачем
5. Установіть відповідність.
A. Ва(ОН)2 1. Ва2+,20Н"
Б. Na2S04 2. 2Н , S04
B. H2S04 3. 2Na+, S04
6. Процес електролітичної дисоціації:
а) оборотний; б) необоротний; в) повільний.
7. Напишіть у йонній формі рівняння взаємодії:
натрій карбонату та хлоридної кислоти;
8.Яку масу води потрібно долити до 250 г розчину з масовою часткою розчиненої речовини 30 %, щоб отримати 12 % розчин?
9. Виставте ступені окиснення та розставте коефіцієнти в рівняннях реакцій методом електронного балансу, вкажіть окисники й відновники, а також процес окиснення та процес відновлення.
1)Сu + H2SO4→ CuSO4 + SO2+ H2O
10. Обчисліть масу осаду, одержаного в результаті взаємодії розчину купрум(ІІ) хлориду масою 120 г з масовою часткою солі 37,5 % і надлишку розчину натрій гідроксиду.


про публікацію авторської розробки
Додати розробку
