Складання рівнянь окисно-відновних реакцій
Про матеріал
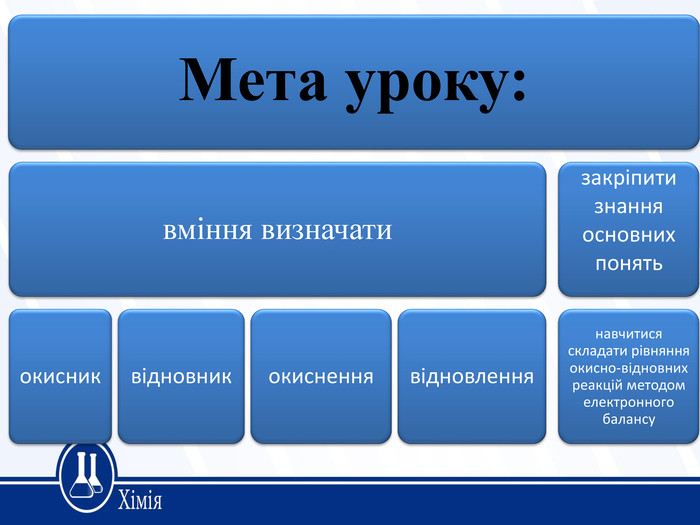
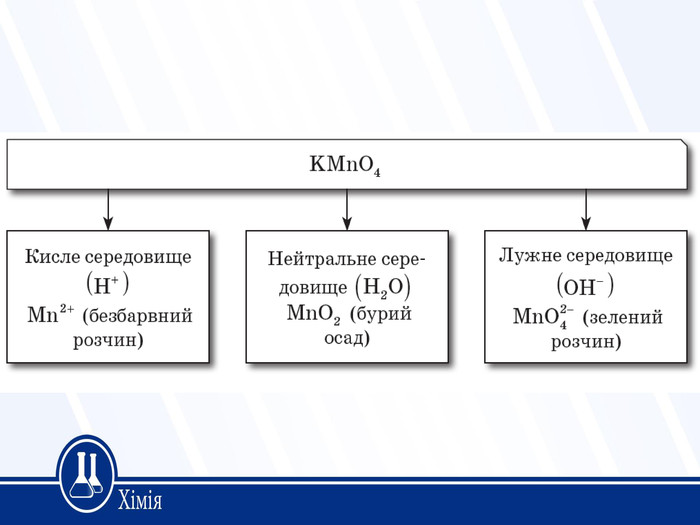
Поглибити знання учнів про окисно-відновні реакції, закріпити знання основних понять та вміння визначати й застосовувати такі поняття: «ступінь окиснення», «окисник», «відновник», «окиснення», «відновлення»; навчити учнів складати рівняння окисно-відновних реакцій методом електронного балансу. Перегляд файлу
Зміст слайдів
ppt
До підручника
Хімія 9 клас (Григорович О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку