Складання рівнянь окисно-відновних реакцій
Хімія,9 клас
Урок № 20
Складання рівнянь найпростіших окисно-відновних реакцій, добір коефіцієнтів
Мета: дати поняття про метод електронного балансу; сформувати вміння застосовувати метод електронного балансу при добиранні коефіцієнтів реакції; навчити використовувати поняття «ступінь окиснення» для складання простих окисно-відновних реакцій методом електронного балансу; закріпити поняття ступеня окислення, окисника й відновника, процесу окиснення й відновлення.
Очікувані результати: учні мають уміти складати рівняння окисно-відновних реакцій методом електронного балансу; учні мають уміти складати електронні рівняння процесів окиснення й відновлення; учні мають визначати процеси окиснення й відновлення, окисник і відновник за рівняннями хімічних реакцій.
Базові поняття та терміни: ступінь окиснення, окисник, відновник, процеси окиснення і відновлення, окисно-відновні реакції, метод електронного балансу.
Тип уроку: комбінований.
I. Організаційний момент
Перевірка домашнього завдання
1.1. Перевірка наявності в учнів виконаних письмових робіт. Обговорення запитань, що виявилися найбільш складними.
1.2. Самостійна робота. (Роздавальний матеріал.)
Варіант 1
1. Визначте ступені окиснення елементів у молекулах речовин:
CuSO4, HNO3, Fe2O3, H3PO4.
2. Що таке окиснення? Що таке відновлення?
3. Які реакції називають окисно-відновними?
Варіант 2
1. Визначте ступені окиснення елементів у молекулах речовин:
ZnSO4, Al2O3, MgCl2, NaNO3.
2. Які процеси відбуваються під час перебігу окисно-відновних реакцій?
3. Що таке окисник і відновник?
II. Актуалізація опорних знань та мотивація навчальної діяльності
2.1. Формулювання проблеми.
Завдання:
Перетворіть схему реакції на рівняння.
а) CO2 + Н2О Н2CO3;
б) KMnO4 + HCl Cl2 + MnCl2 + KCl + H2O.
Учні роблять висновок, що іноді складно добрати коефіцієнти традиційними методами.
2.2. Показ практичного значення вивчення нового матеріалу.
Слово вчителя
Існує ефективний метод добору коефіцієнтів у схемах окисно-відновних реакцій — метод електронного балансу. Він ґрунтується на порівнянні ступенів окиснення атомів у реагентах і продуктах реакції.
2.3. Повідомлення теми уроку.
2.4. Формулювання разом з учнями мети уроку.
III. Етап засвоєння нових знань
План пояснення нового матеріалу
1. Метод електронного балансу. (Пояснення вчителя, вивчення алгоритму складання рівнянь окисно-відновних реакцій методом електронного балансу.)
2. Використання методу електронного балансу. (Фронтальна робота біля дошки.)
Звернути увагу учнів
Окиснення й відновлення — два протилежні боки одного окисно-відновного процесу. Число електронів, що приймає окисник, дорівнює числу електронів, що віддає відновник.
Речовини, що є окисниками або відновниками в багатьох реакціях, називаються типовими.
Типові окисники: F2, Cl2, Br2, I2, O2, H2SO4, HNO3, MnO2, KMnO4, K2CrO4.
Типові відновники: Н2, C, метали, Н2S, CO, SO2, HI, FeSO4.
- Метод електронного балансу
Алгоритм складання рівнянь окисно-відновних реакцій методом електронного балансу
1. Записати схему реакції.
2. Визначити ступені окиснення елементів до та після реакції.
3. Підкреслити елементи, що змінили свої ступені окиснення.
4. Під схемою реакції виписати елементи, що змінили свої ступені окиснення.
5. Визначити число електронів, які ці елементи віддавали чи приймали.
6. Указати окисник і відновник.
7. Провести вертикальну риску та підвести електронний баланс відданих і прийнятих електронів.
8. Отримані числа є коефіцієнтами в рівнянні реакції перед формулами речовин, що містять елементи, які змінили свої ступені окиснення.
9. Усі інші коефіцієнти визначити простим добором.
10. Вказати процеси окиснення й відновлення.
3.2 Використання методу електронного балансу
Приклад 1
Доберіть коефіцієнти в схемі реакції методом електронного балансу, визначте окисник і відновник, укажіть процеси окиснення й відновлення:
Fe2O3 + CO → Fe + CO2.
Розв’язання:
Скористаємося алгоритмом добору коефіцієнтів методом електронного балансу.
1. Визначимо ступені окиснення елементів:
![]() .
.
2. Підкреслимо символи елементів, ступені окиснення яких змінюються:
![]() .
.
3. Випишемо елементи, що змінили ступені окиснення:
![]() ,
,
![]() .
.
4. Складемо електронні рівняння, визначаючи число відданих і прийнятих електронів:
![]() ,
,
![]() .
.
5. Число відданих і прийнятих електронів має бути однаковим, оскільки вихідні речовини та продукти реакції є речовинами незарядженими. Зрівнюємо число відданих і прийнятих електронів, добравши найменше спільне кратне (НСК) та додаткові множники:
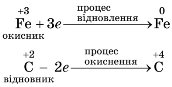
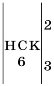
6. Отримані множники є коефіцієнтами. Записуємо коефіцієнти у схему реакції:
Fе2О3 + 3СО = 2Fе + 3СО2.
Зверніть увагу учнів
Речовини, що є окисниками або відновниками в багатьох реакціях, називають типовими.
|
Типові окисники: F2, Cl2, Br2, I2, O2, H2SO4, HNO3, MnO2, KMnO4, K2CrO4 Типові відновники: Н2, C, метали, Н2S, CO, SO2, HI, FeSO4 |
Приклад 2
Складіть рівняння реакції між кальцієм і киснем та доберіть коефіцієнти методом електронного балансу.
Розв’язання:
1. Запишемо схему реакції в молекулярному вигляді:
Ca + O2 → CaO.
2. Над формулами запишемо значення ступенів окиснення атомів елементів:
Ca0 + O20→ Ca–2O–2.
3. Під рівнянням запишемо елементи, що змінили свій ступінь окиснення:
Ca0 → Ca+2;
O20→ Ca–2.
4. Сума зарядів ліворуч і праворуч у рівнянні електронного балансу має бути однаковою:
Ca0 – 2ē → Ca+2;
O20 + 4 ē → 2O–2.
5. Число відданих і приєднаних електронів має бути однаковим, отже, рівняння
Ca0 – 2ē → Ca+2слід помножити на 2. Цей множник буде коефіцієнтом у молекулярному рівнянні реакції перед речовинами, що містять атоми Кальцію:
2Ca + O2 = 2CaO

Приклад 3
Складіть рівняння реакції між алюмінієм та розчином хлоридної кислоти. Доберіть коефіцієнти методом електронного балансу.
Розв’язання:
1. Напишемо схему реакції.
Al + HCl → AlCl3 + H2↑.
2. Визначимо ступені окиснення атомів, що його змінили, і позначимо над хімічним символом:
0 +1 +3 0
Al + HCl = AlCl3 + H2↑.
3. Складемо електронні рівняння, зазначивши елемент, що окиснюється, та елемент, що відновлюється, а також число електронів, утрачених відновником та приєднаних окисником.
0 +3
![]()
![]() Al – 3e → Al 2
Al – 3e → Al 2
+1 0 6
2H + 2e → H2 3
4. За вертикальною рискою поставимо число, що є найменшим спільним кратним до чисел 3 і 2. НСК=6.
5. За другою вертикальною рискою поставимо числа, що отримуємо від ділення найменшого спільного кратного на 3 (число електронів, відданих атомом Алюмінію) і число 2 (число електронів, приєднаних двома атомами Гідрогену). Це числа 2 і 3.
6. Зазначені числа є основними коефіцієнтами, що необхідно поставити перед алюмінієм і воднем. Інші коефіцієнти доберемо:
2Al + 6HCl = 2AlCl3 + 3H2↑.
7. Перевірку робимо за загальною сумою атомів до та після реакції. Якщо у складі сполук міститься Оксиген, то за загальною сумою атомів Оксигену.
IV. Узагальнення й систематизація знань
4.1. Індивідуальна робота учнів за картками.
Кожний учень отримує завдання на картці і складає по два рівняння окисно-відновних реакцій.
Після закінчення учні роблять взаємоперевірку. Якщо виявлено помилки, виправляють їх.
4.2. Розв’язання проблеми.
На початку уроку в нас виникла проблема при доборі коефіцієнтів у рівнянні реакції. Використовуючи здобуті на уроці знання, давайте вирішимо цю проблему.
а) не окисно-відновна;
б) 2KMnO4 + 16HCl 5Cl2 + 2MnCl2 + 2KCl + 8H2O.
V. Домашнє завдання, інструктаж щодо його виконання
Індивідуальне завдання
Підготуйте повідомлення:
1. Історична довідка про використання окисно-відновних реакцій.
2. Значення окисно-відновних реакцій.
VI. Підбиття підсумків уроку
Учні визначають результати уроку, порівнюють їх з очікуваними та оцінюють власну діяльність з отримання нових знань
Самостійна робота
Варіант 1
1. Визначте ступені окиснення елементів у молекулах речовин:
CuSO4, HNO3, Fe2O3, H3PO4.
2. Що таке окиснення? Що таке відновлення?
3. Які реакції називають окисно-відновними?
Варіант 2
1. Визначте ступені окиснення елементів у молекулах речовин:
ZnSO4, AI2O3, MgCI2, NaNO3.
2. Які процеси відбуваються під час перебігу окисно-відновних реакцій?
3. Що таке окисник і відновник?


про публікацію авторської розробки
Додати розробку
