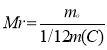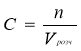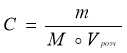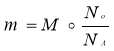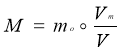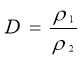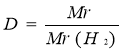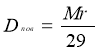Матеріали до уроків "Розрахункові задачі"
Міністерство освіти і науки України
ДВНЗ «Кам’янець-Подільський коледж будівництва,архітектури та дизайну»
РОЗРАХУНКОВІ ЗАДАЧІ В НЕОРГАНІЧНІЙ ХІМІЇ
(для студентів та викладачів ВНЗ І-ІІ рівня акредитації)

М. Кам’янець-Подільський
2018 рік
Обговорено та рекомендовано на засіданні циклової комісії
технологічних дисциплін
Протокол № 1 від 31 серпня 2018 року
Голова ЦК Лонська Ю.А.
Рецензенти: Платонова О.П., викладач хімії
Автор-упорядник:
Владика Ольга Іванівна, викладач хімії Кам’янець-Подільського коледжу будівництва, архітектури і дизайну.
Розрахункові задачі в неорганічній хімії (для студентів та викладачів ВНЗ І-ІІ рівня акредитації).-Кам’янець-Подільський,2018.-10с.
Зміст анотації
Посібник містить алгоритми розв’язування основних типів розрахункових задач з хімії, що вивчаються студентами у ІІ семестрі. Крім того, у посібнику вміщено довідникові таблиці та матеріали. Призначений для студентів вищих навчальних закладів І-ІІ рівня акредитації та викладачів хімії.
В С Т У П
Інтеграція України в європейський та світовий освітній простір викликала необхідність переглянути деякі підходи до навчання. Згідно з Національною доктриною розвитку освіти у XXI столітті, «головна мета української системи освіти — створити умови для розвитку самореалізації кожної особистості України, формування покоління, здатного вчитися протягом життя, створювати і розвивати цінності громадянського суспільства».
Одним із пріоритетів державної політики в розвитку освіти є подолання прірви між освітою та життям, компетентнісне ставлення особистості до життя. Основними структурними компонентами навчальної діяльності студентів є:
• мотиваційний — ставлення до навчання;
• змістовий — відомі та нові знання, уміння,навички;
• процесуальний — способи виконання діяльності на різних рівнях складності.
Щоб мати можливість знайти своє місце в житті, студент повинен володіти певними якостями:
- гнучко адаптуватися в життєвих ситуаціях;
- самостійно і критично мислити;
- грамотно працювати з інформацією (вміти збирати потрібні факти, аналізувати їх, висувати гіпотези для розв'язання проблем, робити необхідні узагальнення, зіставлення з аналогічними або альтернативними варіантами розв'язання, встановлювати статистичні закономірності, робити аргументовані висновки, використовувати їх для розв'язання нових проблем);
- уміти самостійно працювати над розвитком особистого морального, інтелектуального, культурного рівня.
Однією з основних вимог сучасної освіти є формування гнучкого, нестандартного мислення, притаманного творчій особистості. Одним із засобів для досягнення цього є розрахункові задачі.
Розрахункові задачі посідають особливе місце у вивченні хімії. Систематичне їх розв'язування сприяє свідомому засвоєнню хімічних знань, формуванню логічного мислення, розвитку розумових здібностей, навчає практично використовувати набуті теоретичні знання. Хімічні задачі сприяють формуванню системи конкретних уявлень, що необхідно для осмисленого сприйняття теоретичного матеріалу. Задачі, що включають певні хімічні ситуації, стають стимулом до самостійної роботи учнів над навчальним матеріалом, а в процесі розв'язування задач виховується працелюбність, цілеспрямованість, почуття відповідальності, наполегливості у досягненні поставленої мети. Під час розв'язування задач реалізуються міжпредметні зв'язки з фізикою, математикою, біологією, екологією та іншими навчальними дисциплінами. Найтісніший зв'язок знань і дій є основою формування різних прийомів мислення.
При вивченні курсу неорганічної хімії у ІІ семестрі студенти коледжу повинні вміти розв’язувати такі типи комплексних хімічних задач:
- Обчислення за реагентами, один з яких узято в надлишку.
- Обчислення за хімічними рівняннями, якщо реагент містить певну частку домішок.
- Обчислення виходу продукту реакції від теоретично можливого.
1. Обчислення за реагентами, один з яких узято в надлишку.
Реагенти вступають у реакцію в чітко визначених масових співвідношеннях. Досить часто в практичній роботі зустрічаються ситуації, коли один з реагентів залишається в надлишку або, навпаки одного з реагентів не вистачає для одержання визначеної кількості продукту реакції. При розв’язуванні задач цього типу слід пам’ятати, що із двох вихідних речовин розрахунок проводиться лише за тією речовиною, яка знаходиться в нестачі. Тобто ця речовина під час реакції витрачається повністю. Визначити, яка з речовин перебуває в нестачі, можна склавши відношення маси або об’єму вихідної речовини, що дано за умовою задачі, до відповідної маси або об’єму, визначеного за рівнянням реакції.
Алгоритм обчислення за рівнянням хімічної реакції,
якщо одна з вихідних речовин узята в надлишку
|
Порядок дій |
Приклади виконаних дій
|
|
1) Прочитайте текст задачі |
Обчисліть масу осаду, який утвориться внаслідок взаємодії розчинів, які містять купрум (ІІ) сульфат масою 8г та натрій гідроксид масою 10г. |
|
2) Запишіть скорочено умову задачі |
Дано: m(CuSO4) = 8г m(NaOH) = 10г Знайти: m(Cu(OH)2) - ? |
|
3) Запишіть рівняння реакції |
CuSO4+2 NaOH = Cu(OH)2 + Na2SO4
|
|
4) Підкресліть формули речовин, про які йдеться в умові задачі |
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
|
|
5) Надпишіть над підкресленими формулами вихідні дані, під формулами – дані, що закономірно витікають з рівняння реакції |
8г 10г хг CuSO4 + 2 NaOH = Cu(OH)2↓+ Na2SO4 n=1моль n=2моль n=1моль M=160г/моль M=40г/моль M=98г/моль m = 160 г m = 80 г m = 98 г
|
|
6) Знайдіть, яка із двох даних речовин взята в нестачі |
В нестачі CuSO4, тому розрахунок проводимо саме за цією речовиною. |
|
7) Розрахунок здійснюємо за речовиною, яка повністю використовується, тобто за тією, яка в нестачі |
|
|
8) Запишіть відповідь |
Відповідь: m(Cu(OH)2) = 4,9 г
|
Приклади задач для самостійного розв’язку:
- Обчисліть об’єм водню, щоутвориться в результаті взаємодії цинку масою 13г із сульфатною кислотою масою 20г.
- До розчину, що містить 0,01 моль натрій сульфату, додали розчин, що містить 3,12г барій хлориду. Яка маса осаду утворилася?
- Яка масса солі утвориться внаслідок взаємодії 8г магній оксиду і 8г сульфур (VІ) оксиду.
- Який об’єм аміаку утвориться внаслідок взаємодії азоту обємом 30л і водню об’ємом 120л?
- У розчин, який містить сульфатну кислоту масою 11,76г, занурили шматочок алюмінію масою 3,24г. Скільки алюміній сульфату утворилося?
- Залізо масою 2,8г спалили в хлорі об’ємом 2,8л (н.у). Визначити масу добутого ферум (ІІІ) оксиду.
- Змішали 12г порошку сірки і 18 г алюмінієвих ошурок. Суміш нагріли. Яка речовина прореагує повністю? Визначити масу добутого алюміній сульфіду.
- Визначити масу осаду, добутого в результаті взаємодії 20г натрій гідроксиду і 32г купрум (ІІ) сульфату.
- Яку массу ферум (ІІІ) хлориду можна добути в результаті взаємодії заліза масою 11,2г з хлором об’ємом 11,2л (н.у.)?
- До розчину масою 125г з массовою часткою барій хлориду10% додали розчин сульфатної кислоти массою 196г з массовою часткою кислоти 10%. Визначте масу осаду, що утворився в результаті реакції.
- Суміш, що складається з амоній хлориду масою 4г і подрібненого натрій гідроксиду масою 4г, нагріли. Який об’єм аміаку (н.у.) утворився?
2. Обчислення за хімічними рівняннями, якщо реагент містить певну частку домішок.
У природі чистих речовин не буває. Кожна з природних речовин є сумішшю кількох різних речовин. Речовини, крім основної, які в даному випадку не є цінними та не використовуються на виробництві, називають домішками. Участь в хімічній реакції приймає лише чиста речовина, домішки участі в реакції не приймають, тому їх масу слід віднімати від загальної маси речовини.
Для технічних речовин (речовини з домішками) можна виразити масову частку домішок, або масову частку чистої речовини у частках від одиниці, або у відсотках.
![]() або
або ![]()
Алгоритм обчислення маси продукту реакції
за відомою масою вихідної речовини, яка містить домішки
|
Послідовність дій |
Приклади виконаних дій
|
|
1) Прочитайте текст задачі |
Яку масу кальцій оксиду можна отримати з вапняку масою 400 кг з масовою часткою домішок 0,2? |
|
2) Запишіть скорочено умову задачі |
Дано: m(вапняку) = 400 кг ω(домішок) = 0,2 Знайти: m(CaO) - ? |
|
3) Обчисліть масу речовини за формулами |
ω(чист.реч) = 1 - ω(домішок) ω(СаСО3) = 1 – 0,2 = 0,8 m(ч.реч)= ω(чист.реч) · m(вапняку) m(СаСО3) = 0,8 · 400 = 320 (кг) |
|
4) Складіть рівняння реакції |
СаСО3 → CaO + CO2
|
|
5) Підкресліть формули речовин, про які йдеться в умові задачі
|
СаСО3 → CaO + CO2
|
|
6) Надпишіть над підкресленими формулами вихідні дані задачі, під формулами – дані, які закономірні для рівняння реакції |
320 кг х кг СаСО3 → CaO + CO2 n = 1 моль n = 1 моль М = 100 кг/моль М = 56 кг/моль m = 100 кг m = 56 кг
|
|
7) Складіть пропорцію та обчисліть масу продукту реакції |
|
|
8) Запишіть відповідь |
Відповідь: m(CaO) = 179,2 кг |
Приклади задач для самостійного розв’язку:
- Який об’єм вуглекислого газу виділиться при термічному розкладанні вапняку масою 350 г, що містить 5% домішок?
- Визначити масу кальцій карбонату у 500 г вапняку, що розклали, якщо виділилось 2,24 л газу.
- Визначити масу домішок, що містилась у технічному кальцій карбіді масою 250 г СаС2, якщо при дії на нього водою виділилось 2,24 л газу ацетилену С2Н2 та утворився кальцій гідроксид.
- Яка маса купрум (ІІ) оксиду утвориться при спалюванні міді в кисні, що утвориться при термічному розкладі калій перманганату масою 3,8 г, що містить 2% домішок?
- Обчислити масу кальцій оксиду, який утвориться при термічному розкладанні 20 кг вапняку, що містить 10% некарбонатних домішок.
- Визначити масу домішок, що міститься в технічному алюмінії масою 65 г, якщо при розчиненні його у хлоридній кислоті виділиться 0,448 л газу.
- При дії розчину сульфатної кислоти на 1 кг технічного магній карбонату виділилось 224 л вуглекислого газу. Визначити масову частку домішок у зразку магній карбонату.
- Яка маса купрум (ІІ) оксиду прореагує з воднем, який утвориться в результаті взаємодії розчину сульфатної кислоти з 3,5 г технічного алюмінію, де масова частка домішок становить 10%?
- Внаслідок згоряння сірки масою 2 г одержати сульфур (ІV) оксид об’ємом 1,12 л. Обчислити масову частку домішок у спаленому зразку сірки.
- Яка маса технічного алюмінію, масова частка домішок в якому 15%, витратиться на добування алюміній сульфіду масою 30 г?
3. Обчислення виходу продукту реакції від теоретично можливого.
Практично при проведенні будь-якого хімічного процесу відбувається втрата деякої кількості реагуючих речовин. Тому для одержання бажаної маси (чи об’єму)продукту реакції необхідно враховувати виробничі втрати, тобто розраховувати практичний вихід реакції і, навпаки, за практичним виходом розраховувати маси (об’єми, кількість речовини) реагентів. Маси (об’єми) продуктів реакції, розраховані за рівнянням реакції, називаються теоретичним виходом. Теоретичний вихід приймають за 100%, тому що одержати продуктів реакції більше, ніж ця розрахункова величина неможливо. Маси (об’єми) продуктів реакції, обчислені з урахуванням втрат, називаються практичним виходом. Практичний вихід завжди менший за теоретичний. Вихід продукту розраховують за формулою:
![]() або
або ![]()
Алгоритм обчислення виходу продукту реакції
порівняно з теоретично можливим
|
Порядок дій
|
Приклади виконаних дій |
|
1) Прочитайте текст задачі |
Із негашеного вапна масою 112 г одержали гашене вапно масою 120 г. Обчисліть вихід продукту від теоретично можливого. |
|
2) Запишіть скорочено умову задачі |
Дано: m(СаО) = 112г mпрак(Са(ОН)2) = 120г Знайти: η - ? |
|
3) Запишіть рівняння реакції |
СаО + Н2О = Са(ОН)2 |
|
4) Підкресліть формули речовин, про які йдеться в умові задачі |
СаО + Н2О = Са(ОН)2 |
|
5) Укажіть над підкресленими формулами вихідні кількості речовин, під формулами – дані, закономірні для рівняння реакції. Увага! По рівнянню реакції знаходять масу теоретичну! |
112г х г СаО + Н2О = Са(ОН)2 n = 1 моль n = 1 моль М = 56 г/моль М = 74 г/моль m = 56 г m = 74 г |
|
6) Обчисліть теоретичну масу гашеного вапна |
|
|
7) Обчисліть вихід продукту від теоретично можливого за формулою:
η = |
η = |
|
8) Запишіть відповідь |
Відповідь: η(Са(ОН)2) = 81% |
Приклади задач для самостійного розв’язку:
- Аміак масою 34 кг пропустили через розчин сульфатної кислоти. Масова частка виходу амоній сульфату дорівнює 90%. Обчислити масу добутого амоній сульфату.
- При нагріванні калій нітрату масою 30,3г зібрали 3л кисню. Обчисліть об'ємну частку виходу.
- З азоту масою 56кг було синтезовано аміак масою 48 кг. Знайдіть масову частку виходу аміаку від теоретично можливого.
- У результаті розчинення у сульфатній кислоті цинку масою 1,3 г добули водень об’ємом 0,4л (н.у.). обчисліть вихід водню.
- Яку масу сульфур (УІ) оксиду можна добути із 32г сульфур (ІУ) оксиду, якщо вихід реакції становить 95%.
- Який об’єм аміаку можна синтезувати з азоту масою 112 кг, якщо об’ємна частка виходу аміаку становить90% від теоретичного.
- Визначити вихід ферум (ІІ) сульфіду, якщо із заліза масою 150г в реакції з сіркою добули ферум (ІІ) сульфід масою 120г.
- Яку масу сірки спалили, якщо добуто 762 кг сульфур (ІУ) оксиду, а масова частка виходу становить 80%?
- Який об’єм водню витратиться на добування аміаку масою 70г, що становить 78% від теоретичного?
- Унаслідок взаємодії натрій нітрату із сульфатною кислотою одержали 2,7 г нітратної кислоти, що становить 90% від теоретично можливого. Скільки натрій нітрату вступило в реакцію?
- Яку масу сірководню спалили, якщо об’єм добутого сірчистого газу 13,44л (н.у.). вихід газу становить 80%?
Задачі взято з посібників:
1. Ярошенко О. Г., Новицька В. І. Збірник задач і вправ з хімії— К., 1996.
2. Кузьменко М. В., Єрьомін В. В. 2400 задач,— Тернопіль, 2001.
3. Хомченко Г.П. Посібник з хімії для вступників. - Видавництво Київ "Н.С.К." 2000 р.
4. Туринська Н.М. Основи загальної хімії. - Київ: Ірпінь: ВТФ "Перун".
ДОДАТКИ
- Позначення та розмірність деяких фізичних величин
|
Позначення фізичної величини |
Фізична величина |
Розмірність |
|
Аr |
Відносна атомна маса |
а.о.м. |
|
Мr |
Відносна молекулярна маса |
а.о.м. |
|
W |
Масова частка |
% |
|
m |
Маса |
г, кг, т |
|
ν |
Кількість речовини |
моль |
|
V |
Об’єм |
мл, л, м3 |
|
Vm |
Молярний об’єм (число Авогадро) |
22,4 л/моль; м3/моль |
|
М |
Молярна маса |
г/моль, кг/моль |
|
N |
Число структурних частинок |
атоми, молекули, йони |
|
NА |
Стала Авогадро |
6,02·1023 моль-1 |
|
ρ |
Густина |
г/мл, г/см3, кг/м3 |
|
DН2 |
Відносна густина за воднем |
|
|
Dпов |
Відносна густина за повітрям |
|
|
С |
Молярна концентрація |
моль/л або М |
|
Р |
Тиск |
Па, кПа, атм |
|
Vх.р. |
Швидкість хімічної реакції |
|
|
T або t |
Температура |
°C або К |
|
∆Н |
Тепловий ефект реакції |
кДж/моль |
|
η або φ |
Вихід реакції |
% |
- Основні формули, що використовуються при розв’язуванні задач
|
Фізична величина
|
Формули |
|
Кількість речовини |
|
|
Об’єм |
|
|
Число структурних частинок |
|
|
Молярний об’єм |
|
|
Відносна молекулярна маса |
|
|
Молярна концентрація |
|
|
Маса |
|
|
Молярна маса |
|
|
Відносна густина |
|
|
Масова частка елемента |
|
|
Масова частка розчиненої речовини |
|
- Ряд активності металів
Li K Ba Sr Ca Na Mg Be Al Mn Cr Zn Fe Cd Ni Sn Pb (H2) Bi Cu Ag Hg Pt Au
![]() хімічна активність металів зростає
хімічна активність металів зростає


про публікацію авторської розробки
Додати розробку

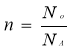
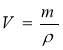
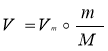
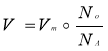
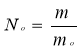
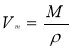 ;
;