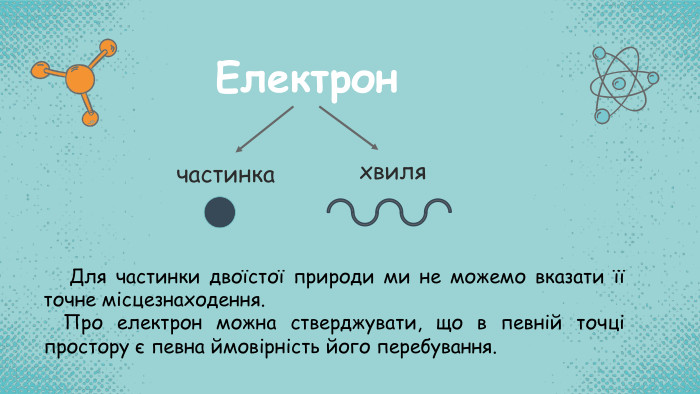
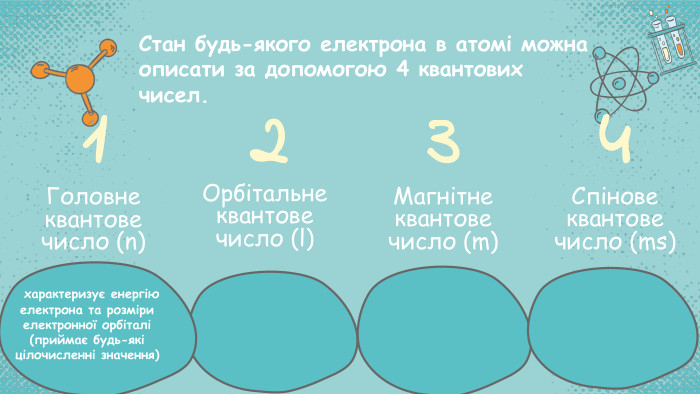
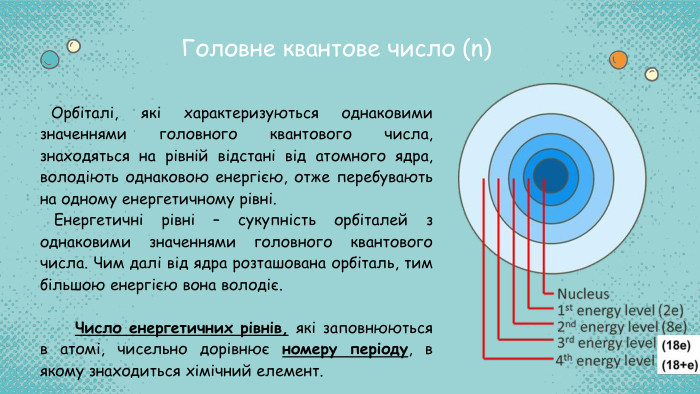
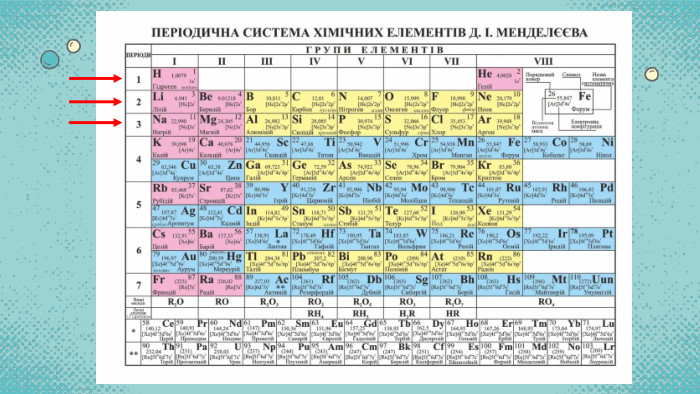
Стан електронів у атомі
Про матеріал
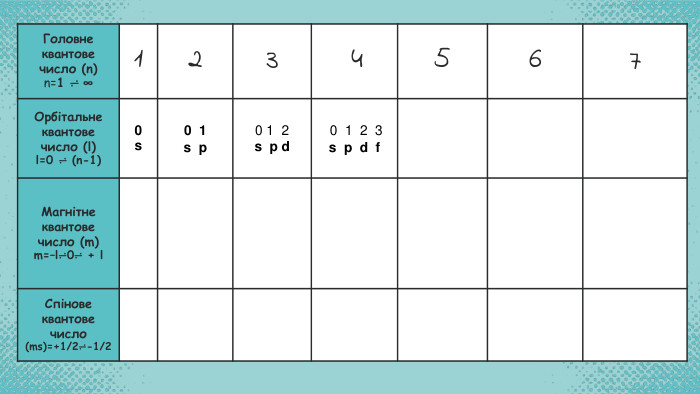
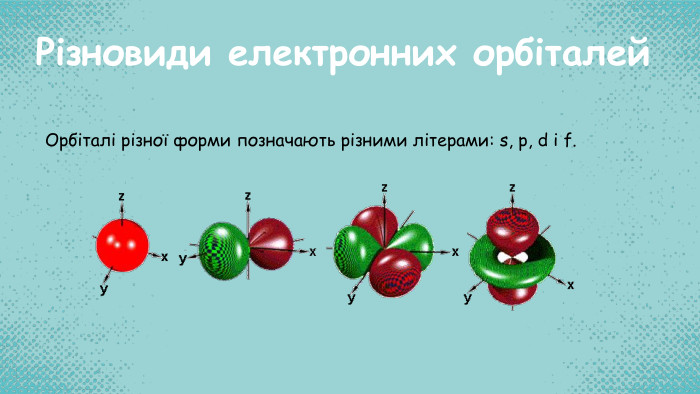
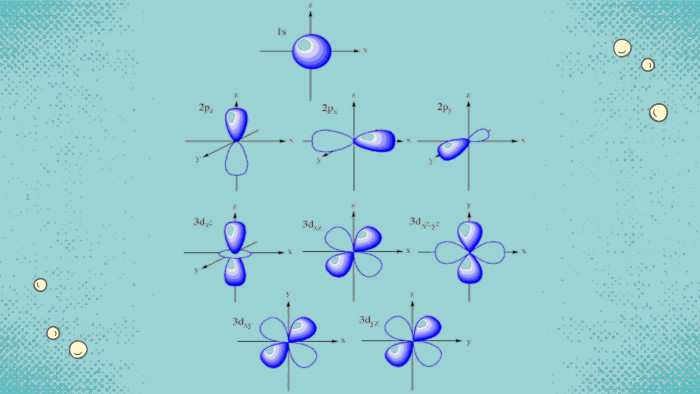
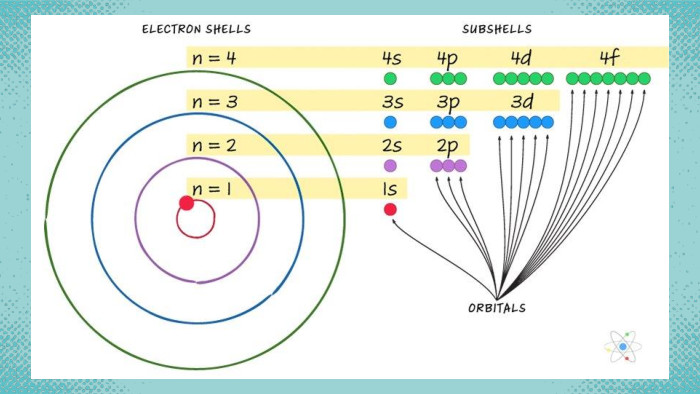
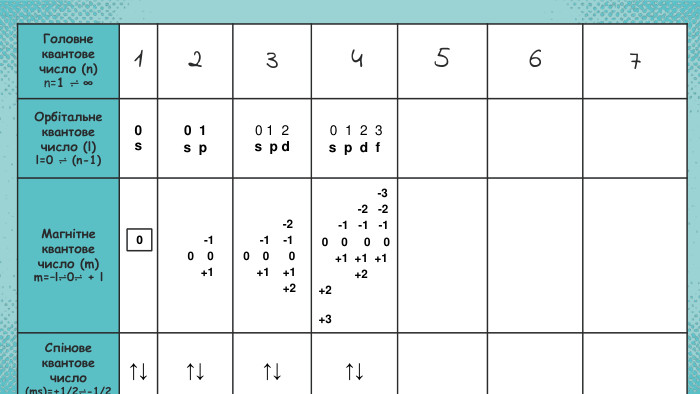
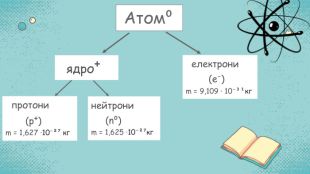
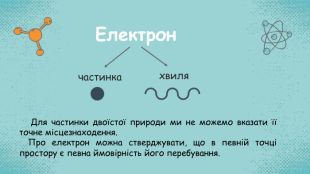
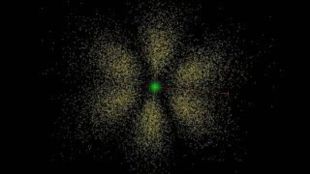
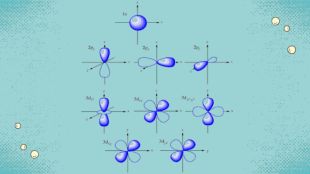
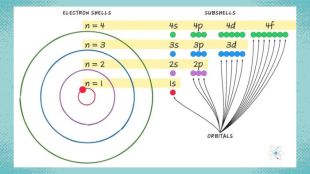
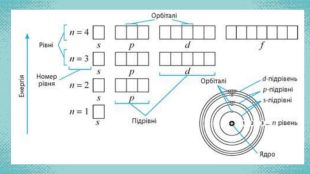
Стан електронів в атомі. Електронні орбіталі. Енергетичні рівні. Періодичний закон і періодична система хімічних елементів. Будова атома Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку