СТЕМ-урок, хімія та інформатика 9 клас "Навчальний проект №3 Виготовлення розчинів для надання домедичної допомоги з виконанням обчислень в табличному процесорі"
Хімія та інформатика 9 клас
Тема: Навчальний проект №3:«Виготовлення розчинів для надання домедичної допомоги з виконанням обчислень в табличному процесорі.»
Очікувані результати навчально-пізнавальної діяльності
Знаннєвий компонент
наводить приклади колоїдних та істинних розчинів, розчинників, суспензій, емульсій, аерозолів; пояснює вплив різних чинників на розчинність речовин; утворення водневого зв’язку; пояснює зв’язки адрес комірок в формулах;
Діяльнісний компонент
розрізняє компоненти розчину, насичені й ненасичені розчини; використовує арифметичні можливості для обчислень значень величин;
Ціннісний компонент
висловлює судження про значення розчинів у природі та житті людини; оцінює значення та зручність автоматизації обчислень за допомогою табличного процесора.
Обладнання: комп’ютери, терези, важки, скляні палички, хімічні стакани, вода; реактиви: сода, кухонна сіль, йод, борна кислота, цукор.
Хід уроку
І. Організація класу.
ІІ. Стадія виклику. Складання списку відомої інформації.
Розчини, дисперсні системи, колоїдні розчини, вода універсальний розчинник, органічні розчинники, компоненти розчину, розчинні та нерозчинні речовини, табличний процесор, формула, рядок формул, функція.
ІІІ. Стадія осмислення.
Демонстрація. Проведемо експеримент: візьмемо дві склянки по 20 мл води й додаватимемо в них порціями однакову кількість: у першу — цукру, у другу — питної соди. Що відбудеться?
Евристична бесіда.
Розчинність — це фізична величина, що показує, яку масу певної речовини можна розчинити в 1 л розчинника за певних температури й тиску.
- Як впливає температура на розчинність речовин?
- Які ще фактори впливають на розчинність?
Розчин, у якому певна речовина за певних температури й тиску більше не розчиняється, називається насиченим.
Розчин, у якому вміст розчиненої речовини менший за розчинність за певної температури, називається ненасиченим.
— Як можна з насиченого розчину зробити ненасичений?
— А чи можна з ненасиченого розчину зробити насичений?
У результаті повільного охолодження насиченого розчину можна одержати пересичений розчин.
Ненасичені розчини умовно поділяють на концентровані — з високим умістом розчиненої речовини, і розведені — з низьким умістом розчиненої речовини.
ІV. Стадія рефлексії. Навчальний проект.
Розчини дуже широко використовуються людиною. І сьогодні ми спробуємо приготувати розчини для надання домедичної допомоги. Всі обчислення ви повинні виконати за допомогою табличного процесора Excel 2010.
Інструктаж з БЖД з хімії та інформатики.
Група №1
Одним із поширених випадків у побуті є опік йодом. Як лікувати уражену ділянку?
- змивати речовину теплою водою протягом 10 хвилин;
- нейтралізувати дію йоду за допомогою мильної води або 20 % розчину цукру
- наносити обліпихову олію на уражену ділянку курсом від 3 до 5 днів;
- використовувати емульсії на основі Пантенола, втираючи в зону опіку 2-3 рази в день;
Для того щоб шкірні покриви могли швидше відновитися, важливо повністю обмежити зіткнення рани з водою, миючими засобами та будь-якими іншими подразниками.
Завдання.
Приготуйте 20% розчин цукру для лікування ураженої йодом ділянки шкіри, попередньо зробивши розрахунки.
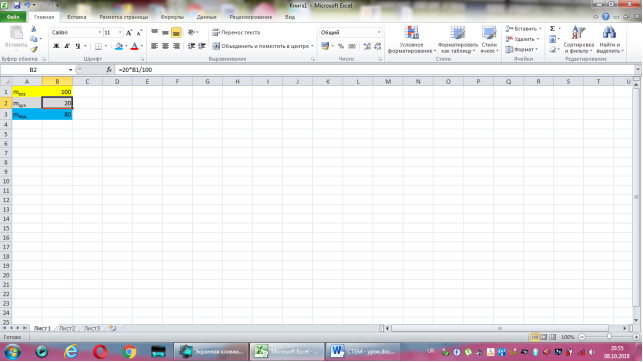
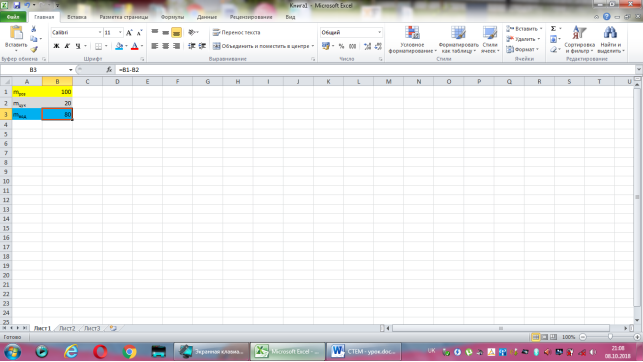
Відповідь: Нехай маса розчину дорівнює 100г, тоді маса цукру -20·100:100=20(г), а маса води 100-20=80(г).
Коміркам А1, А2, А3 надаємо відповідно назви величин: маса розчину, маса цукру, маса води. В комірку В2 вводимо формулу обчислення маси цукру, що має наступний вигляд: =20*B1/100. До комірки В3 записуємо формулу для знаходження маси води: =B1-B2. Залишається лише до комірки В1 ввести значення маси розчину.
Група №2
Одним з найбільш поширених симптомів, які зустрічаються як у дорослих, так і у малюків – це стріляючий біль всередині вуха. Найчастіше ця ознака свідчить про гострий отит, що виникає на тлі діючих вірусних або бактеріальних захворювань порожнини носа і носоглотки. Для лікування використовують антисептичний препарат - розчин борної кислоти. Дорослим готують 3% розчин, а дітям 2% розчин.
Завдання.
Приготуйте антисептичний препарат - 2% розчин борної кислоти, попередньо зробивши розрахунки.
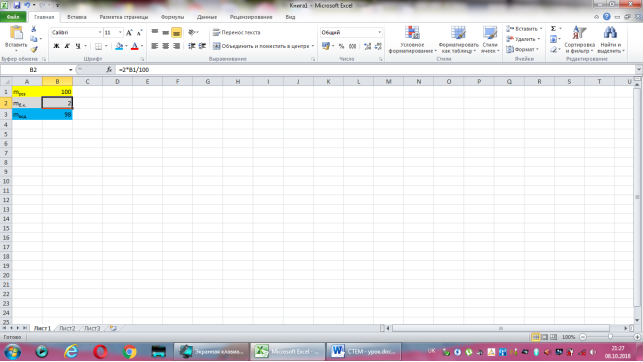
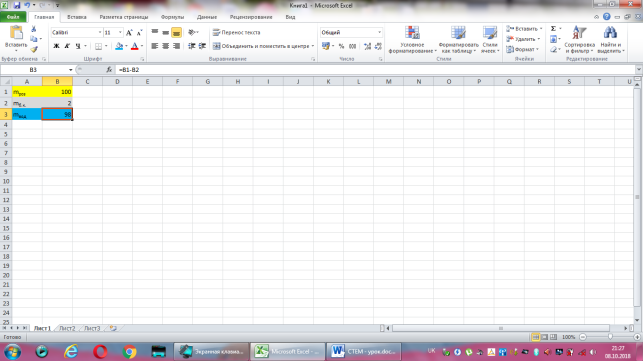
Відповідь: Нехай маса розчину дорівнює 100г, тоді маса борної кислоти -2·100:100=2(г), а маса води 100-2=98(г).
Коміркам А1, А2, А3 надаємо відповідно назви величин: маса розчину, маса борної кислоти, маса води. В комірку В2 вводимо формулу обчислення маси борної кислоти, що має наступний вигляд: =2*B1/100. До комірки В3 записуємо формулу для знаходження маси води: =B1-B2. Залишається лише до комірки В1 ввести значення маси розчину.
Група №3
З терапевтичною метою 2–4% водні розчини борної кислоти використовують для обробки ран та гнійних порожнин, полоскання ротової порожнини при стоматиті та промивання очей при кон’юнктивіті; 0,5–3% спиртові розчини — при лікуванні гострого та хронічного отиту, піодермії, екземі; 10% розчин у гліцерині — при кольпіті; у вигляді мазі (5–10%) та присипок — при запальних захворюваннях шкіри; у вигляді супозиторіїв — у гінекологічній практиці для лікування грибкових захворювань.
Завдання.
Для лікування екземи приготуйте 1-процентний розчин борної кислоти. Зробіть попередньо розрахунки.
Відповідь: Нехай маса розчину дорівнює 100г, тоді маса борної кислоти -1·100:100=1(г), а маса води 100-1=99(г).
Коміркам А1, А2, А3 надаємо відповідно назви величин: маса розчину, маса борної кислоти, маса води. В комірку В2 вводимо формулу обчислення маси борної кислоти, що має наступний вигляд: =1*B1/100. До комірки В3 записуємо формулу для знаходження маси води: =B1-B2. Залишається лише до комірки В1 ввести значення маси розчину.
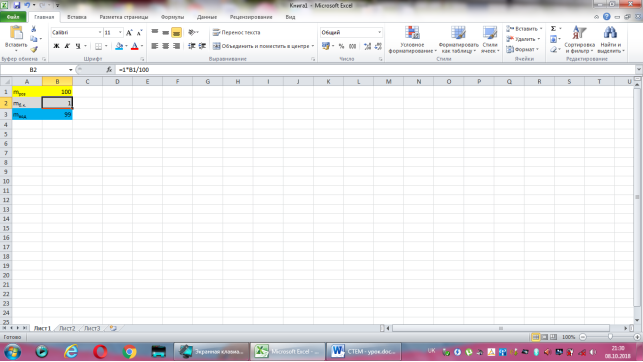
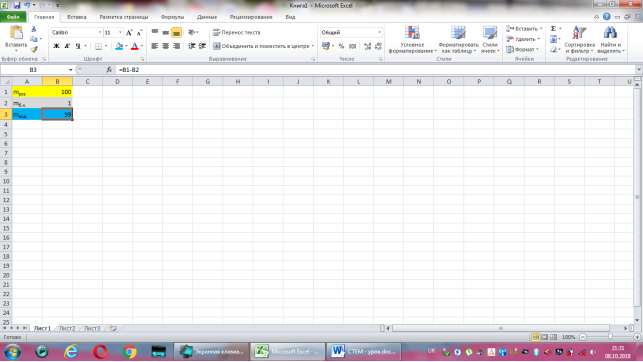
Група №4
Гіпертонічний розчин кухонної солі дуже славиться у побуті, адже його можна використовувати як лікувальний засіб. Дивовижні властивості води і хлориду натрію допоможуть в лікуванні ряду захворювань:
- апендициту в хронічній стадії;
- патологічних процесів суглобів і тканин;
- розвитку абсцесів різних внутрішніх органів;
- захворювань носоглотки (зокрема, риніту);
- головного болю;
- мігрені;
- гострих респіраторних і вірусних інфекцій;
- астми;
- ангіни;
- різних гематом;
- остеохондрозу;
- набряків різного походження;
- гінекологічних патологій;
- пошкоджень м’язових, суглобових тканин або кісток.
Завдання.
Приготуйте 8% розчин натрій хлориду, попередньо зробивши розрахунки.
Відповідь: Нехай маса розчину дорівнює 100г, тоді маса натрій хлориду -8·100:100=8(г), а маса води 100-8=92(г).
Коміркам А1, А2, А3 надаємо відповідно назви величин: маса розчину, маса натрій хлориду, маса води. В комірку В2 вводимо формулу обчислення маси натрій хлориду, що має наступний вигляд: =8*B1/100. До комірки В3 записуємо формулу для знаходження маси води: =B1-B2. Залишається лише до комірки В1 ввести значення маси розчину.
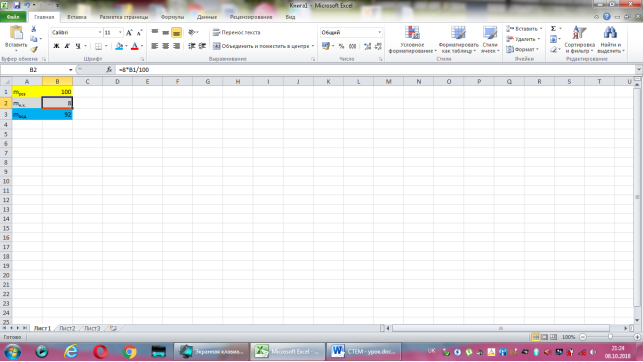
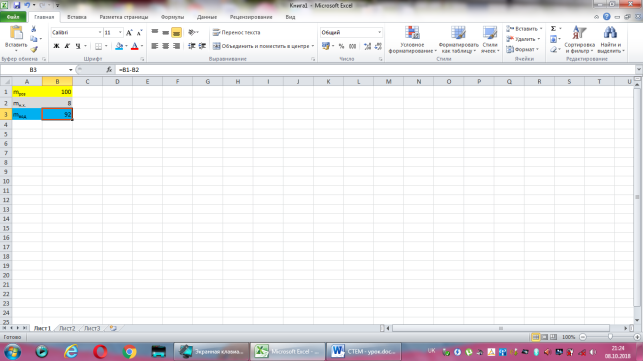
Група №5
Часто виникає необхідність промивання носової порожнини, наприклад, при нежиті під час ГРВІ, загострення сезонного риніту, забруднення слизової через запиленості або загазованості умов праці. Фізіологічний розчин швидко і легко очистити слизову від мікробів, пилу, розм’якшить сухі скоринки, полегшить дихання. Можна використовувати цей засіб для промивання носа не тільки при застуді, але й в профілактичних цілях під час загострення сезонних захворювань.
Завдання.
Приготуйте фізіологічний розчин, 0,9% розчин натрій хлориду, попередньо зробивши розрахунки.
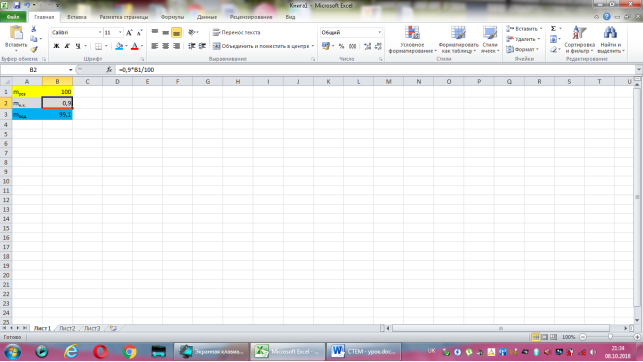
Відповідь: Нехай маса розчину дорівнює 100г, тоді маса натрій хлориду -0,9·100:100=0,9(г), а маса води 100-0,9=99,1(г).
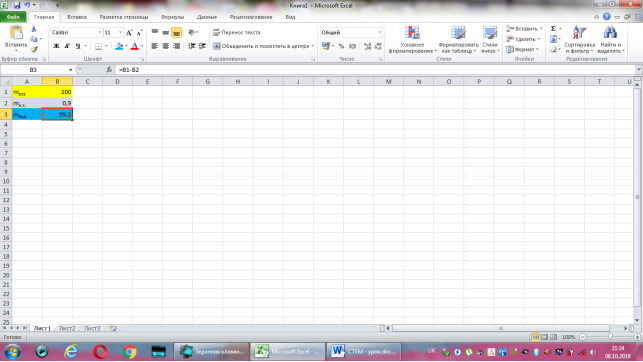
Коміркам А1, А2, А3 надаємо відповідно назви величин: маса розчину, маса натрій хлориду, маса води. В комірку В2 вводимо формулу обчислення маси натрій хлориду, що має наступний вигляд: =0,9*B1/100. До комірки В3 записуємо формулу для знаходження маси води: =B1-B2. Залишається лише до комірки В1 ввести значення маси розчину.
Група №6
Харчова сода - перший засіб для допомоги при ударах, порізах, тощо. Вона знімає набряклість, зменшує біль і зупиняє кровотечу. При багаторазовому блюванні використовують содовий розчин для поповнення втраченої рідини. При отруєнні рекомендується робити содові клізми.
Однак сода може принести не тільки користь, але і шкоду. Тривалий контакт з сухою содою (порошком) може призвести до опіку. Тому, після кожного використання порошку, ретельно мийте руки. І не допускайте попадання в очі. Якщо таке станеться, промийте очі рясно водою і зверніться до лікаря.
Завдання.
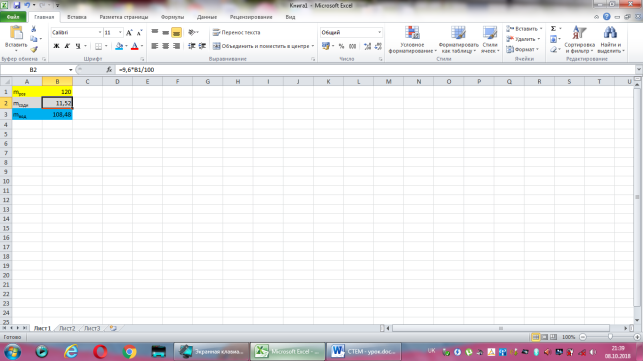
Приготуйте120г 9,6% розчину соди, який можна застосувати для зняття запалення ясен. Полоскати ротову порожнину варто 4-5 разів на день. Зробіть відповідні розрахунки.
Відповідь: Маса соди дорівнює 9,6·120:100=11,52(г), а маса води 120-11,52=108,48(г).
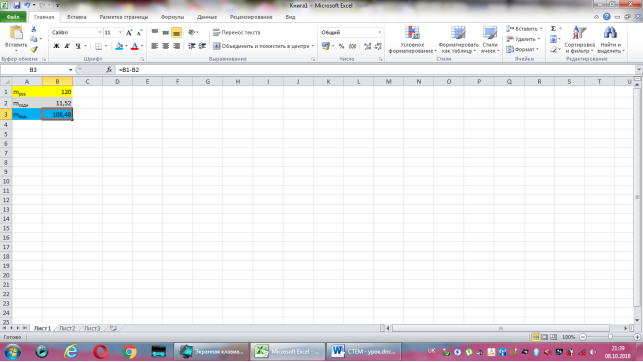
Коміркам А1, А2, А3 надаємо відповідно назви величин: маса розчину, маса соди, маса води. В комірку В2 вводимо формулу обчислення маси соди, що має наступний вигляд: =9,6*B1/100. До комірки В3 записуємо формулу для знаходження маси води: =B1-B2. Залишається лише до комірки В1 ввести значення маси розчину.
Представлення проектів.
V. Домашнє завдання.
Поцікавтеся які розчини та як використовують ваші рідні в домашніх умовах. Складіть задачу. За допомогою табличного процесора виконати обчислення. Підготуйте презентацію на цю тему.


про публікацію авторської розробки
Додати розробку
