Структура й функція білків






















Тернопільська обласна радауправління освіти та науки тернопільської облдержадміністраціїКременецька обласна гуманітарно-педагогічна академія ім. Тараса ШевченкаІНДЗ на тему«Структура й функція білків. »Виконав студент 2 курсу21-Е групи факультету фізичного виховання,біології та психології Шуманський. А. М
Білки́ — великі біомолекули та макромолекули, які містять один або кілька довгих ланцюгів амінокислотних залишків, сполучених пептидними зв'язками. Білки виконують широкий спектр функцій всередині організмів, включаючи каталізацію метаболічних реакцій, реплікацію ДНК, реагування на подразники, створення структури клітин і організмів і транспортування молекул з одного місця до іншого. Білки́
Зазвичай білки є лінійними полімерами — поліпептидами, хоча інколи мають складнішу структуру. Невеликі білкові молекули, тобто олігомери поліпептидів, називаються пептидами. Послідовність амінокислот у конкретному білку визначається відповідним геном і зашифрована генетичним кодом. Хоча генетичний код більшості організмів визначає лише 20 «стандартних» амінокислот, їхнє комбінування уможливлює створення великого різноманіття білків із різними властивостями
Білки були вперше описані шведським хіміком Єнсом Якобом Берцеліусом в 1838 році, який і дав їм назву протеїни . Проте їхня центральна роль в життєдіяльності всіх живих організмів була виявлена лише у 1926 році, коли Джеймс Самнер показав, що фермент уреаза також є білком. Секвенування першого білка — інсуліну, тобто визначення його амінокислотної послідовності, принесло Фредерику Сенгеру Нобелівську премію з хімії 1958 року. Перші тривимірні структури білків гемоглобіну і міоглобіну були отримані за допомогою рентгеноструктурного аналізу, за що автори методу, Макс Перуц і Джон Кендрю, отримали Нобелівську премію з хімії 1962 рок
Амі́нокисло́ти — органічні сполуки, які одночасно містять у своєму складі аміно- (- NH2) та карбоксильну (- СООН) групи. Амінокислоти є мономерними одиницями білків, у складі яких залишки амінокислот з'єднані пептидними зв'язками. Більшість білків побудовані із комбінації дев'ятнадцяти «первинних» амінокислот, тобто таких, що містять первинну аміногрупу, і однієї «вторинної» амінокислоти або імідокислоти (містить вторинну аміногрупу) проліну, що кодуються генетичним кодом. Амі́нокисло́ти
Класифікація амінокислот на основі полярності бічних ланцюгів. Властивості амінокислотних залишків у складі білків є вирішальними для структури і функціонування останніх. Зокрема амінокислоти суттєво відрізняються за полярністю бічних ланцюгів, а отже і особливостями взаємодії із молекулами води. На основі цих відмінностей протеїногенні амінокислоти поділяють на чотири групи:амінокислоти із неполярними бічними ланцюгами,амінокислоти із полярними незарядженими бічними ланцюгами (інколи розділяють на амінокислоти із неполярними аліфатичними та неполярними циклічними бічними ланцюгами),амінокислоти із позитивно зарядженими бічними ланцюгами,амінокислоти із негативно зарядженими бічними ланцюгами (інколи останні дві групи об'єднують в одну).
У цю групу об'єднують дев'ять амінокислот, бічні групи яких є неполярними і гідрофобними. Найменшою з них є гліцин, що не має бічного ланцюга (біля α-атома карбону, крім карбоксильної і аміногрупи, розміщені два атоми водню). Хоч гліцин класифікують як неполярну амінокислоту, він не робить жодного внеску у забезпечення гідрофобних взаємодій в молекулах білків. Аланін, лейцин та ізолейцин мають аліфатичні вуглеводневі бічні групи: метильну, бутильну та ізобутильну відповідно. Метіонін є сірковмісною амінокислотою, його бічний ланцюг представлений неполярним тіоловим естером. Амінокислоти із неполярними бічними групами
Шість амінокислот мають полярні незаряджені бічні ланцюги: серин, треонін, тирозин, цистеїн, аспарагін і глутамін. Серин і треонін містять гідроксильну групу, аспарагін і глутамін — амідну, тирозин — фенольну. До складу цистеїну входить тіольна група - SH, завдяки чому дві молекули (чи їх залишки у складі пептидів) цієї речовини можуть з'єднуватись дисульфідним зв'язком, що формується шляхом окиснення - SH груп. Такі зв'язки важливі для формування і підтримання структури білків. Оскільки дві молекули цистеїну, з'єднані дисульфідним зв'язком, раніше вважались окремою амінокислотою, таку сполуку називали цистином, тепер цей термін вживають рідко. Амінокислоти із полярними незарядженими бічними групами
Дві амінокислоти мають сумарний негативний заряд за фізіологічного p. H (7,0): аспарагінова і глутамінова кислоти. Обидві мають по додатковій карбоксильній групі. Їхні іонізовані форми називають аспартатом та глутаматом відповідно. Аміди цих амінокислот — аспарагін і глутамін також входять до складу білків. Амінокислоти із негативно зарядженими бічними групами
Три протеїногенні амінокислоти мають позитивно заряджені бічні групи при фізіологічних значеннях p. H: лізин, аргінін і гістидин. Лізин має додаткову первинну аміногрупу в ε-положенні. До складу аргініну входить гуанідинове угрупування, а гістидин містить імідазолове кільце. Серед усіх протеїногенних амінокислот тільки гістидин має групу, що іонізується за фізіологічного p. H (p. Ka = 6,0). Через це його бічний ланцюг при p. H 7,0 може бути нейтральним або позитивно зарядженим. Завдяки цій властивості гістидин входить до складу активних центрів багатьох ферментів, і бере участь у каталізі хімічних реакцій як донор/акцептор протонів. Амінокислоти із позитивно зарядженими бічними групами
Розчиність. За здатністю розчинятися білки діляться на розчинні і нерозчинні. До розчинних відноситься білок курячого яйця. Не можуть розчинятися білки вовни, пір'я, нігтів. Гідроліз. При дії води у присутності кислоти або ферментів білки піддаються гідролізу. У результаті розщеплення білкових молекул водою утворюється суміш амінокислот. Такий процес відбувається в органах травлення при перетравленні білкової їжі. Утворені амінокислоти всмоктуються у кров і використовуються організмом для синтезу власних білків.
Денатурація. Денатурація — руйнування просторової структури білка. Вона відбувається при нагріванні білків, під дією радіоактивного випромінювання, деяких хімічних речовин (кислот, лугів, солей важких металів). При денатурації білки змінюють свої властивості і втрачають біологічну активність, незважаючи на те, що їх первинна структура зберігається. Розклад при нагріванніПри сильному нагріванні білки горять. При цьому утворюються речовини зі своєрідним запахом паленого пір'я. По запаху можна легко відрізнити вовняні або шовкові волокна від синтетичних.
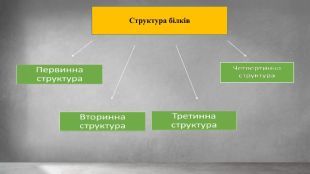
Структура білків. Для функціонування білків украй важлива як Їх амінокислотна (пептидна) послідовність, так і тривимірна структура, яка формується в процесі згортання . Тривимірна структура білків за нормальними природними умовами називається нативним станом білка. Зазвичай структура білків поділяється на чотири рівні : Первинна структура — послідовність амінокислот у пептидному ланцюжку. Вторинна структура — регулярні підструктури (наприклад альфа-спіралі і бета-листи), які визначаються локально, таким чином що в одній молекулі білка зазвичай існує багато подібних структурних елементів (мотивів). Третинна структура — тривимірна структура єдиної білкової молекули, просторове розташування вторинних структур. Четвертинна структура — комплекс кількох молекул білка або поліпептидних ланцюжків, який зазвичай називають білком у цьому контексті, що функціонують разом у складі білкового комплексу.
Первинна структура. Первинна структура — структура біологічної макромолекули із точним вказанням усіх атомів та хімічних зв'язків, що їх з'єднують (включаючи стереохімію). Для типової нерозгалуженої біополімерної молекули без перехресних зв'язків (наприклад, ДНК, РНК або типового внутрішньоклітинного білка), первинна структура еквівалентна послідовності її мономерних субодиниць, тобто нуклеотидна або амінокислотна послідовність.
Вторинна структура. Вторинна структура — конформаційне розташування головного ланцюга макромолекули (наприклад, поліпептидного ланцюга білка або ланцюга нуклеїнових кислот), незалежно від конформації бічних ланцюгів або відношення до інших сегментів. В описі вторинної структури важливим є визначення водневих зв'язків, що стабілізують окремі фрагменти макромолекул.
Третинна структура білків Третинна структура білків — третинна структура окремих поліпептидних ланцюгів білків, тобто просторова структура, яку приймає єдина білкова молекула. Третинна структура є проміжним рівнем між вторинною (локальне просторове впорядкування амінокислот) і червертинною (структура білкового комплексу) структурами білків. Зазвичай до третинної структури відносять елементи «надвторинної структури», тобто структурні мотиви і домени білків. третинна структура міоглобіну — А-спіраль згорнута нерегулярним чином в компактну глобулу
Четвертинна структура Четвертинна структура — спосіб укладання в просторі окремих поліпептидних ланцюгів, що володіють однаковою первинною, вторинною або третинною структурою, і формування єдиного в структурному і функціональному відношеннях макромолекулярного утворення. Специфічність четвертинної структури білків проявляється в певній конформаційній автономії поліпептидних фрагментів, що входять до складу макромолекули білка. Вклад гідрофобних взаємодій у стабілізацію третинної і четвертинної структури білків досить значний : у разі третинної структури на їх частку припадає, більше половини стабілізуючої сили.
СПИСОК ВИКОРИСТАННИХ ДЖЕРЕЛBruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter (2002). Molecular Biology of the Cell (вид. 4th). Garland. ISBN 0815332181. Архів оригіналу за 25 жовтня 2007. Процитовано 3 лютого 2008. (англ.) (див. «Молекулярна біологія клітини»)David L. Nelson and Michael M. Cox (2004). Lehninger Principles of Biochemistry (вид. 4th). W. H. Freeman & Co. ISBN 0716743396. Процитовано 3 лютого 2008. (англ.) (див. також російський переклад першого видання Ленинджер А. (1985). Основы биохимии. В 3 томах. Москва: Мир.)Berg, Jeremy M.; Tymoczko, John L.; and Stryer, Lubert. (2002). Biochemistry. New York: W. H. Freeman and Co. Архів оригіналу за 29 жовтня 2007. Процитовано 3 лютого 2008. (англ.)Степанов В. М. (2005). Молекулярная биология. Структура и функция белков. Москва: Наука. ISBN 5-211-04971-3. (рос.)Рубин А. Б. (1999). Биофизика (вид. 2). Москва. Университет. Архів оригіналу за 10 лютого 2008. Процитовано 3 лютого 2008. (рос.)Финкельштейн А. В., Птицын О. Б. (2005). Физика белка: Курс лекций с цветными и стереоскопическими иллюстрациями и задачами с решениями. (вид. 2-е). Москва: Книжный дом «Университет». ISBN 5-98227-065-2. (рос.)А. В. Сиволоб (2008). Молекулярна біологія. К: Видавничо-поліграфічний центр «Київський університет». с. 33-64. Архів оригіналу за 4 березня 2016. Процитовано 27 березня 2016. Людина. / Навч. посібник з анатомії та фізіології. — Львів. 2002. — 240 с.


про публікацію авторської розробки
Додати розробку