Сучасна модель атома. Протонно-нейтронна модель ядра атома. Ядерні сили. Ізотопи
1
Урок 47 Сучасна модель атома. Протонно-нейтронна модель ядра атома. Ядерні сили. Ізотопи
Мета уроку: сформувати знання про сучасні погляди на модель атома та атомного ядра, ізотопи, сильну взаємодію нуклонів.
Очікувані результати: учні повинні пояснювати дослід Резерфорда, характеризувати ядерну модель атома та протоннонейтронну модель атомного ядра, давати означення нуклона, знати, що таке сильна взаємодія, називати основні властивості ядерних сил.
Тип уроку: урок засвоєння нових знань.
Наочність і обладнання: навчальна презентація, комп’ютер, підручник, Періодична система хімічних елементів Д. І. Менделєєва.
Хід уроку
І. ОРГАНІЗАЦІЙНИЙ ЕТАП
II. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ ТА ВМІНЬ
Що ви знаєте про будову речовини?
Яка будова атома?
Яким чином її вдалося встановити?
Які гіпотези висувалися для теоретичних і практичних досліджень?
IІІ. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Модель атома Джозефа Томсона
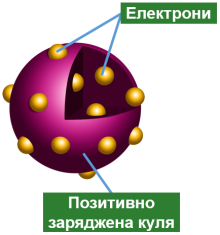 Джозеф Томсон відкрив електрон ще в 1897 р. Виходячи з відомостей про електронейтральність атома, учений створив модель: атом складається з позитивно зарядженої кулі, заряд якої рівномірно розподілено по всьому об’єму, і негативно заряджених електронів, розміщених у цьому об’ємі. Модель була схожа на пудинг з родзинками.
Джозеф Томсон відкрив електрон ще в 1897 р. Виходячи з відомостей про електронейтральність атома, учений створив модель: атом складається з позитивно зарядженої кулі, заряд якої рівномірно розподілено по всьому об’єму, і негативно заряджених електронів, розміщених у цьому об’ємі. Модель була схожа на пудинг з родзинками.
Виходячи з моделі атома Томсона, можна було пояснити явища йонізації атомів, електролізу, періодичну систему елементів, але вона не давала змоги пояснити електромагнітні та оптичні явища.
Проблемне питання
• Чи дійсно позитивний заряд розподілений по всьому об'єму атома?
2. Класичний дослід Резерфорда
Ернест Резерфорд, Ернест Марсден і Ганс Гейгер у 1908-1911 рр. проводили серію дослідів щодо з’ясування структури атома. Для дослідів учені використали речовину, із якої з великою швидкістю вилітали позитивно заряджені частинки – так звані α-частинки.
Вузький пучок α-частинок зі свинцевого контейнера спрямовувався на тонку золоту фольгу, а далі потрапляв в екран, покритий шаром кристалів цинк сульфіду. Якщо в такий екран улучала α-частинка, то в місці її влучання відбувався слабкий спалах світла. Учені спостерігали спалахи за допомогою мікроскопа та реєстрували влучання α-частинок в екран.
Під час дослідів було виявлено:
-
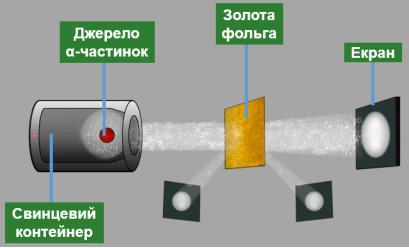 переважна більшість α- частинок проходить крізь золоту фольгу, не змінюючи напрямку руху;
переважна більшість α- частинок проходить крізь золоту фольгу, не змінюючи напрямку руху;
- деякі відхиляються від початкової траєкторії;
- приблизно одна з 20 000 частинок відскакувала від фольги, начебто натикаючись на якусь перешкоду.
Проблемне питання
• Чому деякі α-частинки відскакують від фольги?
Оскільки побачити атом неможливо, то пояснення зміни напрямку руху α- частинок ґрунтувалося на логічних припущеннях.
Учений ретельно підрахував кількість частинок, що летіли в кожному з напрямків, а потім за допомогою складного, але переконливого математичного аналізу обґрунтував ядерну модель атома.
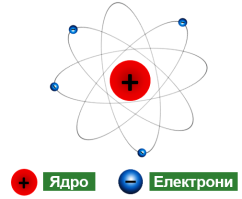 Ядерна модель будови атома:
Ядерна модель будови атома:
- атом складається з позитивно зарядженого ядра, оточеного негативно зарядженими частинками – електронами;
- 99,9% маси і весь позитивний заряд атома зосереджені в ядрі атома;
- розмір ядра порівняно з атомом надзвичайно малий (діаметр атома становить приблизно 10– 10 м, а ядра – 10–15 м).
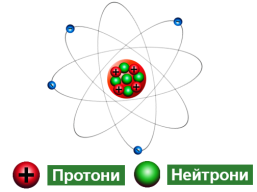 3. Будова атомного ядра
3. Будова атомного ядра
Атомне ядро складається із частинок двох видів:
- протони (мають позитивний електричний заряд);
- нейтрони (не мають заряду).
Нуклони – це протони й нейтрони, що входять до складу ядра атома.
Нуклонне (масове) число (А) – це сумарна кількість протонів і нейтронів в атомі.
Зарядове (протонне) число (Z) – це кількість протонів у ядрі.
Кількість нейтронів (N) у цьому ядрі: N = A – Z.
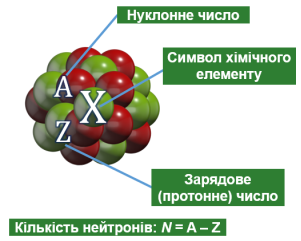 Нуклід – це вид атомів, який характеризується певним значенням зарядового числа та певним значенням масового числа.
Нуклід – це вид атомів, який характеризується певним значенням зарядового числа та певним значенням масового числа.
Проблемне питання
• Скільки протонів і нейтронів містить ядро нукліда Титану ![]() ?
?
![]()
 Ізотопи – це різновиди атомів того самого хімічного елемента, ядра яких містять однакове число протонів, але різну кількість нейтронів.
Ізотопи – це різновиди атомів того самого хімічного елемента, ядра яких містять однакове число протонів, але різну кількість нейтронів.
 4. Сильна взаємодія
4. Сильна взаємодія
Проблемне питання
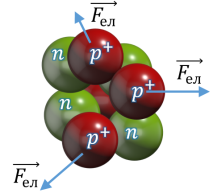
• Яким чином у складі одного ядра і на дуже близькій відстані один від одного утримуються протони, адже однойменно заряджені частинки відштовхуються?
Кулонівські (електростатичні) сили відштовхування намагаються «зруйнувати» ядро.
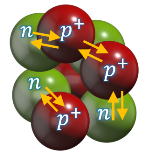
Ядерні сили – це сили, які діють між протонами й нейтронами в ядрі та забезпечують існування атомних ядер.
Основні властивості ядерних сил:
1) є тільки силами притягання;
2) є близькодіючими: вимірювання показали, що ядерні сили між нуклонами виявляються лише на відстанях, які приблизно дорівнюють розмірам нуклона (10–15 м);
3) не залежать від заряду: на однаковій відстані сили, що діють між двома протонами, між двома нейтронами або між протоном і нейтроном, є однаковими;
4) мають властивість насичення: нуклон виявляється здатним до ядерної взаємодії одночасно лише з невеликою кількістю нуклонів-«сусідів»
ІV. ЗАКРІПЛЕННЯ НОВИХ ЗНАНЬ І ВМІНЬ
1. Скільки протонів і скільки нейтронів міститься в ядрах атомів Меркурію ![]() , Купруму
, Купруму ![]() , Германію
, Германію ![]() ?
?
Меркурій ![]()
Купрум ![]()
Германій ![]()
2. Як визначити кількість електронів в атомі?
Атом є електрично нейтральним: сумарний заряд протонів у ядрі дорівнює сумарному заряду електронів, що розташовані навколо ядра. Оскільки заряд протона за модулем дорівнює заряду електрона, то зрозуміло, що в атомі кількість протонів дорівнює кількості електронів.
3. У ядрі атома Брому 35 протонів і 45 нейтронів. Скільки електронів у цьому атомі?
В атомі кількість протонів дорівнює кількості електронів тому в атомі Брому міститься 35 електронів.
4. У ядрі атома Карбону міститься 12 частинок. Навколо ядра рухаються 6 електронів. Скільки в ядрі цього атома протонів і нейтронів?
Оскільки в атомі кількість протонів дорівнює кількості електронів, то
![]()
5. У ядрі атома певного хімічного елемента 31 протон і 39 нейтронів. Що це за елемент?
![]()
Галій ![]()
6. Чим відрізняються ядра ізотопів Феруму: ![]() ?
?
Ядра ізотопів Феруму відрізняються кількістю нейтронів.
V. ПІДБИТТЯ ПІДСУМКІВ УРОКУ
1. Опишіть дослід Е. Резерфорда із розсіяння α-частинок та його результати.
2. Із яких частинок складається атом? атомне ядро?
3. Що таке зарядове число? масове число?
4. Як визначити кількість протонів і нейтронів у ядрі? Наведіть приклад.
5. Що таке нуклід?
6. Які нукліди називають ізотопами? Назвіть ізотопи Гідрогену.
7. Який тип взаємодії забезпечує утримання нуклонів у ядрі атома?
8. Дайте означення ядерних сил, назвіть їхні властивості.
VI. Домашнє завдання
Опрацювати § 22, Вправа № 22 (1 – 4)


про публікацію авторської розробки
Додати розробку
