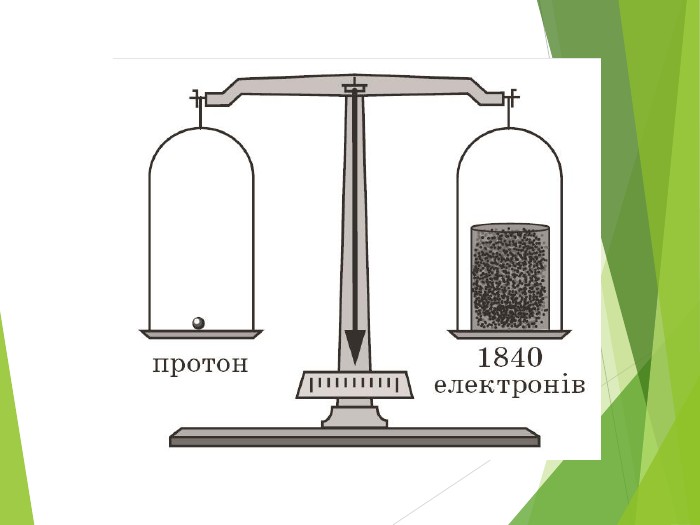
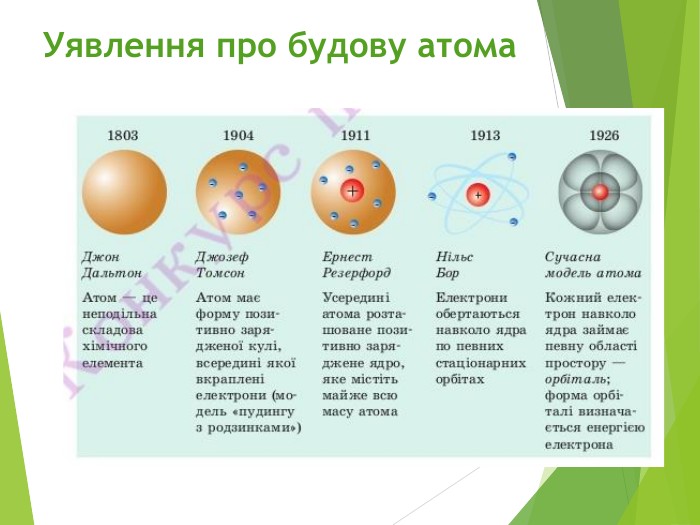
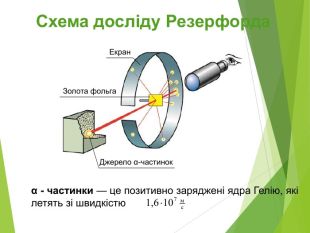
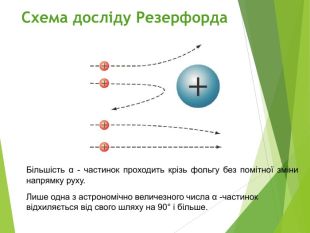
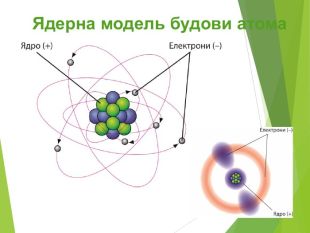
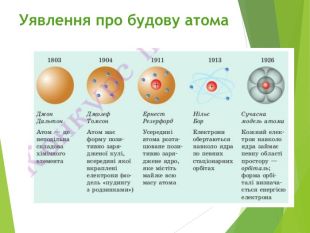
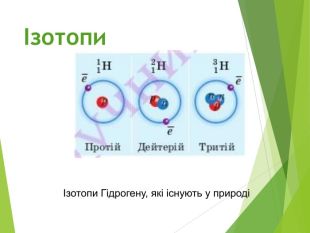
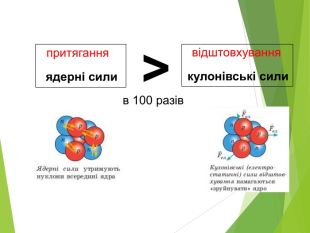
Сучасна ядерна модель атома.Ядерні сили ізотопи.
Про матеріал
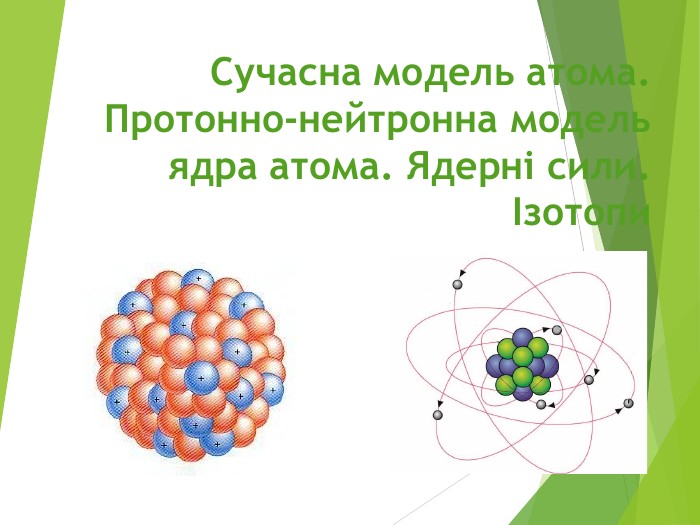
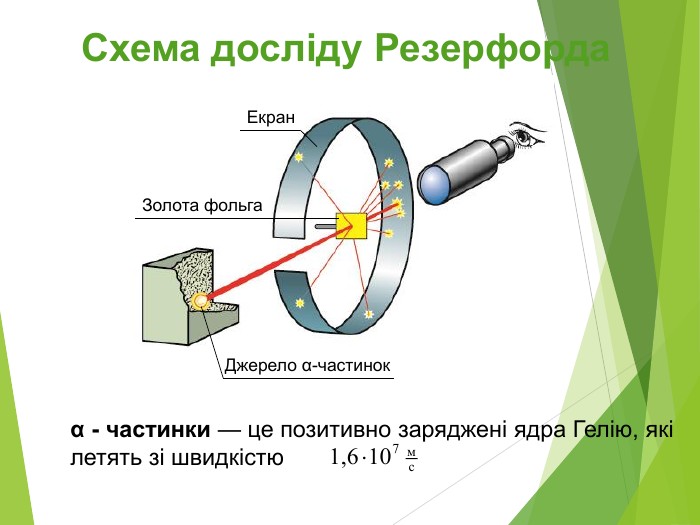
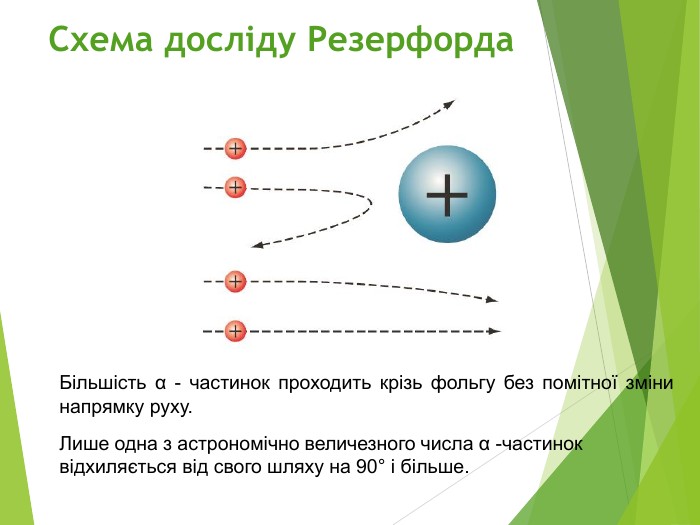
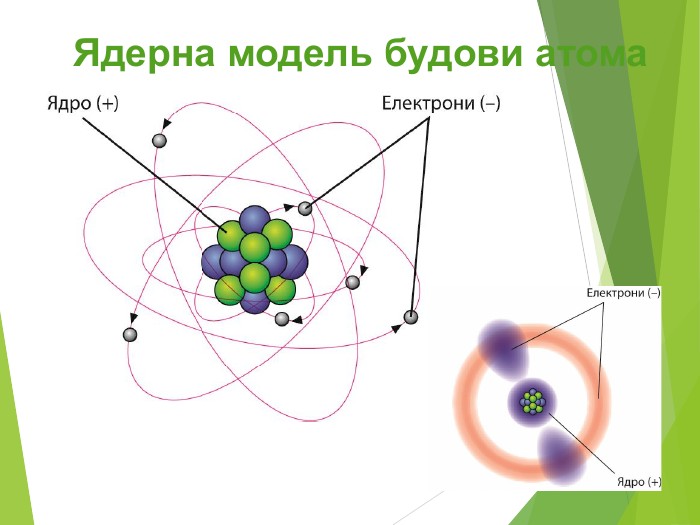
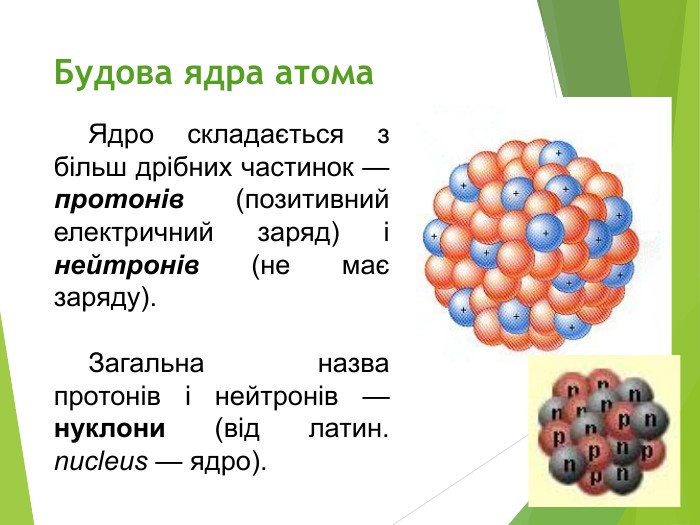
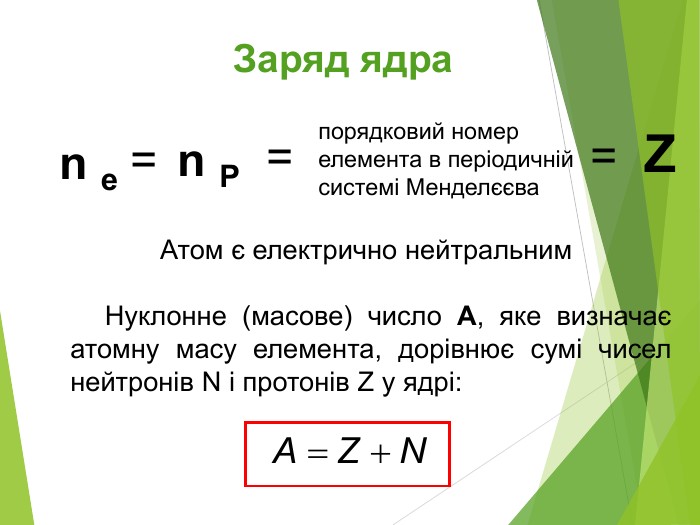
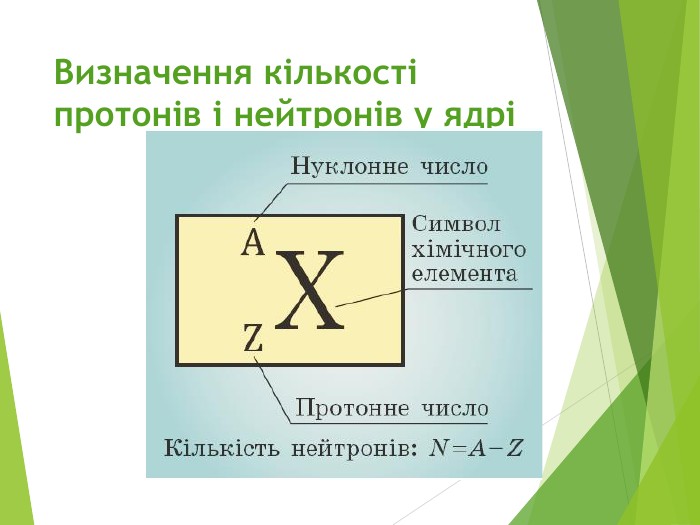
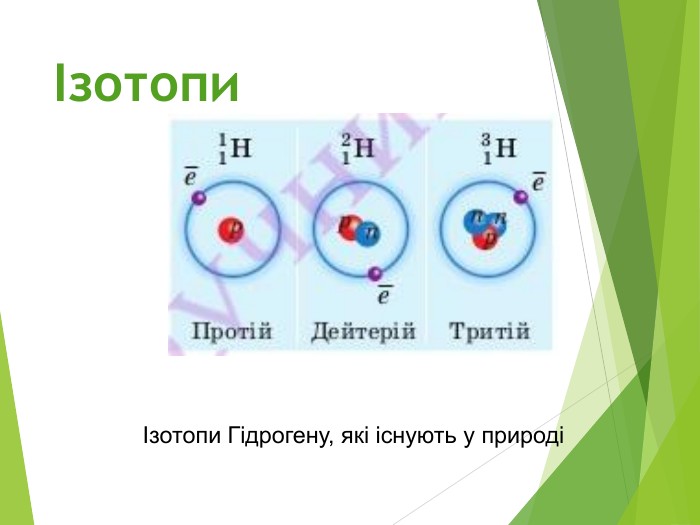
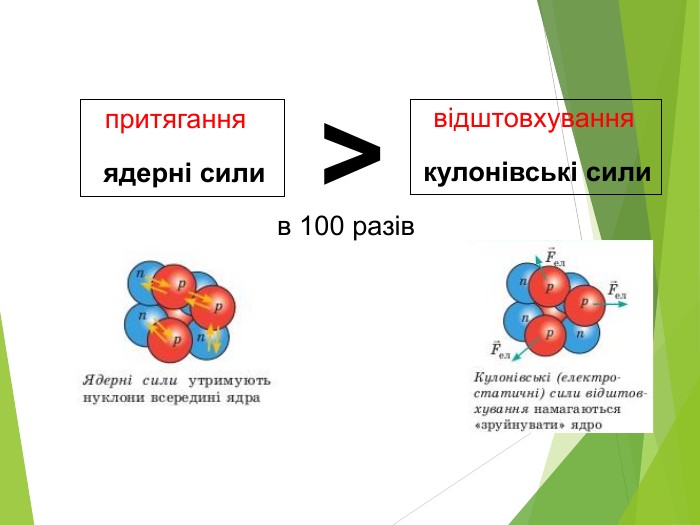
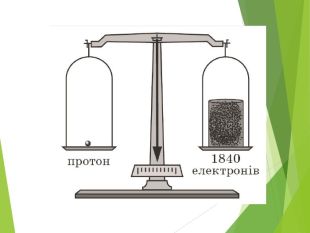
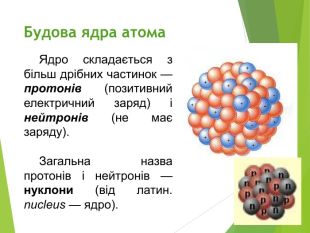
Будова ядра атома.Ядро складається з більш дрібних частинок — протонів (позитивний електричний заряд) і нейтронів (не має заряду).
Загальна назва протонів і нейтронів — нуклони (від латин. nucleus — ядро).
Перегляд файлу
Зміст слайдів
ppt
До підручника
Фізика 9 клас (Бар'яхтар В.Г., Довгий С.О., Божинова Ф.Я., Кирюхіна О.О. (за редакцією Баряхтара В.Г., Довгого С.О.))
До уроку
§ 31. Атом і атомне ядро Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку