Сучасні малоівазивні методи хірургічного лікування ісультів для нейрохірургів ,кардіологів.
Міністерство освіти та науки
Дисертація
На здобуття наукової степені кандидата наук.
Сучасний підхіт пароксезмальних станів в нейрохірургічному лікуванні інсультів .
Данилової Інеси Віталіївної
Київська міська клінічна лікарня швидкої допомоги.
Київ 2020 рік.
Зміст
ПЕРЕЛІК УМОВНИХ СКОРОЧЕНЬ…..………………………………………4
ВСТУП…………………………………………………………………………...6
РОЗДІЛ I. ОГЛЯД ЛІТЕРАТУРИ
1.1. Епідеміологія мозкового інсульту……………………………..….10
1.2. Фактори ризику виникнення церебрального інсульту серед осіб
молодого віку……………………………………………………………..14
1.3. Особливості клінічної картини та морфологічних змін головного
мозку в гострому періоді мозкового інсульту………………………..33
РОЗДІЛ ІІ. ЕПІДЕМІОЛОГІЯ ГОСТРИХ ПОРУШЕНЬ МОЗКОВОГО
КРОВООБІГУ В М. Києва…………………………………………………36
РОЗДІЛ ІІІ. МАТЕРІАЛ І МЕТОДИ ДОСЛІДЖЕННЯ…………………….41
РОЗДІЛ IV. ФАКТОРИ РИЗИКУ МОЗКОВОГО ІНСУЛЬТУ В ОСІБ
МОЛОДОГО ТА ЗРІЛОГО ВІКУ…………………………………………….44
РОЗДІЛ V. КЛІНІЧНА ХАРАКТЕРИСТИКА ХВОРИХ В ГОСТРОМУ
ПЕРІОДІ МОЗКОВОГО ІНСУЛЬТУ …….……………..………………….. 49
5.1. Клінічна характеристика хворих з фатальним мозковим
інсультом………………............................................................................50
5.2. Клінічна характеристика хворих з нефатальним мозковим інсультом.......52
РОЗДІЛ VІ. СУЧАСНА ХАРАКТЕРИСТИКА МОЗКОВОГО ІНСУЛЬТУ У ХВОРИХ МОЛОДОГО ВІКУ……………………….……………………………54
РОЗДІЛ VІІ. ХАРАКТЕРИСТИКА УСКЛАДНЕНЬ ГОСТРОГО
7.1ПЕРІОДУ МОЗКОВОГО ІНСУЛЬТУ……………………………………......57
РОЗДІЛ VIII. РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ ТА ЇХ ОБГОВОРЕННЯ……60
ВИСНОВКИ……………………………………….65
ПРАКТИЧНІ РЕКОМЕНДАЦІЇ…….…………………………………….......68
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ………….............................................70
ДОДАТОК А. Тест Mini Mental State Examination………………………….80
ПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ
АГ – артеріальна гіпертензія
АТ– артеріальний тиск
ВК – внутрішньомозковий крововилив
ВООЗ – Всесвітня організація охорони здоров’я
ВСА – внутрішня сонна артерія
ГІМ – гострий інфаркт міокарда
ГІ – геморагічний інсульт
МВОЗ – міський відділ охорони здоров’я
ГПМК – гостре порушення мозкового кровообігу
ГТ геморагічна трансформація
ГХС – гіперхолестеринемія
ІХС – ішемічна хвороба серця
ІМ – інфаркт мозку
І – ішемічний інсульт
КТ – комп’ютерна томографія
МІ – мозковий інсульт
МПМК – минуще порушення мозкового кровообігу
ПМА – передня мозкова артерія
САК – субарахноїдальний крововилив
СМА – середня мозкова артерія
ТІН – транзиторний ішемічний напад
ТЕЛА – тромбоемболія легеневої артерії
ФП – фібриляція передсердь
ФР – фактори ризику
ЦВЗ – цереброваскулярні захворювання
ЦД – цукровий діабет
ЧДД – частота дихальних рухів
ЧСС – частота серцевих скорочень
ШКГ – шкала ком Глазго
ВСТУП
На сьогодні судинні ураження нервової системи - одна з найважливіших проблем клінічної неврології та малоівазивної хірургії ,нейрохірургії через невпинне зростання цієї патології, особливо у осіб працездатного віку, не зважаючи на велику кількість сучасних методів діагностики та лікування.
Пароксизмальних станів у неврології та нейрохірургії зоседженно на надання первиної та вториної допомоги та подальшого хірургічного лікування мозкових ГПМК ,інсультив, усунення негативних наслідків ураження головного мозку.
На сьогоднішній день у світі близько 9 млн. людей страждають цереброваскулярними захворюваннями [7,8,10,17,25,28,48- 50,119,123].
У світі щороку переносять перший або повторний інсульт близько 15 млн. людей. В Україні, згідно офіційної статистики МОЗ України,
реєструється в рік не менше 350тис. нових випадків інсульту [49,50]. За прогнозами експертів ВООЗ до 2019р-2020 рік., число померлих у світі внаслідокГПМК збільшиться до 9 млн. Міжнародна організація по боротьбі з ГПМК інсультом називає церебральну патологію «глобальною епідемією». Різні аспекти цієї проблеми інтенсивно вивчаються неврологами, нейрохірургами, генетиками практично у всіх розвинутих країнах світу. Інсульт щороку обговорюється на багаточисленних міжнародних, європейських, регіональних з’їздах і конференціях, публікуються матеріали в спеціалізованих журналах, монографіях, навчальних посібниках. Більшість досліджень направлено на вивчення захворювання інсультом в популяції в цілому без вікової орієнтації, хоча статистика останніх років свідчить про зростання чисельності судинних захворювань головного мозку у людей молодого віку (ВООЗ відносить осіб від 15 до 45 років). Складність проблеми ГПМК у молодих пацієнтів обумовлена недостатністю вивчення даної патології, низькою інформативністю населення про перші симптоми та їх наслідки, які займають перше місце серед причин первинної інвалідності, та неблагополучною соціально-економічною ситуацією [9, 17, 26, 119, 127].
Варто зазначити, що в більш економічно розвинутих країнах – Швеції, Норвегії, Японії, Канаді, США, Австралії - показники захворювання в 2-4 рази менші ніж у нашій країні [9, 48, 50, 51.].
На сьогодні люди раннього віку розквіті сил, в репродуктивному віці та на піку професійної і творчої діяльності більше підлягають ризику винекнення інсультів згідно протоколів американської асоціації інститутів інсультів та українсько-европейської асоціації інсультів в Україні ,це становить близько 95% всіх інсультів. Ці питання є ктуальними.,оскільки інтерес до вияснення причин ГПМК у осіб молодого віку зумовлений наступними факторами: етіологія інсультів у більшості хворих молодого віку відрізняється від етіології у хворих старшої вікової групи і часто залишається невиясненою, що має значення для проведення кваліфікованої профілактики повторних епізодів; недостатньо розроблений ,алгоритм обстеження молодих пацієнтів.
Мета дослідження
Підвищити ефективність профілактики, діагностики, лікування мозкових інсультів у молодих осіб та осіб зрілого віку, що складають категорію працездатних, шляхом вивчення структури факторів ризику їх виникнення, а також особливостей клінічного перебігу і структурно-морфологічних змін речовини мозку у хворих в і України на моделі м. Києва .
Задачі дослідження
1. Вивчити епідеміологію мозкового інсульту шляхом аналізу медичної документації.
2. Вивчити структуру ФР МІ у обстежених хворих залежно від його типу.
4. Вивчити особливості клінічного перебігу, якість надання медичної
допомоги, структурні зміни головного мозку, дані лабораторних досліджень у цієї групи хворих з МІ.
5. На підставі отриманих результатів розробити рекомендації щодо
профілактичних заходів, спрямованих на зниження захворюваності і
смертності від МІ в цьому регіоні.
Об'єкт дослідження
Хворі з мозковим інсультом.
Предмет дослідження
Епідеміологія, фактори ризику МІ, клінічні прояви, особливості перебігу і структурні зміни головного мозку при МІ.
Методи дослідження
1. Аналіз звітної документації. 2. Загально-клінічне і клініко-неврологічне
обстеження хворих. 3. Психодіагностичні методики (Mini Mental State
examination), опитувальник Бека для виявлення депресивних порушень. 4.
Нейровізуалізаційний метод дослідження (комп'ютерна томографія
головного мозку).
5. Клініко-лабораторне дослідження.
6. Патоморфологічний.
7. Статистичний аналіз.
Наукова новизна отриманих результатів. Визначено розповсюдженість основних ФР МІ у хворих молодого та зрілого віку та їх поєднання, які впливають на виникнення і перебіг цього захворювання в залежності від його типу в дослідженої популяції. Оцінено якість надання медичної допомоги: визначено відсоток хворих, що отримали невідкладну допомогу протягом перших шести годин від початку захворювання, а також причини пізньої госпіталізації в профільні стаціонари.
Виявлено особливості клінічного перебігу найгострішого і гострого
періодів фатального і нефатального МІ, структура летальних кінців, роль інтра- та екстрацеребральних ускладнень.
Практичне значення отриманих результатів. Виявлені особливості
епідеміології та основні ФР розвитку порушень мозкового кровообігу в м. Києві які покладено в основу розроблення заходів щодо профілактики МІ в регіоні. Проаналізовано якість надання медичної допомоги хворим МІ. Встановлені причини летальних випадків. Вивчено клінічні особливості фатального і нефатального МІ, доведено необхідність ранньої профілактики соматичних ускладнень. На підставі отриманих даних розроблено профілактичні заходи, спрямовані на зниження захворюваності та смертності від МІ, підвищення якості діагностики та лікування хворих з урахуванням його типу. Отримані результати можуть використовуватися у подальших поглиблених наукових дослідженнях.
Особистий внесок здобувача. Дисертаційна робота є самостійним
науковим дослідженням автора. На підставі проведеного патентно-
інформаційного пошуку та вивчення матеріалів літератури автором
визначено актуальність теми роботи, сформульовані мета та завдання дослідження. Особисто проведені епідеміологічні дослідження з детальним аналізом отриманих даних, клініко-неврологічне обстеження хворих, що перебували на стаціонарному лікуванні в лікарні. Аспірант брала участь у проведенні лабораторних, комп’ютерно-томографічних, морфологічних досліджень. Самостійно проведений детальний статистичний аналіз і узагальнення клінічних, інструментальних і лабораторних даних. Написані всі розділи, сформульовано основні висновки і положення роботи, що виносяться на захист, підготовлені до друку наукова статті та тези доповідей на конференціях.
Приймала участь в науково практичних конференціях -500,з них 120 науково пактичні школи з відповідної теми неврології та нейрохірургії та суміжних спеціальностей лвкарів .
Були опубліковані статті з даної теми як в Українських виданнях так і в закордоних ,5 з них в Корейскому виданні при Сеульскому реабітаційному уентрі "Пуасон".
Доповідей та тез було -38, снмінарів-33.,тема присвячена "боротьби з інсультом в сучасному світі."
Вся робота виконувалась на овітньо наукових базах лікарень м. Житомира, м. Києва,м. Ніжина ,інститутів ім.Стажевского ,ім . Інститута нейрохірургії в м. Києва. На базі Київської міської лікарні швидкої допомоги.м. Києва.,та Асоціації борьби з інсультом.
!!!(Апробація результатів дисертації. Основні положення і результати
досліджень обговорені на наукових засіданнях кафедри нейрохірургії Київського державного інститута науково-практичних конференціях неврологів м. Київ (-2020рр.), науково-практичній конференції „Актуальні питання теоретичної та практичної медицини» (Києва, 2020 р.). )
Структура та обсяг роботи. Основний зміст дисертаційної роботи
викладено на 85 сторінках машинопису, складається зі вступу, огляду літератури, 8 розділів особистих досліджень, аналізу та узагальнення отриманих результатів, висновків, практичних рекомендацій, списку літератури, що містить 380джерел (з них 196 – кирилицею, 50 – латиницею), додатка, проілюстровано 4таблицями, та додатків.
ОСНОВНА ЧАСТИНА
РОЗДІЛ І
ОГЛЯД ЛІТЕРАТУРИ
1.1 Епідеміологія мозкового інсульту Судинні захворювання мозку є однією з найбільш важливих медико- соціальних проблем сучасності, що обумовлено їх значною часткою у структурі захворюваності, смертності, інвалідності. Найбільш поширеним та тяжким за своїми наслідками серед судинних захворювань мозку є інсульт [28, 29, 45, 50, 51, 75].
Гострий інсульт — один з основних факторів захворюваності та
смертності в усьому світі (щорічно інсульт виникає у понад 15млн. людей і майже 6 млн. хворих помирають). В Європі показники смертності коливаються від 63,5 до 273,4 на 100 тис. населення. Після серцево судинних та онкологічних захворювань інсульт є третьою найбільш частою причиною смерті в індустріально розвинених країнах. Експерти ВООЗ вважають, що до 2025 р. кількість хворих на інсульт збільшиться на третину. Аналіз динаміки захворюваності на інсульт за останні десятиріччя свідчить про стійку тенденцію до зростання — на 0,5–2 % за рік. У 1975 р. показник захворюваності не перевищував 2,0 на 1000 населення. Протягом останніх 10 років він значно зріс — із 2,2 до 3,5. У більшості країн Європи у 80-х роках минулого сторіччя показник захворюваності на інсульт був близький до 2,0, а вже наприкінці 90-х спостерігали чітку тенденцію до його зростання навіть у соціально розвинених країнах [13, 35, 49, 78, 100,117].
За даними сучасних міжнародних досліджень (STONE, Syst-Eur, NIKS),
у структурі серцево-судинної патології частка інсульту більша за частку інфаркту міокарда приблизно на 30 % — «інсультний парадокс» (G. Howard, 2007). Проаналізовано показники захворюваності та смертності у 39 краї світу. за період 1985–1994 рр. Виявлено суттєве зниження смертності від інсульту за останні десятиріччя ХХ ст., що визнано одним із 10 основних досягнень медицини ХХ ст. [88, 97, 119].
Таким чином, два найважливіших показники, що характеризують
цереброваскулярну патологію — захворюваність і смертність — на сьогодні мають протилежну спрямованість: захворюваність зростає, смертність зменшується [47]. Проте зниження рівня смертності від цереброваскулярнихзахворювань не може свідчити про подолання окресленої проблеми, оскількири цьому збільшується кількість повторних інсультів та інвалідизованих хворих [13, 37]. Зростання поширеності цереброваскулярних захворювань дає підстави вважати проблему боротьби з мозковим інсультом пріоритетним напрямком лікувально-профілактичної роботи медиків усього світу [51]. У 2007 році вперше захворіли на мозкові інсульти 105 513 чоловік, щона 100 тис. населення становить 278,2. У свою чергу, у 35,5 % від усіх випадків мозковий інсульт стався у людей молодого працездатного віку. Порівняно з 2018 роком кількість мозкових катастроф в абсолютних цифрах зменшилася на 1204 випадки, але при розрахунках на 100 тис. населення — зросла на 11,3 [50]. Незважаючи на те що в Україні виконуються програми профілактики та лікування артеріальної гіпертензії, запобігання судинно- мозкових проблем і їх лікування, показники поширеності, захворюваності, інвалідності та смертності є значними серед населення працездатного віку.
Так, питома вага хворих працездатного віку у поширеності хвороб системи кровообігу становить 36,6 %, цереброваскулярних хвороб — 21,5 %. У свою чергу, поширеність останніх в Україні за попередні 10 років зросла на 52,7 %, а захворюваність — на 23,9 %.
Інсульт в осіб молодого віку в клінічній практиці зустрічається досить часто, проте більшість досліджень спрямована на вивчення захворюваності на інсульт у популяції в цілому без вікової орієнтації. Протягом попереднього десятиліття помічено прогресування цереброваскулярних захворювань у людей молодого та середнього віку, які на ранніх стадіях патології у загальній структурі захворюваності [37, 38]. На думкуфахівців, у найближчому майбутньому очікується подальше підвищення рівня первинної захворюваності на інсульт дорослого населення, в тому числі за рахунок його омолодження. Приблизно 33 % від усіх пацієнтів із мозковим інсультом люди молодого віку [19, 23]. Відповідно до останніх досліджень, в Україні 30-денна летальність при мозковому інсульті становить 30–40 %.Протягом першого року помирає близько 50 % пацієнтів і лише 20 % повертаються до активного життя.
Слід зазначити, що інсульт — це поширена причина первинної інвалідності та тимчасової і/або стійкої втрати працездатності. Медико- соціальна експертиза інвалідів, які перенесли мозковий інсульт,являє собою проблему через поширеність даної патології, високий рівень інвалідизації працездатного населення України. Інвалідність після перенесеного інсульту становить 3,2 на 10 тис. населення, займаючи перше місце серед причин первинної інвалідності [48, 61]. За даними закордонних авторів, щорічні фінансові витрати на лікування і реабілітаційні заходи хворих, які перенесли церебральний інсульт, у країнах Західної Європи становить від 55 до 73 млн. доларів США. Непрямі витрати, пов’язані з утратою трудової активності працездатного молодого населення та зменшенням валового національного продукту, взагалі не піддаються підрахунку [35].
Останні десятиліття минулого століття характеризувалися революційними змінами в діагностиці захворювань церебральної судинної патології. Впровадження в медичну практику ультразвукових методівдослідження, комп’ютерної томографії (КТ), магнітно-резонансної томографії (МРТ), ангіографії піднесло діагностику судинних захворювань на якісно новий рівень. Близько 40 % гострих порушень кровообігу з вогнищевими ураженнями мозку не могли бути верифіковані без нейровізуалізації, що, безумовно, покращило діагностику церебральної патології і деякою мірою збільшило статистичний показник захворюваності [88, 101]. Нові функціональні та лабораторні методи досліджень зробили ранню діагностику надбанням клінічної практики, що позначилося не ті на збільшенні захворюваності, а й на зменшенні смертності, оскільки своєчасне лікування поліпшує перебіг захворювання та запобігає виникненню ускладнень. В останні роки змінилася і структура гострих порушень мозкового кровообігу: знизилася частка хворих на крововиливи у мозок, зменшилася кількість фатальних інсультів. У цілому ризик смерті при інсульті зменшився порівняно з 1971 р. на 25 %, при цьому досить важливими в поясненні зниження смертності можна вважати причини, пов’язані з більш ефективною профілактикою та лікуванням [88, 111, 123], огляду на сучасні аспекти проблеми стає зрозумілим, що зараз найільш ефективним методом її вирішення є запобігання виникненню інсульту.
Хоча головна роль у зниженні захворюваності та смертності від гострого порушення мозкового кровообігу належить первинній профілактиці, суттєвий ефект щодо зменшення летальності має саме оптимізація системи допомоги хворим на інсульт, враховуючи заходи щодо реабілітації і вторинну профілактику [9, 12, 38, 50, 80]. Незважаючи на переконливі наукові докази й сформульовану в керівних положеннях тактику, організована допомога все ще далека від повноцінного впровадження ізберігається нерівність у наданні допомоги навіть на місцевому рівні.
Відносна кількість хворих на інсульт, яким допомогу було надано в
інсультних відділеннях, становить 23 % в Австралії, 31 % у Канаді, 50 % у Великобританії, приблизно 80 % у Скандинавських країнах. В Японії інсультні відділення створені менше ніж у 3 % лікарень, які надають невідкладну допомогу [12, 35, 101, 67, 105]. В Україні сучасна стратегія лікування інсульту впроваджується або повільно
[88, 101]. Нові функціональні та лабораторні методи досліджень зробили ранню діагностику надбанням клінічної практики, що позначилося не тільк на збільшенні захворюваності, а й на зменшенні смертності, оскільки своєчасне лікування поліпшує перебіг захворювання та запобігає виникненню ускладнень. В останні роки змінилася і структура гострих порушень мозкового
кровообігу: знизилася частка хворих на крововиливи у мозок, зменшилася кількість фатальних інсультів. У цілому ризик смерті при інсульті зменшився порівняно з 1971 р. на 25 %, при цьому досить важливими в поясненні зниження смертності можна вважати причини, пов’язані з більш ефективною профілактикою та лікуванням [88, 111, 123].
З огляду на сучасні аспекти проблеми стає зрозумілим, що зараз
найбільш ефективним методом її вирішення є запобігання виникненню інсульту. Хоча головна роль у зниженні захворюваності та смертності від гострого порушення мозкового кровообігу належить первинній профілактиці, суттєвий ефект щодо зменшення летальності має саме оптимізація системи допомоги хворим на інсульт, враховуючи заходи щодо реабілітації і вторинну профілактику [9, 12, 38, 50, 80]. Незважаючи на переконливі наукові докази й сформульовану в керівних положеннях тактику, організована допомога все ще далека від повноцінного впровадження і зберігається нерівність у наданні допомоги навіть на місцевому рівні.
Відносна кількість хворих на інсульт, яким допомогу було надано в
інсультних відділеннях, становить 23 % в Австралії, 31 % у Канаді, 50 % у Великобританії, приблизно 80 % у Скандинавських країнах. В Японії інсультні відділення створені менше ніж у 3 % лікарень, які надають невідкладну допомогу [12, 35, 101, 67, 105]. В Україні сучасна стратегія лікування інсульту впроваджується або повільно, або взагалі залишається. застосовується. Не в усіх областях України є адекватно обладнані спеціалізовані відділення для лікування хворих на цереброваскулярні захворювання. Через економічні складності обмежено діагностичну базу і можливість надання кваліфікованої інтенсивної терапії. Тільки 13–15 % хворих на інсульт госпіталізується в межах терапевтичного вікна, частина хворих взагалі не госпіталізується у стаціонари й не отримує адекватної допомоги. Також недостатнім є штат кваліфікованих фахівців (неврологів, нейрохірургів, анестезіологів), які здатні надавати відповідну допомогу хворим на інсульт [9, 12, 37, 38, 50].
Для зміни епідеміологічної ситуації щодо цереброваскулярних хвороб у позитивний бік в Україні 31 травня 2016 р. була затверджена Державна програма запобігання та лікування серцево-судинних і судинно-мозкових захворювань на 2016–2020рр. Метою програми є запобігання та зниження рівня захворюваності на серцево-судинні та судинно-мозкові хвороби, зниження інвалідності та смертності від їх ускладнень, а також збільшення
тривалості й підвищення якості життя населення (Про затвердження Державної програми запобігання та лікування серцево-судинних і судинно-мозкових захворювань на 2019–2020 рр.: Постанова Кабінету Міністрів України № 761 від 31.15.2016 р.).
1.2 Фактори ризику виникнення церебрального інсульту серед осіб
молодого віку Особливу увагу приділяють вивченню факторів ризику цереброваскулярних захворювань. При цьому концепція факторів ризику базується на математично верифікованих зв’язках між захворюваннями, синдромами, умовами життя, діяльності людини і чинником розвитку інсульту. Продемонстрований тісний зв’язок між церебральною і кардіальною патологією, що виникає внаслідок таких серцево-судинних захворювань, як артеріальна гіпертензія. В останні роки відзначено омолодження контингенту пацієнтів з цереброваскулярною патологією, втому числі з геморагічним інсультом, що призводить до суттєвих соціально економічних наслідків. Через це вивчають роль віку у системі патогенетичних факторів ризику інсульту [70, 74, 76]. Слід підкреслити, що в осіб молодого віку порівняно з більш старшою віковою групою у структурі мозкових інсультів значна частина належить порушенню мозкового кровообігу за геморагічним типом [21, 70]. Відзначено, що у пацієнтів віком 20–45 років геморагічний інсульт виявляється в 42,7 % випадків, тоді як пацієнтів старшої вікової групи цей показник дорівнює 15,7 % [112].
Відповідно до Міжнародної класифікації судинних уражень головного й спинного мозку 10-го перегляду, гостре порушення мозкового кровообігу за геморагічним типом включає субарахноїдальний та внутрішньомозковий крововиливи. При цьому геморагічний інсульт розвивається за двома патогенетичними механізмами: розрив судинної стінки та діапедез. За даними різних авторів, частота субарахноїдальних крововиливів (САК) становить від 12–19 до 29–32 випадків на 100 тис. населення у рік. 53–60 % усіх спонтанних церебральних крововиливів припадає на частку артеріальних аневризм судин основи мозку. Важливість цієї патології відзначається небезпекою для життя хворого внаслідок раптових розривів аневризм [39, 45]. Незважаючи на сучасні технології лікування, наслідки захворювання залишаються незадовільними, тому що гинуть близько 25 % хворих, при цьому 12 % — до надання їм спеціалізованої допомоги, а з усієї кількості тих,
хто вижив, приблизно 50 % залишаються глибокими інвалідами. Повторний розрив артеріальної аневризми є одним із найчастіших ускладнень, що призводять до збільшення частоти інвалідизації на 82 %, летальних кінців — на 60 % [17]. Крововиливи ускладнюються наступним ангіоспазмом і, як наслідок, ішемією та набряком мозку, що робить стан хворого більш тяжким.
Якщо ці процеси стають необоротними, виникає стійкий неврологічний дефіцит, що різко погіршує прогноз та результати лікування. Відомо, що близько 60 % хворих помирає на 3-тю — 5-ту добу після крововиливу через наростаючий ангіоспазм. При повторних кровотечах з артеріальних аневризм, що спостерігаються частіше на 8-му — 14-ту і 20–25-ту добу,
виникають у хворих, можуть спричинювати розвиток як ішемічних, так і геморагічних цереброваскулярних захворювань [76]. Крім того,сучасна епідеміологічна обстановка характеризується збільшенням захворюваності на сифіліс, почастішали випадки менінговаскулярного сифілісу, при якому у 35 % пацієнтів розвиваються гострі порушення мозкового кровообігу. При цьому запальні й продуктивні зміни стінок судин мозку ведуть до облітерації просвіту, розвитку ділянок ішемії або формування аневризм, розривів судин і крововиливів у тканину мозку [34].
В останні роки серед осіб молодого віку збільшилося число тих, хто
вживає наркотики. У результаті однією з провідних причин розвитку
внутрішньомозкових гематом у цій віковій категорії став прийом таких препаратів, як амфетамін, кокаїн, екстезі. Раніше вважали, що розвиток геморагії у цих випадках обумовлений виникненням вираженої гіпертензії.
Однак обстеження таких пацієнтів з використанням ангіографії показало розвиток у них судинних мальформацій у вигляді артеріальних аневризм та артеріовенозних мальформацій [110]. У зв’язку з цим при обстеженні пацієнтів молодого віку з геморагічним інсультом поряд із проведенням ангіографії необхідний токсикологічний скринінг сироватки крові й сечі [75].
Відомо, що діапедезні геморагії найбільш часто розвиваються при
первинному ураженні судинної стінки і артеріальній гіпертензії.
Функціонування ендотелію судин багато в чому визначається станом ліпідного обміну. Виявлено, що ризик розвитку внутрішньомозкової гематоми (ВМГ) асоційований з низьким рівнем холестерину в сироватці крові, зниженим споживанням насичених жирів і тваринного білка, зловживанням алкоголем [94]. Проникність судинної стінки може бути порушена й при інших обмінних розладах. Так, наприклад, амілоїдна ангіопатія може супроводжуватися розвитком ВМГ [94]. Варто підкреслити, що сучасні методи нейровізуалізації (КТ і МРТ головного мозку) не дозволяють диференціювати гематому, асоційовану з амілоїдною ангіопатією, і гематому, пов’язану з вираженою гіпертензією. Остаточні ендокринні, що часто розвиваються у жінок із гормонозалежними захворюваннями репродуктивної системи [6]. Відзначено підвищення артеріального тиску при тривалому прийомі гормональних контрацептивів або лікуванні эстроген-гестагенними препаратами. Показано, що вагітність і пологи можуть бути вірогідними факторами ризику розвитку всіх форм гострого порушення мозкового кровообігу. Доведено, що в регуляції
діяльності серцево-судинної системи, в тому числі контролі артеріального тиску, важлива роль належить гормону епіфіза мелатоніну. При інтраназальному введенні мелатоніну у дозі 2 мг/добу протягом 7 днів відзначалося зниження рівня діастолічного артеріального тиску у хворих на гіпертонічну хворобу в середньому на 30 мм рт.ст. При призначенні здоровим жінкам репродуктивного віку 1 мг мелатоніну також виявлене зниження показників артеріального тиску за рахунок пригнічення активності норадреналіну. Напевно, порушення обміну мелатоніну в молодих жінок можуть спричинювати розвиток артеріальної гіпертензії [56]. Ряд науковців вважають, що найбільш виражені нейроендокринні порушення відбуваються у жінок у післяпологовому періоді, що в ряді випадків може сприяти розвитку інсульту. У таких пацієнток внутрішньомозкові гематоми спостерігалися в 25 % усіх випадків гострого порушення мозкового кровообігу. При цьому визначена асоціація післяпологового інсульту з гіпертензією під час вагітності і акушерським проведенням кесарського розтину [121]. Крім того, про порушення в нейроендокринній системі при геморагічному інсульті свідчить різке зниження рівня тиреотропного гормону в плазмі крові хворих [113].
Деякі науковці особливу увагу приділяють цукровому діабету як
фактору ризику геморагічного інсульту. При обстеженні у Фінляндії 5166 пацієнтів із цукровим діабетом віком не старше 50 років, у яких дебют хвороби спостерігався до 18 років, встановлений високий ризик субарахноїдального і внутрішньомозкового крововиливів, а також підвищення в 6 разів можливості розвитку ішемічного інсульту [103].
Із літературних джерел відомо, що судинні захворювання головного
мозку належать до мультифакторної патології, обумовленої взаємодією зовнішніх і внутрішніх факторів: генетичних, метаболічних. У зв’язку з цим при цереброваскулярних захворюваннях в осіб молодого віку проводять оцінку генетичної схильності до даної патології, а також досліджують асоціацію гострого порушення мозкового кровообігу із певними генами- кандидатами. До останніх зараховують гени, білкові продукти яких можуть прямо або опосередковано брати участь у розвитку інсульту. Крім того, особливу увагу приділяють генам, які кодують компоненти систем, що регулюють гемостаз, ліпідний обмін, тонус судин [126]. В останні роки інтенсивно вивчають поліморфізм, тобто генетичну мінливість локусу (ділянки локалізації гену) у певних популяціях. Важливе значення надають дослідженню генетичних маркерів гіпертонічної хвороби. Показано роль поліморфізму гену синтази оксиду азоту, ендотеліального фактора релаксації, гену ангіотензинперетворюючого ферменту в розвитку артеріальної гіпертензії [118]. Доведено, що поліморфізм гену, що кодує інгібітор активатора плазміногену 5G/5G, корелює з високим рівнем активатора плазміногену в крові, супроводжується активацією фібринолітичної системи й схильністю до геморагічного інсульту.
Враховуючи те, що фактор XIII стабілізує резистентність фібрину до
фібринолізу, встановлено, що поліморфізм гену фактора XIII призводить до валін-лейцин-амінокислотного заміщення в положенні 134 амінокислотної послідовності й асоціюється з підвищеною частотою первинного внутрішньомозкового крововиливу. Так, у жінок молодого віку (до 45 років) варіанти XIII фактора згортання з фенілаланіном у позиції 204 і лейцином у положенні 564 супроводжуються схильністю до геморагічного інсульту. При сполученні поліморфізму гену фактора XIII і генотипу інгібітору активатора плазміногену 5G/5G ризик геморагії збільшується в 20 разів [76]. Показано роль поліморфізму гену a1-антихімо-трипсину в розвитку гострого порушення мозкового кровообігу за геморагічним типом.
На сьогодні генетика також є чиником дослідники виявили ген сімейної форми хвороби моя-моя був картований на хромосомі 17q25.
Виявилося, що дебют хвороби моя-моя в 76 % випадків спостерігається до 20 років. Описані 2 вікових піки початку цього захворювання: до 15 років і від 31 до 40 років. При цьому захворюванні співвідношення осіб жіночої й чоловічої статі становить 1 : 59. Хвороба моя-моя зазвичай проявляється в дітей ішемічним інсультом, у дорослих — геморагічним інсультом. Рання
діагностика цього захворювання необхідна для правильного вибору
лікувальної тактики з метою попередження повторних крововиливів або інфарктів мозку [75].
Цереброваскулярна патологія зустрічається в 18 % випадків однією з форм первинного гіперальдостеронізму — глюкокортикоїдпригнічуючого гіперальдостеронізму (ГПГА). Це спадкове захворювання з аутосомно-домінантним типом передачі, при якому єдиним регулятором секреції альдостерону є адренокортикотропний гормон. У хворих на ГПГА цереброваскулярна патологія в 70 % випадків проявляється геморагічним інсультом. При обстеженні 376 пацієнтів з 27 родин із молекулярно-генетично встановленим діагнозом ГПГА виявлена більша частота розривів артеріальних аневризм, асоційована з високою летальністю. Середній вік, при якому розвивався геморагічний інсульт, становив 31,7 року [108].
До паренхіматозних та субарахноїдальних крововиливів може
призводити спадкова еластична псевдоксантома, що передається аутосомно-домінантно й аутосомно-рецесивно, ген локалізується на хромосомі 16р13.
При цьому виявляються дегенерація й розриви еластичних волокон у середній оболонці судинної стінки з наступним відкладенням мікрокальцифікатів. Показано, що патоморфологічною основою
цереброваскулярних порушень при даному захворюванні є інтракраніальні аневризми мозкових судин та оклюзія екстра- й інтракраніальних артерій. Характерною рисою ураження судин при еластичній псевдоксантомі вважають розвиток аневризм і стенозів судин мозку у того самого пацієнта.
Можна вважаюти наявність потенційного джерела емболії та відсутність клінічних ознак стенозуючого ураження артерій голови. Ключовим методом виявлення потенційного джерела кардіогенної емболії є ехокардіографія, що широко використовується при обстеженні пацієнтів з емболічним інсультом для виявлення прихованих кардіальних джерел емболії без явного захворювання
серця й для анатомічної верифікації джерел емболії в осіб зі встановленим захворюванням серця [20]. В останні роки все більший інтерес дослідників викликає проблема парадоксальної емболії як причини ішемічного інсульту.
У цілому парадоксальна емболія розглядається як одне з джерел кардіогенної емболії поряд з патологією клапанів і камер серця. Частота кардіоемболічного інсульту становить близько 20–30 % серед ішемічних порушень мозкового кровообігу, а у хворих молодого віку може досягати 40 %, що підкреслює значимість ідентифікації конкретної причини розвитку мозкової катастрофи з метою вторинної профілактики [70, 89].
Особливу увагу привертає до себе відкрите овальне вікно (ВОВ) як
основний шлях реалізації парадоксальної емболії. За даними різних
дослідників, ВОВ виявляють у 27–35 % населення в усіх вікових групах. При цьому в осіб віком до 55 років із криптогенним інсультом відкрите овальне вікно виявлене в 46–47 % випадків. Більш висока поширеність цієї вади серця визначена в родинах молодих пацієнтів із указаним типом інсульту [32, 53]. Серед хворих на криптогенний інсульт віком до 55 років ВОВ зустрічається в 46 % випадків; частота криптогенного інсульту досить висока і становить у середньому 31 % від загального числа всіх ішемічних інсультів
[20]. Доведено, що відкрите овальне вікно являє собою клапанне сполучення між передсердями, що забезпечує в ембріональному періоді проходження артеріальної крові в ліве передсердя з правого, минаючи нефункціонуючі судини легенів. Даний механізм забезпечує постачання ембріона киснем, передчасне внутрішньоутробне закриття овального вікна призводить до загибелі плода. У більшості людей після народження овальне вікно
закривається на першому-другому році життя [87], однак у 27–30 % осі овального вікна пов’язане з нормальним процесом ембріогенезу
міжпередсердної перегородки [70, 92]. Рядом авторів наявність відкритого овального вікна розцінюється не як патологія, а як варіант нормальної будови серця, однак за певних умов (кашель, фізичне навантаження) тиск у правому передсерді збільшується і виникає так званий право-лівий шунт, що відіграє важливу роль у виникненні парадоксальної емболії [98]. Крім відкритого овального отвору, шляхами руху емболу можуть бути справжні дефекти міжпередсердної перегородки, внутрішньолегеневі шунти й у дуже рідких випадках — дефекти міжшлуночкової перегородки. Джерелом емболів при парадоксальній емболії найчастіше є система нижньої порожнистої вени: переважно вени нижніх кінцівок, а також малого таза, що є більш характерним для жінок.
Одну з перших задокументованих вказівок на можливість парадоксальної емболії можна віднести до 1877 року, коли J. Cohenheim при розтині молодої жінки, яка померла від інсульту, виявив відкрите овальне вікно і зробив припущення про проникнення через нього тромбів із венозної системи в церебральні артерії. Численні наступні дослідження переконливо продемонстрували тісний взаємозв’язок ВОВ із криптогенним інсультом. P. Lechat і співавт. у 1988 році виявили значну перевагу відкритого овального вікна у пацієнтів, які перенесли інсульт, порівняно зі здоровими особами. Також відзначена більш часта ідентифікація ВОВ в осіб, що перенесли криптогенний інсульт, ніж у пацієнтів зі встановленою причиною інсульту [91]. У більшості спостережень криптогенного інсульту, асоційованого з ВОВ, відсутні переконливі дані, що свідчать на користь наявності і проникнення тромбу з венозної системи в артеріальну різні тромбофільні стани [61, 79]. Однак при всьому достатку даних існує дуже незначна кількість наукових робіт, присвячених дослідженню системи гемостазу при відкритому овальному вікні й оцінці ризику інсульту при комбінації ВОВ із різними порушеннями гемостазу. У літературі зустрічаються поодинокі повідомлення про випадки ішемічного інсульту у молодих осіб при сполученні відкритого овального вікна з деякими гіперкоагуляційними станами. Існують спостереження, що повідомляють про52-літнього чоловіка, який переніс ішемічний інсульт. У нього не виявлено будь-яких змін магістральних артерій голови, ембологенних джерел і тромбі у лівих камерах серця. При проведенні черезстравохідної ехокардіографії виявлене ВОВ, а при дослідженні системи гемостазу — гетерозиготну мутацію фактора Лейдена. Разом із тим не отримано переконливих доказів,
що саме сполучення цих факторів відіграло вирішальну роль у розвитку ішемічного інсульту у даного пацієнта [81]. При вивченні взаємозв’язку тромбофілітичних станів і відкритого овального вікна отримані суперечливі результати. Так, F. Carod і співавт. обстежили пацієнток із ішемічним інсультом у віці від 15 до 45 років. Усім виконані томографічні дослідження речовини мозку, магістральних артерій голови, транскраніальну доплерографію з контрастуванням і емболодетекцією, а також дослідження системи гемостазу. Вивчено рівні гомоцистеїну, антитромбіну III, протеїнів С и S, наявність вовчакового антикоагулянту, антитіл до кардіоліпіну, антинуклеарних антитіл, мутації фактора Лейдена та метилтетрагідрофолатредуктази. Було показано, що частота поширеності різних тромбофілій у пацієнтів з відкритим овальним вікном і без нього істотно не розрізнялася [81]. Деякі науковці, а саме S. Sastry і співавт., V. Karttunen і співавт., досліджували різні тромбофілітичні стани залежно від наявності відкритого овального вікна. У результаті встановлено, що мутації фактора Лейдена й протромбіну частіше зустрічалися у пацієнтів з ВОВ, ніж без нього. Механізмом усіх інсультів, на думку авторів, була парадоксальна
Встановлено, що іншими неврологічними захворюваннями, у
патогенезі яких відіграє роль відкрите овальне вікно, є мігрень, минущ глобальна амнезія. Відкрите овальне вікно діагностувалося у половини хворих на мігрень, що супроводжувалося аурою, причому після закриття ВОВ напади мігрені зникають [20]. Із більш широким впровадженням імунологічних досліджень у клінічну медицину істотно розширилося уявлення про значимість імунопатологічних процесів у патогенезі цереброваскулярних порушень, в тому числі про роль антифосфоліпідних антитіл в розвитку антифосфоліпідасоційованої церебральної васкулопатії,
що є причиною переважно ішемічних порушень мозкового кровообігу. Останнім часом результати декількох незалежних рандомізованих контрольованих клінічних досліджень показали, що прийом оральних контрацептивів, особливо у поєднанні з палінням, є чинником ризику розвитку ішемічного інсульту у жінок молодого віку. Так, застосовувана за терапевтичними показниками лікарів-гінекологів замісна терапія комбінованими гормональними препаратами, що містили естрогени й прогестерон, підвищувала ризик розвитку інсульту в здорових жінок, зокрема, у постменопаузі. На сьогодні відомо, що естроген має як позитивний, так і негативний вплив на серцево-судинну систему [124]. З одного боку, він потенційно впливає на ліпіди: знижує рівень ліпопротеїнів
низької щільності, збільшує рівень ліпопротеїнів високої щільності, вправляє вазодилатуючу дію за допомогою оксиду азоту і запобігає
атеросклеротичному ураженню судин. З іншого боку, естрогени підвищують рівень тригліцеридів і С-реактивного білка. Крім цього, естроген має чимало протромботичних ефектів: збільшує рівень протромбіну і зменшує рівень антитромбіну III, що сприяє підвищенню ризику венозних тромбоембол[70, 75]. Встановлено, що естрогени, подібно до серцевих глікозидів, справляють стимулюючу дію на міокард, викликають гіперволемію, підвищення ударного і хвилинного об’єму серця. Збільшення об’єму циркулюючої крові обумовлено збільшенням продукції альдостерону, підвищенням реабсорбції натрію в ниркових канальцях і зростанням осмотичного тиску плазми крові. Гіперволемія та активація ренінангіотензинової системи сприяють розвитку артеріальної гіпертензії.
У повідомленнях про молодих пацієнток, які тривалий час приймали
оральні контрацептиви з високим вмістом естрогенів, відзначався
підвищений ризик інсультів у даного контингенту. Зменшення вмісту
естрогенів надалі супроводжувалося частковим зниженням ризику інсульту.
Особливо високий ризик інсульту спостерігається у жінок старших за 35 років, які приймали оральні контрацептиви і зловживали палінням. Це пов’язують із підвищенням згортання крові в результаті стимуляції естрогенами синтезу факторів згортання в печінці та впливом на інтрацеребральні судини [85, 86]. Результати Британського перспективного дослідження показали, що серед тих, хто користується оральними контрацептивними засобами, трохи частіше зустрічаються тромбози глибоких і поверхневих вен, емболія легеневої артерії, захворювання коронарних артерій і порушення мозкового кровообігу. У дослідженні, проведеному в США, було підтверджено підвищення в 10 разів ризику субарахноїдальних крововиливів і підкреслена роль паління й віку в розвитку серцево-судинних захворювань. Встановлено, що у жінок, які палять і користуються комбінованими оральними контрацептивами, ризик геморагічного інсульту збільшується до 25 %, в осіб із мігренеподібними головними болями ризик тромботичного інсульту зростає до 35 %. [122].
Крім того, доведено, що прийом контрацептивних гормональних препаратів впродовж тривалого часу сприяє виникненню первинного антифосфоліпідного синдрому у жінок і дітей, народжених від матерів з антифосфоліпідним синдромом, викликаючи негативні наслідки.
На цей момент незважаючи на впровадження сучасних діагностичних методик, не можливо зменшувати роль патологоанатомічного дослідження.
Аутопсія – це посмертна верифікація діагнозу у випадку фатального виходу, особливо в тих випадках, коли смерть настає в перші години захворювання. Також аутопсія дозволяє впевнено діагностувати ускладнення інсульту, в тому числі і соматичні [13-15].
Вивчення клініки та морфологічної картини змін головного мозку в
гострому періоді інсульту мають надати можливість виявити деякі характерні особливості клінічної структури й перебігу гострого пері оду захворювання, з’ясувати фактори, які визначають летальний наслідок, скорегувати лікувальну тактику і направити ії на лікування ускладнень.
Перенесений мозковий інсульт підвищує вірогідність розвитку когнітивного дефіциту в 4-12 разів. Виражена деменція розвивається у 25-30% пацієнтів, які перенесли інсульт, та призводить до значного зниження якості життя, а також підвищує смертність та витрати на догляд за хворими [1,46].
Когнітивні функції формуються в результаті інтегрованої діяльності різних відділів головного мозку. Згідно з концепцією А.Р.Лурія [41] кожний відділ головного мозку вносить свій специфічний вклад у формування когнітивних функцій. Гіпокамп, мамілярні тіла, медіальні ядра таламуса та пов’язані з ними структури (круг Пейпеца) відповідають за підтримку необхідного рівня уваги та запам’ятовування нової інформації. Задні відділи кори (тім’яні, скроневі та потиличні частки) забезпечують сприйняття, обробку,
розпізнавання та збереження інформації. Роль лобної частки - вибір цілі діяльності, розробка програми для досягнення поставленої мети та контроль за виконанням програми (так звані “керівні функції”).
у. Вірогідність розвитку післяінсультної деменції та її тяжкість напряму залежить від характеристики самого інсульту.
Мають значення: кількість та об’єм вогнища ураження мозкової тканини, наявність церебральної атрофії, особливо в медіальних відділах скроневої частки; наявність дифузних змін білої речовини півкуль мозку (лейкоареоз). Всі вищеперераховані чинники призводять до порушення гемореологічних властивостей крові та церебральної гемодинаміки, які, У свою чергу, стають причинами ГПМК. Структурні зміни сірої та білої речовини нервової тканини є патоморфологічним субстратом феномена кірково-підкіркової дисоціації та порушення нейротрансмісії в ЦНС. Ішемічна загибель нейронів збільшується природними, асоційованими з віком, процесами нейродегенерації, які були до цереброваскулярної катастрофи, що і визначає рівень когнітивних розладів та тяжкість деменції після виникнення ГПМК.
РОЗДІЛ ІІ
ЕПІДЕМІОЛОГІЯ ГОСТРИХ ПОРУШЕНЬ МОЗКОВОГО
КРОВООБІГУ В м.Києва.
У 2020 році,на сьгоднішній день в нашій країні офіційно зареєстровано близько 5 мільйонів хворих з різними формами неврологічних захворювань. Перше місце серед цієї групи посідають цереброваскулярні хвороби. У 2009 згідно з офіційною статистикою МОЗ України поширеність ЦВЗ серед дорослого населення становила 8432,9 на 100 000 населення. В Сумській області цей показник становив 9979,0 на 100 000 населення.
Співвідношення геморагічного та ішемічного інсультів складає в
середньому 1 : 4, але в деяких західних областях – 1 : 5, в східних 1:3.
Смертність в останні 5 років стабілізувалася та має тенденцію до незначного зниження. У 2009 році смертність в Україні від ЦВЗ становила 281,6 на 100 000 населення. Смертність від ІІ становила 45,2 на 100 000 населення а від ГІ – 28,9 на 100 000 населення, внаслідок САК – 2,8 на 100 000 населення. Загальний обласний показник смертності від ЦВХ в 2019 році тановив 589,7 , в 2020 р. 666,9, в 2020– 358,4 на 100 000 населення, та також мав тенденцію до зниження. Показник смертності від МІ по м. Києві відповідні роки становив 41,8; 31,9; 32,8 на 100 000 населення.
Серед працездатних осіб від ЦВЗ померло загалом по області в 2018р. – 51,4, в 2019р. - 64,3, в 2020р. 42,3 на 100 000 населення; по місту Києва відповідно 36,9; 19,2; 117,6 на 100 000 населення. Від МІ серед працездатного населення в області померло від ЦВЗ в 2018 р. – 24,1, 2019 р. – 27,3, в 2020 р. – 35,0 на 100 000 населення, по обласному центру відповідно 37,1; 26,4; 12,3 на 100 000 населення.
На жаль офіційних даних по області щодо типів інсульту немає чіткої градації хворих за віком. Реєтруються певна різниця в захворюваності на МІ в східних та західних регіонах країни.
найбільш високі показники захворюваності на МІ в Луганській та Донецькій областях і в 2 рази нижчі в Закарпатській, Львівській та Івано-Франківській. Це обумовлює актуальність вивчення цієї проблеми на рівні окремих регіонів країни.Слід додати, що проблема МІ це не тільки медична, а й соціальна. За минулий рік інвалідами внаслідок цереброваскулярних захворювань області визнано 351 особу, серед них у працездатному віці 210хворих, що 5склало 51%. Таблиця 2.15.Летальність від МІ в м. Києва.
Вік,
роки
2019 р. 2020 р.
Все населення 31,8±1,8** 26,2±1,7
20 – 59 років 34,2±2,8** 24,9±3,0
60 років і старші 30,7±3,7* 26,9±2,1
Примітка: *р>0,05, **р<0,05, * - різниця показників в 2019– 20120рр.
Проведено аналіз ймовірного впливу на вихід інсульту термінів
госпіталізації з урахуванням 6-годинного інтервалу з моменту початку захворювання (за даними організаційно-методичного відділу станції ШМД).
З’ясовано, що в 2019 р. протягом 6 годин з моменту початку захворювання стаціонарну допомогу отримали 230 (39,6±2,3%) хворих, з них померло 57 (31,5±3,5%). У 2020році в стаціонари протягом 6 годин госпіталізовано 2019 (56,8±2,3%) пацієнтів, з них померло 70 (32,3±3,2%). Після 6 годин з момент ,появи ознак захворювання в 200р. госпіталізовано 241 (56,8±2,4%) хворих, з яких 39 (16,2±2,4%) померло. У 2010 р. відповідно 245 (53,0±2,3%) і 31 (12,7±2,1%) осіб. Аналіз цих даних демонструє, що летальність серед пацієнтів, госпіталізованих протягом так званого «терапевтичного вікна» була вищою, ніж серед госпіталізованих пізніше вказаного терміну .
Що стосується надання медичної допомоги хворим обласного центру, то є цікавим, що протягом останнього десятиріччя зберігається тенденція до високого відсотку хворих на МІ, госпіталізованих в профільний стаціонар міста – відділення судинної патології нервової системи з палатам інтенсивної терапії на базі КЗ «4-та міська клінічна лікарня», незважаючи на тяжкість стану та вік пацієнтів (згідно наказу МОЗ України №297 від 30.07.02 р.).
Таблиця 2.2
Розподіл хворих з ЦВЗ в профільному стаціонарі
2018 рік 20019рік 2020рік
Всього 1186 1103 1101
Гостра судинна
патологія
1038 (87,2%) 906 (82,1%) 960 (87,2%)
МІ 496 (41,5±1,4%) 367 (33,3±1,4%) 473 (43,0±1,5%)
20-59 років 167 (33,6±2,1%) 124 (33,8±2,5%) 139 (29,4±2,1%)
60 років і старші 329 (66,4±2,1%) 243 (66,2±2,5%) 334 (70,6±2,1%)
Ішемічний інсульт 338 (68,5±2,1%) 325 (88,5±1,7%) 391 (82,6±1,7%)
Геморагічний інсульт 158 (31,5±2,1%) 42 (11,5±1,7%) 82 (17,4±1,7%)
Транзиторний ішемічний напад
89 (7,4%) 74 (6,7%) 112 (10,2%)
Як видно з таблиці, превалюючою у відділенні (92,2%) залишається
гостра церебральна патологія (82,1% у 2019р. та 87,2% у 2020р.). Показник госпіталізації хворих на інсульт в термін до 6 годин від початку захворювання зріс у порівнянні з двома попередніми роками (2,9% - 2019 році, 2,5% - у 2019 році та 10,9% у 2020 році). Високий рівень екстренної медичної допомоги пояснюється роботою спеціалізованих бригад ШМД
Мозкові інсульти становлять 43,0% всієї патології відділення у 2010 році. Частка ІМ становить 82,6%, ГІ – 17,4%, ТІН – 10,2% всієї патології відділення. У 2010 році дещо знизилася (29,4%) кількість інсультів у віці 20-59 років (33,8% у 2009 р. та 33,6% у 2008 р.). Співвідношення між геморагічним та ішемічним інсультами становило 1:5. Слід додати, що різниця між показниками не була вірогідно значущої. Як видно з таблиці 3.
Майже половину всіх госпіталізованих пацієнтів становили пацієнти у віці 20 – 59 років, тобто особи молодого і зрілого віку (р<0,05).
Всього за останній рік у стаціонарі померло 86 хворих , що є вищим за показники минулих років (71 померлих у 2009 р. та 100 померлих у 2008 р.). Тобто стаціонарна летальність склала у 2008 р. – 8,5%, у 2009 р. – 6.5%, у 2010 р. – 7,8%. Та майже третина всіх померлих – це особи молодого та зрілого віку.
Таблиця 2.3
Структура летальності від ГПМК у судинному відділенні
2008 р. 2009 р. 2010 р.
Померло всього від інсультів 100 71 86 чоловіків 63 (63,0±4,8%) 39 (54,9±5,9%) 48 (55,8±5,34%) , жінок 37 (37,0±4,8%) 32 (45,1±5,9%) 38 (44,1±5,34%) .
Геморагічний інсульт 53 (53±5,0%) 29 (40,8±5,8%) 37 (43,0±5,3%)
Інфаркт мозку 47 (47±5,0%) 42 (59,0±5,8%) 49 (57,0±5,3%)
20-59 років 35 (34,3±4,7%) 17 (23,9±5,1%) 34 (39,5±4,0%)
60 років і старші 65 (65,7±4,7%) 54(76,1±5,1%) 52 (60,4±4,0%)
За останній рік дещо збільшилася питома вага пізньої госпіталізації
(госпіталізації пізніше 3 годин від початку МІ). У 2009 р. пізню госпіталізацію мали 40,3% хворих, у 2010 р. – 43,8% хворих. Цей показник необхідно контролювати в зв’язку з перспективою впровадження в найближчі роки тромболітичної терапії з метою лікування ішемічних порушень мозкового кровообігу.
РОЗДІЛ ІІІ
МАТЕРІАЛ І МЕТОДИ ДОСЛІДЖЕННЯ
Для вирішення поставлених задач в роботі використані клініко неврологічний, нейровізуалізаційний (КТ головного мозку), лабораторний, патоморфологічний та статистичний методи. Стан надання медично допомоги вивчено шляхом аналізу медичної документації: звітів обласного позаштатного спеціаліста, головного невролога міського УОЗ, матеріалиМСЕК. Діагноз МІ базувався на стандартних критеріях, рекомендованих.
Всесвітньою організацією охорони здоров’я. До МІ відносили епізоди вогнищевого або дифузного порушення функцій головного мозку цереброваскулярного походження, які спостерігалися не менше 24 годин або призводили до летального випадку протягом 24 годин. Діагноз МІ ставився на підставі деталізованого вивчення анамнезу, даних дослідження соматичного та неврологічного статусів, результатів параклінічних методів протягом 28 діб від початку захворювання. За пропозицією ВООЗ гострим періодом інсульту вважали 28 діб від появи ознак ГПМК [7]. Класифікували
МІ залежно від типу: інфаркт мозку (ІМ), геморагічний інсульт (ГІ), неуточнений інсульт. Можливі ФР розвитку мозкової катастрофи в осіб молодого та зрілого віку досліджували суцільним методом у хворих, що перебували на стаціонарному лікуванні в неврологічному відділенні для хворих з судинною патологією в 2010 р. З 139 хворих у гострому періоді МІ були 65 (47,0%) чоловіків та 74 (53,0%) жінки. Хворим цієї групи було проведено максимально можливе комплексне клініко-неврологічне обстеження з подальшим детальним аналізом медичної документації (історій хвороби, амбулаторних карт, протоколів комп'ютерної томографії головного мозку, патологоанатомічного розтину).
Програма обстеження цієї групи включала визначення наступних показників: 1) стать; 2) вік; 3) АГ (АТ 140/90 мм рт. ст. і більше, або нормальний АТ на тлі вживання гіпотензивних препаратів) [17,23]; 4) наявність кардіальної патології – фібриляції передсердь, ІХС, перенесеного інфаркту міокарда, стенозу мітрального клапану 5) раніше перенесені ТІН; 6) наявність цукрового діабету; 7) гіперхолестеринемія (якщо рівень загального холестерину сироватки був вищий 5,2 ммоль/л, згідно з рекомендаціями
Американської національної програми по холестерину - NCEP) [10]; 8)
психоемоційне перенапруження визначали у випадку наявності психічних травм протягом місяця до виникнення судинної катастрофи і хронічного емоційного напруження в родині або за місцем роботи; 9) родинний анамнез вважали обтяжливим, якщо у родичів першої лінії (як з боку матері так і батька) є дані про наявність у них АГ, інфаркту міокарда та МІ [17]; 10) тютюнопаління (протягом 2-х останніх років до розвитку МІ) [14]; 11) зловживання алкоголем вважали таким, якщо хворий систематично вживав
лікеро-горілчані напої. Серед них було 34 померлих протягом 28 діб з моменту початку захворювання (група фатального ішемічного та геморагічного інсультів) і215 хворих з успішним кінцем гострого періоду ішемічного та геморагічного процесів. Групи були порівняні за основними параметрами – віком, статтю, ФР, супутньою патологією. Комплексне клініко-неврологічне обстеження проводили з використанням традиційних тестів, застосуванням шкали ком Глазго, Скандинавської шкали інсультів, критеріїв, рекомендованих А.М. Коноваловим. Стан вітальних функцій контролювався шляхом їх моніторування з обов'язковою консультацією терапевта, за наявності показань – кардіолога, нейрохірурга, судинного хірурга, логопеда, психотерапевта. Досліджувалося очне дно, за показаннями проводилася люмбальна пункція. Загальноклінічні та біохімічні лабораторні дослідження додаткові методи досліджень .
Структурні зміни головного мозку вивчали за допомогою
мультислайдового комп'ютерного томографа SOMATOM Emotion 6 фірми Siemens і Synerview 600 S фірми Picker International. Оцінювали густину речовини головного мозку, розміри, локалізацію патологічного вогнища.
Визначали зсув серединних структур, зміни шлуночкової системи, наявність атрофічного процесу, характеру зовнішньої і внутрішньої гідроцефалії. Для визначення обсягу вогнищевих змін використовували геометричну формулу
еліпсоїда: π × A × B × C 3 4, де A,B,C – ½ діаметрів еліпсоїда. (1)
При фатальному інсульті морфологічна верифікація проводилася
стандартним методом (Колтовер А.Н. і співавт., 1975). Морфологічна
верифікація ГПМК проводилася на базі Сумського обласного
патологоанатомічного бюро. Стан головного мозку вивчалистандартизованим методом на фронтальних блоках, що дозволяє більш точніше визначити локалізацію вогнищевих змін по відношенню до всіх анатомічних утворів. Характеристика використаних психологічних методик наведена у відповідному розділі.
Результати дослідження оброблені методами математичної статистики з використанням пакета «Microsoft Excel’07» з обчисленням відсотків їхніх помилок, довірчого інтервалу. Вірогідність розходження визначали за допомогою критерію Ст’юдента.
РОЗДІЛ IV
ФАКТОРИ РИЗИКУ МОЗКОВОГО ІНСУЛЬТУ
В ОСІБ МОЛОДОГО ТА ЗРІЛОГО ВІКУ
З цією метою ми проаналізували наявність у цієї категорії пацієнтів
відомих факторів ризику. Для вирішення поставленої задачі ми здійснили аналіз поширеності того чи іншого ФР серед хворих на ІІ та ГІ (табл. 4.1).
Таблиця 4.1
Частота факторів ризику в залежності від типу інсульту
Фактори ризику Ішемічний
інсульт Геморагічний інсульти Всього Рn=79 n=60 139
Артеріальна гіпертензія 75,9±4,8 n=60 90,3±5,3
n=54 82,0n=114 р<0,05
Фібриляція передсердь 17,7±3,4 n=14 6,4±4,4
n=4 12,9 n=18 р<0,001
Постінфарктний кардіосклероз 4,0±2,2 n=5 3,2±3,1 n=1 4,3 n=6 р<0,05
Мітральна вада 3,8±2,1 n=3 - 2,1 n=3
Цукровий діабет 20,2±4,5 n=16
12,9±6,0 n=8 15,8 n=24 р>0,05
Гіперхолестеринемія 39,2±5,5 n=31 48,3±8,9 n=28
42,4 n=59 р>0,05
Обтяжлива спадковість40,5±5,5 n=32 29,0±3,0 n=17
35,2 n=49 р>0,05
Тютюнопаління 29,1±5,1 n=23 32,3±8,4
n=19 30,2 n=42 р<0,05
Зловживання алкоголем18,9±19,4 n=15 38,7±8,7 n=22 26,6 n=37 р<0,05 Психоемоційне напруження 20,2±20,4 n=16 19,3±7,1 n=11 23,0 n=28 р>0,05 .Транзиторний ішемічний напад 6,3±2,7 n=5 - 20,1 n=5
Аналіз провідних ФР довів, що АГ є провідним чинником як для ІІ, такі для ГІ. (Таблиця 4.1 ).
Частота АГ була однаковою як серед чоловіків, так і жінок.
Переважали її «м’яка» та помірна форми – 85,2% і 87,3% відповідно. 33,6% геморагічних та 48,0% ішемічних порушень мозкового кровообігу виникли на тлі «м’якої» та помірної АГ. На жаль більшість пацієнтів (близько 80%) знали про наявність в себе підвищених цифр АТ, але регулярну антигіпертензивну терапію проводили тільки 9,4% обстежених, а в 35% випадків лікування було епізодичним, або препарати не були правильно підібрані. Як свідчать дані, наведені в таблиці, пріоритетними також були ГХС, обтяжливий спадковий
Характер.Діаграма населення України,демогвафічна карта Мозкового прушення та виникнення нападів інсультів та повторних інсультів.2019-2020рік.

На сьогодні однаково часто серед чоловіків та жінок зустрічалися АГ, спадковий фактор, мітральна вада, ТІН. Вірогідно значущим у чоловіків було зловживання алкоголем і «поточне» тютюнопаління, для жінок більш значущими були ГХС, психоемоційні травми, ФП, ЦД.
Питома вага ГХС була високою як серед чоловіків, так і жінок. Місце
ГХС в патогенезі МІ обговорюється як пріоритетний так і сумнівний фактор. Не остання роль відводиться спадковості. Причому доведено, що цей фактор важливим є саме для пацієнтів молодших за 60 років, та є не значущим для ВК. Без сумніву, це має сприяти виявленню осіб з «групи ризику» Цукровий діабет, який прискорює прогресування атеросклерозу – безперечний фактор ризику МІ. На жаль, в дуже великому відсотку випадків захворювання цей патологічний стан був виявлений під час обстеження в судинному відділенні. Саме для молодих осіб було характерним наявність шкідливих звичок. Алкоголем зловживали чверть (26,6%) хворих, в основному чоловіки. Крім того більше половини випадків гострих цереброваскулярних станів розвинулося на тлі алкогольного сп’яніння. Курців серед хворих з ІМ і ВК виявлено відповідно 29,1% и 32,3%. Тривогу викликає збільшення поширеності паління серед жінок в останні роки. Дві третини випадків зловживання алкоголем поєдналися з палінням. Це є підставою для більш активнішої та масової пропаганди здорового способу життя. Паління і зловживання спиртними напоями комбінувалося з АГ в 74,9±3,3% і
72,6±4,0%, з АГ і ГХС в 30,3±3,5% і 30,6±4,1% випадка відповідно.курців в 9,1±2,2% випадків констатовано поєднання АГ з ЦД, у 10,5±2,8% тих, хто зловживав алкоголем АГ і ФП.
Кардіологічне обстеження у 40% хворих виявило різні зміни з боку
ССС, що свідчить про тісний зв’язок судинних уражень головного мозку та серця. Приблизно 17,4% гострих ішемій мають кардіоемболічну природу. ФП діагностовано в 17,7% ІІ, констатована асоціація з жіночою статтю, що відповідає іншим дослідженням [10, 91, 93]. Визначною рисою формування судинних уражень головного мозку є множинність ФР (поліфакторність), що збільшує в декілька разів ризик ЦВЗ.
Часто зустрічаються поєднання АГ, ГХС, паління, емоційного стресу. Для наших пацієнтів було характерним поєднання 2-3 ФР, незалежно від типу МІ Геморагічний інсульт Інфаркт мозку
Рис. 4.2. Піки найбільшої частоти випадків поєднання ФР в осіб з різними типами МІ.
Особливе значення відводиться поєднанню таких корегуючих ФР як
паління, обтяжлива спадковість, цукровий діабет. Серед поширених
комбінацій найважливіше місце займали комбінації АГ і ГХ36,6±1,6%; АГ і спадковість – 16,7±1,3%; АГ і ЦД – 15,9±1,2%; АГ і ФП – 15,5±1,2%; АГі паління– 14,1±1,2%, АГ, ГХС і ЦД – 9,1±1,0%; АГ, ГХС і спадковість – 7,1±0,9%; АГ, ГХС і паління– 6,1±0,8%; АГ, ГХС і ФП – 5,9±0,8%. Слід зазначити, що у жінок вірогідно частіше зустрічалися наступні поєднання
АГ і ГХС (39,4±2,3% і 32,7±2,2%, р<0,05); АГ і психоемоційне напруження(7,0±1,2% і 16,3±1,8%, р<0,01); АГ і ФП (18,3±1,8% і 12,6±1,6%, р<0,05); АГ іЦД (18,3±1,8% і 13,5±1,6%, р<0,05); АГ і мітральна вада (2,5±0,7% і0,2±0,2%, р<0,01); АГ, ГХС і психоемоційне напруження (7,0±1,2% і2,5±0,7%, р<0,01). У чоловіків частіше відмічені поєднання АГ і паління (29,1±2,2% і 0,5±0,3%, р<0,01); АГ і зловживання алкоголем (17,8±1,8% і2,5±0,7%, р<0,01); АГ, ГХС і паління (11,9±1,5% і 0,2±0,2%, р<0,01); АГ, ГХС і зловживання алкоголем (7,2±1,2% і 1,4±0,6%, р<0,01). Прогноcтична роль окремих факторів ризику не викликає сумнівів. Їх структуру необхідно вивчати з урахуванням віку, статі, типу інсульту.
Проведене дослідження та порівняльна оцінка даних дозволили зробити висновки та підтвердити провідне значення АГ у виникненні як ІІ, так і ВК, а також провідну роль кардіальної патології, як предиктора розвитку гострих ішемій. Таким чином, проведене дослідження продемонструвало, що провідними ФР серед молодого та зрілого населення нашого міста є артеріальна гіпертензія, підвищений рівень холестерину сироватки ,спадкова схильність, ФП, ЦД, а також шкідливі звички. Зважаючи на значну роль модифікуємих ФР в розвитку церебральних подій, провідною ланкою в системі профілактики слід надавати дії саме на ці фактори. Корекція перелічених станів передбачає не тільки застосування лікарської профілактики, роль якої не викликає сумнівів, а насамперед, формування відповідних мотивацій, корекцію способу життя, зміну ставлення населення до власного здоров’я, відмову від шкідливих звичок. .
РОЗДІЛ V
КЛІНІЧНА ХАРАКТЕРИСТИКА ХВОРИХ В ГОСТРОМУ ПЕРІОДІ
МОЗКОВОГО ІНСУЛЬТУ
Мозковий інсульт (МІ) – клінічний синдром гострого судинного
ураження головного мозку. Він є результатом різних за характером
патологічних процесів з боку серцево-судинної системи, крові і
супроводжується структурними та морфологічними змінами тканини мозку, порушенням його функцій, стійкими органічними та неврологічними симптомами [8]. Різноманітність етіологічних і патогенетичних механізмів розвитку захворювання визначає його гетерогенність, а це припускає поділ на типи.
Саме гетерогенність обумовлює виражений поліморфізм і варіабельність клінічної картини, що визначаються різними причинами, у першу чергу, характером процесу, швидкістю його формування, локалізацією та розміром самого вогнища і перифокального набряку, станом серцево-судинної системи, супутніми захворюваннями, розвитком ускладнень, віком та іншими
факторами [7, 8, 29, 30]. Важливим етапом у діагностиці МІ є візуалізація вогнища ураження. Не зважаючи на повсюдне впровадження сучасної діагностичної апаратури, не можна зменшувати місце найбільш доступного - патологоанатомічного дослідження. Аутопсія – найбільш достовірний метод дослідження головного мозку у випадку фатального наслідку [13-15], особливо в тих випадках, коли летальний кінець настає в перші години захворювання. Вивчення клініки і морфологічної картини змін головного мозку в гострому періоді фатального і нефатального МІ повинні дати можливість виявити деякі характерні риси клінічної структури і особливості проходження гострого періоду захворювання, установити фактори. Це має в перспективі можливість корегування лікувальних заходів з метою запобігання виникненню патологічних змін, які ускладнюють МІ. Метою цього етапу роботи є вивчення особливостей клінічного перебігу і структурно-морфологічних змін речовини мозку у хворих з фатальним і нефатальним МІ, що необхідно для розроблення заходів, спрямованих на зменшення кількості смертельних наслідків.
Проведено комплексне обстеження 139 хворих у гострому періоді
мозкового інсульту, вивчені клінічні особливості перебігу гострого періоду МІ, виявлені фактори, що впливають на результат патологічного процесу, причини смерті хворих. Середній вік досліджених осіб складав 49,8±1,2 років. Серед них було 34 померлих протягом 28 діб з моменту початку захворювання (група фатального ішемічного та геморагічного інсультів) і 205 хворих з успішним результатом лікування гострого періоду ішемічного та геморагічного процесів. Групи були порівняні за основними параметрами – віком, статтю, факторами ризику, супутньою патологією.
5.1. Клінічна характеристика хворих з фатальним мозковим інсультом.
Серед 34 хворих цієї групи було 20 (59%) чоловіків та 14 (41%) жінок,
з яких 16 (47,0%) хворіли на ІІ, а 18 (53,0%) – ГІ, у двох з яких, разом з
осередком крововиливу був виявлений ішемічний, розцінений з урахуванням клініки як вторинний. Середній вік обстежених становив 43,9±2,3 років.
Детальний розподіл хворих наведений у таблиці 5.1.
Майже всі хворі були госпіталізовані в судинне відділення машинами ШМД, з них майже 70 % протягом перших 6 годин з моменту виникнення ознак гострого цереброваскулярного захворювання. Однак стан 30% хворих був розцінений не як захворювання, що призвело до пізньої госпіталізації, тобто після 6 годин, і був розцінений як втрата часу на лікування.
Таблиця 5.1
Розподіл хворих з фатальним мозковим інсультом за типом,
статтю та віком
Вік, роки Ішемічний інсульт Геморагічний інсульт
Чоловіки Жінки Всього Чоловіки Жінки Всього
n % n % n n % n % n
10 62,5 6 37,5 16 10 55,5 8 44,5 18
30–39 1 10 - 1 3 30 1 12,5 4
40–49 3 30 3 50 6 3 30 2 25 5
50–59 6 60 3 50 9 4 40 5 62,5 9
Хворих з пригніченою свідомістю та порушенням життєвих функцій
госпіталізовували в палати інтенсивної терапії. Всім пацієнтам проводили загальноприйняту базисну терапію з використанням вазоактивних, дегідратуючих препаратів, нейропротекторів, антиоксидантів та антигіпоксантів. Диференційована терапія в залежності від характеру інсульту включала антикоагулянти при ішемічному, гемостатики при геморагічному характері процесу. Для корекції життєво важливих функцій організму, водно-електролітного балансу використовували звичайні реанімаційні заходи на тлі моніторування основних показників – ЧСС, ЧДР, температури тіла, АТ, ЕКГ. Всі хворі були оглянуті терапевтом, окулістом, при необхідності – нейрохірургом, кардіологом, судинним хірургом. У 52,5% хворих, які були доставлені до стаціонару стан був розцінений як середньої тяжкості, у 29,0% як тяжкий, у 18,5% як вкрай тяжкий, 1 хворий був в термінальному стані. За Скандинавською шкалою це відповідало у 17,5% хворих інсульту легкого ступеня, у 40% – середньому ступеню тяжкості і у 42,5% – тяжкому інсульту.
Таблица 5.2
Розподіл хворих з нефатальним інсультом за статтю, віком, типом МІ. Вік, роки Ішемічний інсульт Геморагічний інсульт
Чоловіки Жінки Всього Чоловіки Жінки Всього
n % n % n n % n % n
Всього 44 55,7 35 44,3 79 19 73 7 27 26
30–39 5 11,3 1 2,8 6 3 15,7 1 14,3 4
40–49 14 31,8 10 28,5 24 6 31,6 3 42,6 9
50–59 25 56,8 24 68,5 49 10 52,6 3 42,6 13
В залежності від типу МІ та його локалізації констатовані наступні
особливості проявів патології. У 61,3% пацієнтів зареєстрований гострий початок захворювання, у 32,3% – поступовий, «підгострий» розвиток мав місце у 6,4%, що вимагало необхідність ретельного диференціального діагнозу з неопластичними процесами.
В першу добу стан хворих за Скандинавською шкалою відповідав у
54,8% – легкому інсульту, у 32,3% – середньої тяжкості, у 12,9% – тяжкому. Загальномозковий синдром мав варіабельний характер. У 54,8% пацієнтів з ІМ порушення свідомості не виявлено, у 38,7% констатовано заглушення та у 6,5% – сопір. Температурна реакція відмічена у 19,4% хворих. Значних порушень життєво важливих функцій не відмічено. У неврологічному статусі спостерігалося чітке переважання вогнищевих синдромів, відповідно басейну ГПМК. У 1 хворого був епілептичний синдром, у 2-х діагностована пневмонія, у одного загострення хронічного пієлонефриту.
На відміну від ІМ темп розвитку ГІ характеризувався гострим початком у 68,0%, поступовим - у 32,0%. Загальний стан 40,0% пацієнтів оцінено як тяжкий, 60,0% – середньої тяжкості. 8,0% госпіталізовано в коматозному стані, 14,0% сопорі, 18,0% – в стані заглушення. Ускладнювали хворобу у одного хворого епіприпадок та ще у одного пізня пневмонія.
РОЗДІЛ VI
СТРУКТУРНО-МОРФОЛОГІЧНА ХАРАКТЕРИСТИКА
МОЗКОВОГО ІНСУЛЬТУ У ХВОРИХ МОЛОДОГО ВІКУ
Одним з найважливіших етапів верифікації діагнозу мозкового інсульту є візуалізація патологічного вогнища. Всім обстеженим хворим з не- фатальним інсультом проведена комп’ютерна томографія головного мозку (у тому числі в динаміці), а тим хворим, що померли - патологоанатомічний розтин. За результатами КТ-сканування картина ІІ в групі хворих пацієнтів, що вижили після гострої фази інсульту мала наступний вигляд: у 29 (36,7%) були виявлені невеликі гіподенсивні вогнища супратенторіальної
локалізації на тлі структурних змін, що відповідають судинній енцефалопатії (невеликі поодинокі або множинні гіподенсивні вогнища, що розташовані в ділянці базальних ядер, внутрішньої капсули або перивентрикулярно, а також наявність розширення шлуночкової системи та борозен півкуль мозку) (рис. 6.1). У 17 (21,5%) пацієнтів об’єм вогнищевих змін (разом із зоною перифокального набряку) не перевищував 10 см 3, у 6 (7,6%) пацієнтів був в межах 10-20 см 3, у 7 (8,9%) - 20-40 см 3
. Однак у 5 (6,4%) осіб цієї групи розмір вогнища перевищував 60 см
. Тобто, у більшості хворих, візуалізовано ішемічні осередки різного розміру без ознак латерального зсуву, що свідчить про незначний набряк мозку. У однієї хворої осередки інфаркту розташовані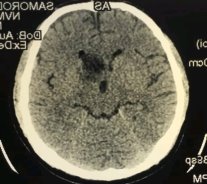
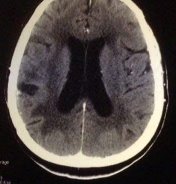 в симетричних ділянках протилежних півкуль в басейні СМА, у трьох
в симетричних ділянках протилежних півкуль в басейні СМА, у трьох
визначені по 2 осередку в одній півкулі, об’єм яких не перевищував 10 см 3. У2 (2,5%) хворих мали гетероденсивні вогнища, що свідчило про розвиток.
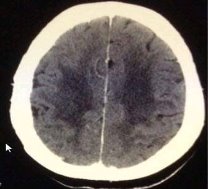
Рис. 6.1. Комп’ютерна томограма головного мозку хворої М. Ішемічний інсульт в басейні правої СМА. Зона зниженої щільності в правій тім’яній ділянці (V=10,3 см 3 ):а) аксіальний зріз на рівні медіобазальних структур; б) аксіальний зріз на рівні коркових відділів тім’яних часток .У хворих з ІІ дані КТ відповідали клінічним проявам . Більший об’єм осередку супроводжувався вираженим набряком мозку, що обумовлювало тяжкість загального стану.
Результати КТ-сканування в гострому періоді нефатального ГІ, свідчать про зміни щільності тканини у вигляді гіперденсивних вогнищ субкортикальної латеральної в межах 1-2 часток (рис.6.2) локалізації. Об’єм осередку коливався від 8,74 до 38,0 см 3 (в середньому 22,4±2,2 см3). У 8 (31,0%) хворих був меншим за 20 см3, а у решти 18 (69,0%) – 20-40 см3Гематоми мали неправильну форму, без чітких контурів. Зона зниженоїщільності, як наслідок формування перифокального набряку була незначною. Розмір латерального зсуву залежав від об’єму гематоми та коливався в межах від 0,2 до 0,8 см. У 19 (73,0%) осіб спостерігалися інші прояви об’ємної дії: здавлювання та деформація бокових шлуночків, мозкових цистерних нервів. Всім хворим молодого та зрілого віку з фатальним інсультом проводилася 100% патологоанатомічна верифікація діагнозу. В гостру фазу (28 діб) померло 16 (47,0%) хворих з верифікованим інфарктом мозку.
Патологоанатомічний розтин виявив у цих пацієнтів великі вогнища некрозу(т.з. білі інфаркти) в тім’яно-скроневій та тім’яно-потиличній ділянках з руйнуванням внутрішньої капсули, що було обумовлено оклюзією стовбура СМА. Переважали вогнища неправильної форми (у вигляді трикутника або неправильного еліпсоїду) та значного розміру середніми діаметрами 5,4±0,4, 4,0±0,2, 4,4±0,3 см, середнім об’ємом - 52,1±5,4 см. У 7 (43,75%) хворих з півкульовим інфарктом спостерігалися ознаки дислокації мигдаликів мозочку і стовбуру мозку. У двох осіб осередок локалізувався в ділянці базальних ядер, у 1 виявлений крововилив в стовбур, який розцінено як вторинни внаслідок набряку. Так у 2 осіб мали місце значні осередки з
ураженням структур, що кровопостачалися як ПМА так і СМА. У 3 випадках при аутопсії констатовано по 2 осередки (у 2 – в базальних відділах обох півкуль у 1 – в системах обох СМА), у 2 хворих – ішемічне вогнище.
РОЗДІЛ VII
ХАРАКТЕРИСТИКА УСКЛАДНЕНЬ ГОСТРОГО
ПЕРІОДУ МОЗКОВОГО ІНСУЛЬТУ
Як показало наше клініко-патологоанатомічне дослідження, у
переважної більшості пацієнтів групи фатального МІ (96,1%), які мали великі півкульові або стовбурові інфаркти, і у 100% хворих з геморагічним інсультом, не зважаючи на проведену медикаментозну терапію, смертельний кінець наставав у результаті наростання набряку мозку з формуванням дислокаційного синдрому і блокади лікворопровідних шляхів з подальшим розвитком у частини хворих вклинення у великий потиличний отвір. У 29,3% випадків масивне півкульове геморагічне вогнище супроводжувалося проривом крові в бічні шлуночки великого мозку. У 1 хворого з інфарктом мозку і у 2 із внутрішньомозковим крововиливом супратенторіальної локалізації під час патологоанатомічного розтину крім ознак дислокаційного синдрому, були виявлені крововиливи в стовбур мозку (в ділянку середнього мозку і варолієвого мосту), які з урахуванням клінічної картини були розцінені як вторинні. Хворі з масивними півкульовими гематомами і вторинними стовбуровими крововиливами були доставлені в стаціонар у дуже тяжкому стані, смертельний кінець у них настав протягом однієї доби. Слід зазначити, що хворі з ІМ і вторинними крововиливами пережили найгострішу фазу й під час госпіталізації перебували у стані середньої тяжкості. Надалі мало місце раптове погіршення їх загального стану з розвитком стовбурового синдрому, що дозволяє припускати не тільки провідну роль дислокації та деформації стовбурових структур у розвитку вторинних крововиливів, але й інших патокінетичних ланок їх розвитку, наприклад, рефлекторних впливів основного вогнища на проникність судинної стінки. В одного з них було
діагностовано ТЕЛА, у 2 на тлі масивного крововиливу виявлені вторинні інфаркти в протилежній гемісфері.
Діагноз геморагічної трансформації (ГТ) інфаркту мозку включає всі
паренхіматозні та позапаренхіматозні крововиливи, що розвинулися на тлі ішемічного інсульту і вважаються його клінічно значущими ускладненнями, які впливають на тактику ведення хворих. При патологоанатомічному дослідженні ГТ виявлена у 2 пацієнток (5,8%) з кардіоемболічним інсультом. Клінічно ГТ проявлялася раптовим погіршенням загального стану хворих (пригніченням свідомості, наростанням загальномозкової симптоматики), гіпертермією (до субфебрильних і фебрильних цифр) з подальшою позитивною динамікою під час лікування. Змін лабораторних показників (лейкоцитоз, зсув лейкоцитарної формули вліво) не було визначено.
Тривалість життя цих хворих був 8,14 діб. Основний патологічний процес мав півкульову локалізацію. Великі вогнища (41,6±9,2 см3) розміщувалися в основі мозку, в субкортикальних відділах правої скроневої ділянки та в ділянці лівої внутрішньої капсули. При порівнянні розвитку даного ускладнення у хворих зі сприятливим і несприятливим кінцем інсульту слід зазначити, що в 9,7% випадків у хворих, які вижили (р>0,05), клінічно ішляхом нейровізуалізації діагностована геморагічна трансформація ішемічного вогнища з локалізацією у двох з них в кіркових структурах і у одного в ділянці базальних гангліїв. Однак об’єм вогнища в цих випадках неперевищував 30 см 3 (16,7±7,6 см3). Таким чином, летальний кінець у хворихіз ГТ інфаркту мозку визначали розміри вогнища, які були значно більші, ніж в групі хворих з нефатальним інсультом.
поодинокими із вторинною генералізацією, без трансформації в епілептичний статус і зупинені внутрішньовенним введенням 0,5% розчину сибазону. Знайдені на розтині великі вогнища ішемії розміщувалися в перикортикальній ділянці скроневих часток. В усіх спостереженнях фокус інфаркту мав лівопівкульову локалізацію. При крововиливі в мозок епісиндром спостерігався у 9,1% хворих. У 3 з них на аутопсії вогнище крововиливу виявлені в півкулях мозку, причому в 3 (3,0%) випадках із проривом в бічний шлуночок і в 2 - із крововиливом під м'яку оболонку мозочка. По одному пацієнту мали крововилив у мозочок і стовбур мозку. На відміну від померлих хворих, тільки у двох, які вижили (з інфарктом ікрововиливом), відзначалися прості моторні епінапади (типу «джексонівського» при ВК і розгорнутий тоніко-клонічний при ІМ). Гіперглікемія в гострому періоді інсульту також визначає погіршення прогнозу і тому сприяє збільшенню площі мозкового інфаркту внаслідок ще більшого зменшення мозкового кровотоку. Гіперглікемія може бути як наслідок попереднього цукрового діабету, так і стресової реакції, викликан безпосередньо тяжким патологічним процесом. З іншого боку, інсульт посилює цукровий діабет [6, 13]
Аналізуючи дані власних досліджень, ми прийшли до висновку, що
пневмонія є серйозним соматичним ускладненням інсульту, що сприяє настанню летального кінця у цих хворих. Пневмонію діагностовано клінічно і констатовано шляхом аутопсії у 14,3% хворих з ІМ і в 8,1±% з ВК. При ішемічному інсульті, ускладненому легеневою патологією, були виявлені великі півкульові вогнища, у 2 (2,9%) померлих вогнище сірого розм'якшення знаходилося в стовбурі головного мозку. При геморагії в хворих були вогнища півкульової локалізації, 1 - у мозочку. Вогнище запалення розміщувалося в нижніх відділах легенів (83,3%) і, як правило, двобічне, у 16,7% мала місце верхньочасткова локалізація. Беручи до уваги швидкий розвиток фатального кінця, варто думати про наявність у даному випадку ранньої пневмонії на тлі тяжкого мозкового інсульту, що збільшила інтрацеребральний процес. У розвитку пневмонії у наших хворих, очевидно.
Значна роль належить тяжкості перебігу основного судинного процесу, його локалізації, віку, попереднім соматичним захворюванням, а також супутній кардіальній патології. Пізню пневмонію було діагностовано в 6,5±4,4% пацієнтів з ІМ і в 8,0±5,5% із ВК. Однак аналіз частоти цього ускладнення у хворих з нефатальним інсультом в порівнянні з померлими не виявив статистично значущої різниці (р>0,05).
Патологія серця значно визначає перебіг і результат гострого
порушення мозкового кровообігу. З одного боку, кардіальна патологія причинним чинником церебральної катастрофи, передумовою розвитку її ускладнень, а, з іншого боку, інсульт викликає декомпенсацію функції серцево-судинної системи. При патологоанатомічному дослідженні в значної частини померлих констатовані ішемічна хвороба серця, дифузний кардіосклероз. Проблема супутніх порушень мозкового і коронарного кровообігу є однією з актуальних проблем клінічної медицини, що обумовлена загальними механізмами регуляції всієї серцево-судинної системи, спільністю факторів ризику, значенням кардіальної патології в
розвитку порушень мозкового кровообігу [16, 17]. У нашому дослідженні порушення функції нирок виявлено в 3,9±2,2% осіб з ІМ і в 1,0±1,0% хворих з ВК внаслідок діабетичного ураження, а ще в
одного – кінцева стадія серцевої недостатності з ураженням паренхіматозних органів. Основними показниками розвитку гострої ниркової недостатності були висока протеїнурія і наростання концентрації креатиніну і сечовини в сироватці крові.
Інфікування сечовивідних шляхів відзначено в пацієнтів з ІМ у 10,4±3,5% і з ВК - у 6,1±2,4% випадків. У цих хворих мав місце розлад
свідомості у вигляді сопору або коми в момент розвитку захворювання або на 1-2 – гу добу перебування в стаціонарі. Це були особи літнього і старечого віку. Середній термін їх перебування в стаціонарі склав 10,4 доби. Порушення сечовипускання сприяли також утворенню пролежнів, показало значні відмінності показників у хворих з нефатальним та фатальним МІ для обох типів. Для ІМ вони склали відповідно 27,0±7,3% і 65,0±7,5% (р<0,001), для ГІ - 11,3±4,0% і 40,0±7,7% (р<0,01). Таким чином, при проведенні дослідження нами виявлені пріоритетні для першої і другої груп хворих ускладнення мозкового інсульту, що безсумнівно викликали погіршення стану і сприяли прискоренню фатального кінця, а з часом і зумовлювали його. Аналіз причин смерті хворих і факторів,
що впливають на летальний кінець, а також структурних змін головного мозку дозволив виявити закономірності, за допомогою яких можна прогнозувати виникнення обтяжливих процесів і вживати заходів, спрямованих на зниження летальності в гострому періоді захворювання. На наш погляд, значний інтерес становить визначення причин летальних наслідків у осіб, стан яких при госпіталізації було розцінено.
РОЗДІЛ VIII
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ ТА ЇХ ОБГОВОРЕННЯ.
Гострі порушення мозкового кровообігу (ГПМК) залишаються
важливою медико-соціальною проблемою, не зважаючи на досягнення фундаментальних та прикладних досліджень у галузі цереброваскулярної патології, що призводить до високої летальності та інвалідизації осіб, яка пов’язана перш за все з когнітивними порушеннями. Розвиток інфаркту мозку, близько третини випадків, супроводжується виникненням когнітив- них порушень аж до розвитку деменції.
Підвищення частоти виникнення ГПМК серед населення віком до 50
років та недостатнє вивчення конкретних стимулів, етіологічних факторів та особливостей патогенезу спонукає до ґрунтовного дослідження дано проблеми [16, 25, 26]. Інсульт є однією з найбільш частих причин смерті у світі. У 2005 р. внаслідок інсульту померло 5,8 млн. осіб, 2/3 з яких — у країнах з низьким та середнім рівнем прибутків. Важливість збору епідеміологічних даних щодо інсульту полягає не тільки в пропаганді боротьби з захворюванням, але і в тому, що вони допомагають створювати, регулювати та оцінювати програми, спрямовані на зниження захворюваност в майбутньому. На сьогодні більшість даних про інсульти отримано у країнах з високим рівнем прибутків. Саме з цієї точки зору детальне вивчення всіхможливих причин, а не тільки факторів ризику, та розробок профілактичних методів мають надзвичайно важливе значення.
Як довів аналіз офіційної медичної документації, в останні 5 років
смертність від ЦВЗ в місті стабілізувалася та має тенденцію до незначного зниження. Показник смертності від МІ по м. Суми у відповідні роки становив 41,8; 31,9; 32,8 на 100 тис. населення, серед працездатного .Обласному центру відповідно 27,1; 12,4; 12,3 на 100 тис. населення. На жаль офіційних даних по області щодо типів інсульту немає. Також немає чіткої градації хворих за віком, також в офіційній статистиці немає показників розповсюдженості ФР, окрім артеріальної гіпертензії та атеросклерозу. У профільних стаціонарах міста в гострому періоді проліковано 68,5% хворих. Більш ніж 60% хворих почали отримувати адекватну терапію в перші 6 годин з моменту розвитку захворювання, однак рівень ранньої госпіталізації найчастіше визначався тяжкістю стану, типом МІ і віком хворих. Тобто у першу чергу було госпіталізовано хворих більш молодого
віку й у більш важкому стані. Летальність серед пацієнтів, госпіталізованих протягом так званого «терапевтичного вікна» була вищою, ніж серед госпіталізованих пізніше вказаного терміну, що пояснюється тим, що в перші години у неврологічні відділення госпіталізуються пацієнти у більш важкому стані. Однак ефективна профілактика ЦВЗ і МІ містить у собі, насамперед, боротьбу з факторами ризику і базується на стратегії концепції факторівризику [9, 10]. З цією метою ми проаналізували наявність у цієї категорії пацієнтів відомих факторів ризику. Для вирішення поставленої задачі ми здійснили аналіз поширеності того чи іншого ФР серед хворих на ІІ та ГІ Аналіз провідних ФР довів, що АГ є провідним чинником як для ІІ так і для ГІ.
Частота АГ була однаковою як серед чоловіків, так і серед жінок.
Переважали ії «м’яка» та помірна форми – 85,2% и 87,3% відповідно. 33,6% геморагічних та 48,0% ішемічних порушень мозкового кровообігу виникли на тлі «м’якої» та помірної АГ. Насторожує той факт, що більшість пацієнтів(близько 80%) знали про наявність в себе підвищених цифр АТ, але регулярну антигіпертензивну терапію майже не проводили, але займалися самолікуванням. Як свідчать дані, наведені в діаграмі, пріоритетними також були ГХС, обтяжливий спадковий анамнез, тютюнопаління, миготлива аритмія, зловживання алкоголем. Серед чоловіків переважали зловживання
алкоголем і «поточне» тютюнопаління, для жінок більш значущими були психоемоційні травми, ФП, ЦД.
На жаль, саме для молодих осіб було характерним наявність шкідливих звичок. Алкоголем зловживали чверть (24,0%) хворих, в основному чоловіки.
Тривогу викликає збільшення поширеності паління серед жінок в останні роки. Дві третини випадків зловживання алкоголем сполучалися з палінням. Це є підставою для більш активнішої та масової пропаганди здорового способу життя.
Психоемоційні навантаження однаково часто супроводжували як ГІ,
так ІІ, та були властиві жінкам. Кардіологічне обстеження у 40% хворих виявлені різні зміни з боку ССС. ФП, яка є безпосередньою причиною церебральних емболій діагностовано в 17,7% ІІ та в в основному в жінок, що відповідає іншим дослідженням [22, 23].
Визначною рисою формування судинних уражень головного мозку є
множинність ФР (поліфакторність). Характерним поєднання 2-3 ФР,
незалежно від типу МІ. Найчастіше поєднувалися АГ і ГХС – 36,6%; АГ іспадковість – 16,7%; АГ і ФП – 15,5%; АГ і паління– 14,1%, Слід зазначити, що у жінок вірогідно частіше зустрічалися наступні поєднання: АГ,психоемоційне напруження , АГ і ФП; У чоловіків частіше відмічені поєднання АГ і паління, АГ і зловживання алкоголем. Проведене дослідження і порівняльна оцінка даних дозволили зробити висновки і підтвердити провідне значення АГ у виникненні як ІІ так і ВК в осіб молодого і середнього віку, а також провідну роль кардіальної патології (особливо миготливої аритмії), як предиктора розвитку гострих ішемій. Таким чином, проведене дослідження продемонструвало, що провідними ФР серед молодого і зрілого населення нашого міста є артеріальна гіпертензія, підвищений рівень холестерину сироватки крові, спадкова схильність, ФП, ЦД, а також шкідливі звички. Зважаючи на значну
роль модифікуємих ФР в розвитку церебральних подій, провідною ланкою в системі профілактики слід надавати дії саме на ці фактори. Корекція перелічених станів передбачає не тільки застосування лікарської профілактики, роль якої не викликає сумнівів, а насамперед формування відповідних мотивацій, корекцію способу життя, зміну ставлення населення до власного здоров’я, відмову від шкідливих звичок. Крім того, на підставі скринінгу ФР ми маємо змогу відібрати хворих для проведення специфічної медикаментозної профілактики із застосуванням антиагрегантів та
антикоагулянтів. При проведенні порівняльної оцінки показників когнітивної функції у хворих в гострий період ІМ, залежно від локалізації вогнища ішемії, отримані такі дані. Середній сумарний бал за шкалою MMSE достовірно(р<0,05) перевищував у хворих із правопівкульною локалізацією вогнища(24,0±0,47 бала за шкалою MMSE) порівняно із хворими з лівої півкуль.
Фатальний кінець при МІ визначався гострим і блискавичним темпом розвитку патології, виразністю неврологічного дефіциту, наростанням внутрішньочерепних і приєднанням соматичних ускладнень, а також наявністю супутньої патології. Сприятливий результат визначався меншими за обсягом патологічними вогнищами, помірним перифокальним набряком, незначними проявами об'ємного впливу, що характеризувався превалюванням вогнищевого синдрому над загальномозковим, меншою кількістю соматичних ускладнень. Це дає можливість прогнозувати розвиток
обтяжливих процесів і своєчасно вживати заходів щодо їх попередження. Таким чином, проведене комплексне епідеміологічне, клінікоморфологічне дослідження дало можливість реально оцінити епідеміологічну ситуацію по мозковому інсульту визначити основні фактори ризику його виникнення, оцінити якість та своєчасність надання медичної допомоги хворим, дозволило розширити уявлення про особливості клінічного перебігу та ускладнень гострого періоду інсульту. Отримані результати дозволили розробити і запропонувати заходи щодо покращення показників захворюваності, смертності і летальності шляхом впровадження освітніх програм для населення, принципів первинної та вторинної профілактики мозкового інсульту в клінічну практику.
ВИСНОВКИ
1. Вивченя невдкладних станів надання первиної та вториної допомоги при гострих інсультів та в подальшому ведення нейрохірургічного лікування в нейрохірургії.
2. Встановлено провідні фактори ризику МІ в популяції м. Києва: для
обох типів інсульту була характерна артеріальна гіпертензія, причому перевага її «м'якої» та помірної форм. Виявлено поліфакторність і комбінації ФР (двох і більше) залежно від характеру процесу, статі. Також відмічена значна роль шкідливих звичок у розвитку церебральних катастроф.
3. На підставі комплексного клініко-неврологічного,
нейровізуалізаційного і патологоанатомічного досліджень гострого періоду МІ встановлено особливості клінічних проявів залежно від характеру і стадії патологічного процесу, темпу його розвитку, обсягу і та локалізації вогнища, що дозволило розширити уявлення про особливості його перебігу. Доказано особливу роль соматичних ускладнень МІ, що обтяжували його перебіг і визначили негативний прогноз. Пріоритетними серед них були пневмонії, інфікування сечовивідних шляхів, , а також поєднання ускладнень. Значнийвплив на рівень летальних кінців усіх видів інсультів супутньої хронічної соматичної патології, на тлі якої вони розвинулися (серцево-судинного захворювання, цукровий діабет та ін.). Ця категорія хворих потребує постійного моніторингу та корекції інтенсивної терапії з метою профілактики, ранньої діагностики, цілеспрямованого лікування ускладненьМІ.
4. Наявність ознак когнітивних і афективних порушень у молодих
пацієнтів в гострому періоді МІ вимагає розробки програми інтенсивних реабілітаційних заходів з метою відновлення функцій головного мозку та адекватного лікування депресивних проявів, які погіршують як ефективність реабілітаційних заходів, так і сприяють погіршенню когнітивних функцій.
5. Результати проведеного дослідження можуть бути покладені в
основу програми заходів, спрямованих на поліпшення епідеміологічної ситуації щодо ЦВЗ і МІ в м. Сумах і на організацію медичної допомоги хворим з урахуванням особливостей даного регіону. Програма включає в себе заходи популяційної стратегії та стратегії високого ризику, впровадження принципів первинної та вторинної профілактики мозкового інсульту. Виявлення, обстеження і лікування осіб з модифікованими факторами ризику.
ПРАКТИЧНІ РЕКОМЕНДАЦІЇ
1. Ефективно спланувати систему профілактики та лікування порушень мозкового кровообігу на основі встановлених епідеміологічних характеристик, провідних факторів ризику розвитку патології причини негативного прогнозу.
2. Вдосконалення системи організації допомоги хворим ЦВЗ повинно будуватися виходячи з таких потреб: потрібна організація поетапного надання медичної допомоги хворим з МІ, невідкладна допомога повинна надаватися в спеціалізованих інсультних відділеннях, що забезпечені сучасною апаратурою, необхідно формування системи реабілітаційного лікування хворих з ЦВЗ та МІ. 3. Для зниження захворюваності та смертності від МІ необхідно
виконання заходів по його первинній та вторинній профілактиці. Стратегія профілактики повинна включати виявлення та корекцію факторів ризику. Поряд з заходами медичного характеру (активного виявлення та адекватного лікування хворих з модифікованими ФР початковими формами судинних уражень головного мозку), суттєве значення повинно надаватися питанням формування здорового способу життя населення, що передбачає масову просвітню роботу, що включає лекції, бесіди, в т.ч. з використанням засобів масової інформації та санітарної просвіти. .
4. Для покращення ситуації по МІ у вивченому регіоні (м. Києва)
необхідно виконання наступних заходів: 1) впровадити освітні програми для широких мас населення (уявлення про фактори ризику МІ, знання перших ознак інсульту та його наслідків, необхідність ранньої госпіталізації хворих);
2) впровадити принципи профілактики та ранньої реабілітації в клінічну практику.
5. Виявлення особливостей клінічного перебігу гострого періоду та
виходу мозкового інсульту, що залежать як від безпосереднього
пошкодження мозку, так і від приєднаних ускладнень, що викликаютьГПМК.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
1. Александрийский А.А. Клинико-нейрофизиологическая характе-
ристика начальных проявлений недостаточночти кровоснабжения головного мозга. Автореф. дис…канд. мед. наук. 14.01.13 / ГОУ ВПО «Ивановска государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию» – Иваново, 2006. – 19 с.
2. Бегидова Н.М., Чудопал С.М. Течение и исходы инсульта у лиц
молодого возраста на территории Кабардино-Балкарской Республики
//Журнал неврологии и психиатрии им. С.С. Корсакова. – 2009. – С. 75-76.
3. Биденко М.А., Шпрах В.В., Мартыненко Е.А. Структура, исходы и
факторы риска мозговых инсультов по данным госпитального регистра вг.Иркутск // Сибирский медицинский журнал. - 2008. - № 4. - С. 61-64.
4. Бокарев И.Н., Бокарев М.И. Тромбофилии, венозные тромбозы и их лечение // Клиническая медицина. — 2002. — № 5. — С. 4-8.
5. Булеца Б.А., Тимченко Н.Д. Деякі атипові фактори ризику мозкових інсультів у осіб молодого віку на Закарпатті // Український медичний альманах. — 2006. — № 2(9). — С. 22-24.
6. Бурцев В.И. Об актуальных вопросах проблемы артериальной
гипертонии // Клиническая медицина. — 2001. — № 1. — С. 65-67.
7. Виленский Б.С., Широков Е.А., Бондарева Т.А. Профилактика и
лечение осложнений инсульта — мультидисциплинарная проблема
//Клиническая медицина — 2001. — № 9. — С. 12-15.
8. Виленский Б.С. Инсульт:профилактика, диагностика и лечение. – Спб.: ООО «Издательство ФОЛИАНТ», 2002. – 397 с.
9. Волошин П.В., Міщенко Т.С., Лекомцева Є.В. Аналіз поширеності та
захворюваності на нервові хвороби в Україні // Международный
неврологический журнал. — 2006. — № 7. — С. 9-13.
10. Горбась І.М. Фактории ризику мозкового інсульту: поширеність,
динаміка, контроль // Здоров України. - 2009. - №22 (227). – С. 14-15.
11. Гузева В.И., Чухловина М.Л., Чухловин А.А. Ишемический инсульт улиц молодого возраста // Клиническая медицина. - 2006. - № 4. - С. 8-12
. 12. Гуляев Д.В., Петренко О.Э., Гуляева М.В. Об организации борьбы с инсультом // Судинні захворювання головного мозку. — 2006. — №1. — С. 8-22.
13. Гусев Е.И. Проблема инсульта в России // Журнал неврологии и
психиатрии им. C.C. Корсакова. — 2003. — № 9. — С. 3-7.
14. Гусев Е.И., Скворцова В.И. Нейропротективная терапия ишемического инсульта // Атмосфера. Нервные болезни. — 2002. — № 1. — С. 3-7.
15. Гусев Е.И., Скворцова В.И. Стаховская Л.В. Инсульт – время
совместных активных действий // Журнал неврологии и психиатрии им. С.С.
Корсакова. – 2007. - №6. – С.4-10.
16. Дзяк Л.А., Котолевська О.С., Голик В.А. Особливості перебігу
субарахноїдальних крововиливів з повторним розривом артеріальних аневризм // Украинський медичний альманах. — 2002. — № 6. — С. 38-40.
17. Дзяк Л.А. Инсульт у молодых пациентов // Здоров’я України. — 2009. — № 5. — С. 12-15.
18. Евтушенко С.К. Гетерогенный ишемический инсульт у детей // Журнал неврологии и психиатрии им. C.C. Корсакова. — 2003. — № 5. — С. 74-82.
19. Евтушенко С.К., Иванова М.Ф., Налетов С.В., Евтушенко И.С.
Гормональные контрацептивные средства как фактор риска ишемического инсульта у женщин молодого возраста Международный неврологический журнал. — 2008. — № 3(19). — С. 30-34.
20. Евтушенко С.К., Шепотинник Е.В., Фадеева Г.В. Патологическая роль гемодинамически незначимого открытого овального окна в развитии кардиоэмболического инсульта // Международный неврологический журнал. — 2008. — № 1(17). — С. 54-57.
21. Евтушенко С.К. От этиологии подвидов инсультов у лиц молодого возраста — к их эффективному лечению и профилактике // Матеріали XII міжнародної конференції «Актуальні напрямки в неврології: сьогодення .
майбутнє». — Судак, 2010. — С. 12-18.
22. Захарушкина И.В., Деев А.С. Церебральные инсульты в молодом
возрасте // Журнал неврологии и психиатрии им. C.C. Корсакова. — 2000. —
№ 1. — С. 14-17.
23. Захарушкина И.В. Церебральные инсульты у мужчин молодого
возраста // Российский медико-биологический вестник им. Акад. И.П. Павлова. – 2003. - №1-2. – С. 65 – 69.
24. Зербіно Д.Д., Гринчишин Н.З., Цюк І.І. Інсульт та професія //
Український медичний часопис. – 2007. - №5 (61). – С. 38-41.
25. Зербіно Д.Д., Гринчишин Н.З., Цюк І.І. Гострі порушення мозкового кровообігу у чоловіків віком до 50 років // Український медичний часопис. – 2008. – 1(63). – 83-87.
26. Зербіно Д.Д., Гринчишин Н.З. Інсульт: вікові, статеві та професійні
особливості // Асоційовані з віком захворювання. – 2008. – 2(02). – 24 – 28.
27. Зиновьева О.Е., Мозолевский Ю.В., Шварева И.С. и др. Ишемический инсульт в молодом возрасте на фоне комбинированного тромбофилического состояния // Неврологический журнал. - 2007. - № 5. - С. 30-35.
28. Зозуля І.С., Боброва В.І., Зозуля А.І., Бредіхін О.В. Діагностика,
комплексне лікування, реабілітація, профілактика і організаційні заходи з питань церебрального інсульту: Навч.-метод. посібник для лікарів. — К., 2004. — 71 с.
29. Зозуля І.С., Мошенська О.П. Гострий період ішемічного інсульту:
сучасний погляд на проблему // Український медичний часопис. — 2009. — № 4. — С. 67-73.
30. Зозуля И.С., Вершигора А.В., Боброва В.И. и др. Медицина
неотложных состояний. — К.: Медицина, 2008. — С. 281-315.
31. Зорилова И.В., Суслина З.А., Иллариошкин С.Н., Кистенев Б.А.
Наследственно обусловленная гипергомоцистеинемия в патогенезе ишемического инсульта у лиц молодого возраста /Неврологическийжурнал.- 2005. - № 2. С. 14-17.
32. Иваницкий А.В., Голухова Е.З., Косенко А.И. Открытое овальное окно: роль в патогенезе ряда неврологических заболеваний и методы их лечения // Журнал неврологии и психиатрии им. C.C. Корсакова. — 2004. — № 5. — С. 65-68.
33. Калашникова Л.А., Гулевская Т.С., Ануфриев П.Л., Гнедовская Е.В., Коновалов Р.Н., Пирадов М.А. Ишемический инсульт в молодом возрасте, обусловленный стенозирующим расслоением (диссекцией) интракраниального отдела внутренней сонной артерии и ее ветвей (клинико-морфологическое наблюдение) // Анналы клинической и экспериментальной неврологии. - 2009. - № 1. - С. 18-24.
34. Карлов В.А., Сорокина Н.Д., Дрожжина Г.Р. Случай позднего
цереброспинального менинговаскулярного сифилиса с синдромом бокового амиотрофического склероза // Журнал неврологии и психиатрии им. C.C. Корсакова. — 2001. — № 2. — С. 41-43.
35. Касте М. Как улучшить качество медицинской помощи больным с инсультом в общенациональном масштабе? Опыт Финляндии // Журнал неврологии и психиатрии им. C.C. Корсакова. — 2003. — № 9. — С. 65-68.
36. Кистенев Б.А., Максимова М.Ю., Лагутин А.В. Ишемический инсульт у больного, страдающего железодефицитной анемией // Атмосфера. Нервные болезни. — 2007. — № 2. — С. 27-31.
37. Коваленко В.М., Корнацький В.М., Манойленко Т.С. Динаміка
показників стану здоров’я населення за 1995–2005 рр.: Аналітично-
статистичний посібник для лікарів кардіологів, ревматологів, терапевтів загальної практики. — К., 2006. — 72 с.
38. Корнацький В.М. Проблеми здоров’я суспільства та продовження
життя. — К., 2006. — 136 с.
39. Крылов В.В., Гусев В.В., Титова Г.П., Гусев А.С. Сосудистый спазм
при субарахноидальном кровоизлиянии. — М.: Аким. — 2001. — 191 с.
40. Кузнецов А.Н. Ультразвуковая допплеровская диагностика в клинике/Под ред. Ю.М. Никитина, А.И. Труханова. — М., 2004. — С. 182-188.
41. Лурия А.Л. Клиническая нейропсихология.- М.: Издательство МГУ, 1973. – 374 с.
42. Маджидова Е.Н., Сагатов Д.Р. Ранняя реабилитация ишемического инсульта у лиц молодого возраста. – Клиническая неврология. – 2010. - №1. – С. 9-10.
43. Магомедова А.С., Левин Я.И. Особенности вегетативной регуляции у больных ишемическим инсультом молодого возраста // Альманах клинической медицины. - 2001. - № 4. - С. 33-34.
44. Мазина С.С. Церебральная гемодинамика у подростков и лиц молоого возраста с начальными проявлениями недостаточности кровоснабжения головного мозга при первичной артериальной гипертонии. Автореф. дис…канд. мед. наук. 14.01.13 / ГОУ ВПО «Ивановская государственная медицинская академия Федерального агентства по здравоохранению и
социальному развитию» – Иваново, 2006. – 23 с.
45. Мамонова М.Ю., Рижкова І.П., Щеглов Д.В. Сучасні тенденції в
лікуванні ішемічних ускладнень субарахноїдального крововиливу
аневризматичної етіології // Вестник неотложной и восстановительной
медицины — 2005. — № 3. — С. 518-521.
46. Масютина С.М. Качество жизни больных, перенесших инсульт в
мозговом возрасте: Автореф. дис…канд. мед. наук: 14.01.13 / Саратовский
государственный медицинский университет. – Саратов, 2006. – 23 с.
47. Медик В.А. Заболеваемость населения: история, современное
состояние и методология изучения. — М.: Медицина, 2003. — 512 с.
48. Мищенко Т.С. Лечение больных ишемическим инсультом // Здоров’я України. — 2004. — № 19(104). — С. 40-41.
49. Міщенко Т.С. Епідеміологія цереброваскулярних захворювань в
Україні // Судинні захворювання головного мозку. — 2006. — № 1. —С.3-7.
50. Міщенко Т.С. Епідеміологія цереброваскулярних захворювань в
Україні у 2007 р. // Судинні захворювання головного мозку. — 2008. 51. Назаренко В.Г., Джоджуа А.Г., Грищенко С.В. Возрастно-половые
особенности частоты заболевания и смертности от инсульта среди населения крупного промышленного города Донбасса // Вісник проблем біології і медицини. — 2002. — № 6. — С. 49-54.
52. Неретин В.Я., Вострикова И.Л. Острые нарушения мозгового
кровообращения у лиц молодого возраста в московской области // Альманах клинической медицины. - 2001. - № 4. - С. 8-10.
53. Онищенко Е.Ф. Открытое овальное окно и инсульт в клинической
практике. — СПб.: Питер. — 2005.
54. Пизова Н.В., Дмитриев A.H. Дисплазия соединительной ткани и острые нарушения мозгового кровообращения (обзор литертуры) // Журнал неврологии и психиатрии им. C.C. Корсакова. - 2007. - № 6. - С. 147-153.
55. Подсонная И.В., Головин В.А. Особенности течения и исходы
инсультов при артериальной гипертонии у ликвидаторов последствий аварии на чернобыльской АЭС // Современніе проблемі науки и образования. – 2008. - №3. – С. 16-22.
56. Рапопорт С.И., Шаталова А.М., Малиновская Н.К. Продукция
мелатонина у больных гипертонической болезнью // Клиническая медицина. — 2000. — № 6. — С. 21-24.
57. Русина А.В. Медико-социальные особенности больных
трудоспособного возраста, перенесших мозговой инсульт // Український вісник психоневрології. — 2005. — № 4(45). — С. 36-38.
58. Рябова Т.Н., Ширшов Ю.А., Виноградова Т.Е. Эпидемиология и
факторы риска инсульта в молодом возрасте // Бюллетень ВСНЦ СО РАМН. – 2007. - №5(2007). – С.161.
59. Сагатов Д.Р. Маджидова Е.Н. Особенности факторов риска инсульта в молодом возрасте // Практическая неврология и нейрореабилитация. – 2010. - №1. – С.4-6.
60. Соловьев В.С., Соловьева С.В., Наймушина А.Г., Новоселова Т.В.№ 2 тяжести заболевания // Неврологический вестник. – 2007. - №1. – С. 26-30.
70. Фонякин А.В., Суслина З.А., Гераскина Л.А. Кардиологическая
диагностика при ишемическом инсульте. — СПб.: ИНКАРТ, 2005. — 224 с.
71. Фонякин А.В., Глебов М.В., Гераскина Л.А. Незаращенное овальное отверстие и парадоксальная церебральная эмболия // Креативная кардиология. - 2008. - № 2. - С. 5-14.
72. Хохлова О.И. Особенности течения ишемических инсультов у лиц
молодого возраста в зависимости от уровня гомоцистеина // Политравма. - 2006. - № 2. - С. 19-21.
73. Центр медичної статистики МОЗ України. Основні особливості та
тенденції розповсюдження хвороб системи кровообігу та ревматичних
захворювань в Україні за 1998–2007 рр. / Під ред. В.М. Князевича. — К., 2008. — С. 6-10.
74. Чакина Н.В., Ємельянова Е.А., Ботвинников А.Ю., Арсентьева С.В.
Современный подход к лечению геморрагических инсультов у беременных // Медицина неотложных состояний — 2007. — № 6(13). — С. 97-98.
75. Чернишова Т.І. Аналіз причин порушення мозкового кровообігу у
молодих // Український вісник психоневрології. — 2002. — № 1. — С. 145-146.
76. Чухловина М.Л., Гузева В.И., Мацукатова Е.М. Особенности
патогенеза и диагностики геморрагического инсульта у лиц молодог
возраста // Клиническая медицина — 2004. — № 3. — С. 11-14.
77. Яворская С.А., Березин А.С., Дамулин И.В., Тушканова М.В., Левченко А.Г., Шашкова Е.В. Инсульт в бассейне задней мозговой артерии сглазодвигательными расстройствами у больного молодого возраста // Неврологический журнал. - 2007. - № 6. С. 30-35
78. Ямагучи Т. Современное состояние проблемы острого ишемического инсульта в Японии: результаты общенационального госпитального исследования 1999–2000 // Журнал неврологии и психиатрии им. C.C. Корсакова. — 2003. — № 9. — С. 72-74.
79. Albers G.W., Amarenco P., Easton J.D. et al. Antithrombotic and
thrombolytic therapy for ischemic stroke: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy // Chest. — 2004. — 126 (Suppl.). — P. 438-512.
80. Argentine C., Prencipe M. The burden of stroke: a need for prevention // Prevention of Ischemik stroke. — L.: Martin Dunitz, 2006. — P. 1-5. 81. Bezzi G., Bolzani W., Compagnoni V. et al. Factor V Leiden mutation and
patent foramen ovale in ischemic stroke // Neurol. Sci. — 2002. — Vol. 23. — P. 229-231.
82. Cabanes L., Mas J.L., Cohen A. et al. Atrial septal aneurysm and patent
foramen ovale as risk factors for cryptogenic stroke in patients less than 55 years of age. A study using transesophageal echocardiography // Stroke. — 1993. — Vol. 24. — P. 1865-1873.
83. Carod F., Vilela N.S., Portugal D. Thrombophilia and patent foramen ovale in young stroke patients // Neurol. — 2006. — Vol. 21. — P. 710-716.
84. Caste M., Fogeiholm R., Rissanen A. // Publ. Health. — 1998. — Vol.112. — P. 103-112.
85. Chan W.S., Ray J., Wai.K., Ginsburg S., Hannah M.E., Corey P.N.,
Ginsberg J.S. Risk of Stroke in Women Exposed to Low-Dose Oral
Contraceptives: A Critical Evaluation of llie Evidence // Arch. Intern. Med. — 2004. — Vol. 164(7). — P. 741-747.
86. Ciccone A., Melis M., Siritho S., Thrift A.G., McNeil J.J., Davis S.M.,
Donnan G.A. Ischemic Stroke Risk in Oral Contraceptive Users // Response
Stroke. — 2003. — Vol. 34(12). — P. 231.
87. Christie A. Normal closing time of the foramen ovale and the ductus
arteriosus: an anatomical and statistical surgery // Am. J. Dis. Child. — 1930. — Vol. 40. — P. 323-326.
88. Centers for Disease Control. Achievements in public health, 1900–1999: deсline in deaths frоm heart disease and stroke — United States, 1900–1999 // Morbid. Mortal. Weekly Rep. — 1999. — Vol. 48. — Р. 649-656
89. Cujec B., Manira R., Johnson D.H. Prevention of recurrent cerebral ischemic events in patients with patent foramen ovale and cryptogenic strokes or transient ischemic attacks // Can. J. Cardiol. — 1999. — Vol. 15. — P. 57-64.
90. Clatterbuck R.E. Cherry angiomas associated with familial cerebral cavernous malformations // J. Neurosurg. — 2002. — Vol. 5. — P. 964-965.
91. Desai A.J., Fuller C.J., Jesurum J.T., Reisman M. Patent foramen ovale and cerebrovascular diseases // Nat. Clin. Pract. Cardiovasc. Med. — 2006. — Vol 3. — P. 446-455.
92. Furlan A.J. Patent Foramen Ovale and Recurrent Stroke: Closure is the Best Option: Yes // Stroke. — 2004. — Vol. 35. — P. 803-804.
93. Hagen P.T., Scholz D.G., Edwards W.D. Incidence and size of patent
foramen ovale during first 10 decades of life: an autopsy study of 965 normal hearts // Mayo Clin. Proc. — 1984. — Vol. 59. — P. 17-20.
94. Gerhartz B., Abrahamson M. Physico-chemical properties of the Nterminally truncated L68Q cystatin C found in amyloid deposits of brain
haemorrhage patients // J. Biol. Chem. — 2004. — Vol. 2. — P. 301-305.
95. Gilligan A.K., Thrift A.G., Sturm J.W. et al. Stroke units tissue plasminogen activator aspirin and neuroprotection: which stroke intervention could provide the greatest community benefit // Cerebrovasc. Dis. — 2005. — Vol. 20. — Р. 239-244.
96. Gillum L.A., Mamidipudi S.K., Johnston S.C. Ishemic stroke risk with oral contraceptives. A meta-analysis. – JAMA. – 2000. – Vol.284. – P.72—8.
97. Ginneken J.K., Dissevelt A.G., Water H.P.A. Result of two methods to
determine health expectancy in the Netherlands in 1981–1985 // Soc.Med. — 1991. — Vol. 32. — Р. 1129-1136.
98. Homma S., Sacco R.L. Di Tulio M.R. et al. Patent foramen ovale and stroke // Circulation. — 2005. — Vol. 112. — P. 1063-1072.
99. Hoyer L.W. Hemofilia A // N. Engl. J. Med. — 1994. — Vol. 1. — P. 38-47.
100. Howard V.J., Howard G. Stroke incidence, mortality and prevalence. The prevention of stroke / Ed. by P.B. Gorelick, M. Alter // The Parthenon Publishing89. Cujec B., Manira R., Johnson D.H. Prevention of recurrent cerebral ischemic events in patients with patent foramen ovale and cryptogenic strokes or transient ischemic attacks // Can. J. Cardiol. — 1999. — Vol. 15. — P. 57-64. Group. — 2002. — Vol. 1. — P. 1-10.
101. Howard G., Howard V.J. «Non-modifiable» risk factors for stroke: age race sex and geography // The Parthenon Publishing Group. — 2005. — Vol. 2. — P. 11-20.
102. Iso H., Stampfer M.J. et al. Prospective study of fat and protein intake and risk of intraparenchymal hemorrhage in women // Circulation. — 2005. — Vol. 6. — P. 784-786.
103. Jakovlievic D., Sarti C. et al. Risk of stroke in type 1 diabetic subjects in Finland // Eur. J. Neurol. — 2002. — Vol. 9. — P. 32.
104. Kemmeren J.M., Tanis B.C., van den Bosch M.A., Bollen E.L., Helmerhorst EM., van der Graaf., Rosendaal F.R., Algra A. Risk of Arterial Thrombosis in Relation to Oral Contraceptives (RATIO) study: contraceptives and the risk of ischemia stroke // Stroke. — 2002. — Vol. 33. — P. 1202-1208.
105. Kimura K., Kazui S., Minematsu K., Yamaguchi T. For the Japanese
Multicenter Stroke Investigators Collaboration (J-Music): hospital-based
prospective registration of acute ischemic stroke and transient ischemic attack in Japan // J. Stroke Cerebrovasc. Dis. — 2004. — Vol. 1(3). — P. 1-11.
106. Leys D. Atherothrombosis: a major health burden // Сebrovasc. Dis. — 2001. — Vol. 11 — P. 1-4.
107. Liaquat I., Dunn L.T. et al. Effect of apolipoprotein E genotipe on hematoma volume after trauma // J. Neurosurg. — 2002. — Vol. 1. — P. 90-96.
108. Litchfield W.R. et al. Intracranial aneurysm and haemorragic stroke in
glucocorticoid-remediable aldosteronism // Hypertension. — 1998. — Vol. 1. — P. 445-450.
109. Lidegaard O., Kreiner S. Contraceptives and cerebral thrombosis: a five-year national case-control study // Contraception. — 2002. — Vol. 65. — P. 197-205.
110. McEvoy A.W., Kitchen N.D. Intracerebral haemorrage and drug abuse in young adults // Br. J. Neurosurg. — 2005. — Vol. 5. — P. 449-454.
111. Manica G. Prevention and treatment of stroke in patients wit hypertension // Clin. Ther. — 2004. — Vol. 26(5). — Р. 631-648.
112. Marini C., Torato R et al. Stroke in young adults in the community — based L Aquila registry // Stroke. — 2005. — Vol. 3. — P. 450-455.
113. Moruzzo D., Polvani M. Low plasma concentration of thyreoid stimulating hormone is an independent marker of haemorrage stroke // Eur. J. Clin. Invest. — 2005. — Vol. 29. — P. 7-8.
114. Neumann N.P. Multiple intracranial aneurisms in a patient with autosomal recessive polycystic kidney disease // Nephrol. Dial. Transplant. — 1999. — Vol. 4. — P. 936-939.
115. Nilsson O.G., Lindgren A. et al. Incidence of intracerebral and subarachnoid haemorrhage in southern Sweden // J. Neurol. Neurosurg. Psychiatry — 2003. — Vol. 5. — P. 601-602.
116. Obach V. et al. Alpha (1) — antichimotripsin polymorphism: risc factor for haemorragic stroke in normotensive subjects // Stroke. — 2001. — Vol. 11. — P. 2580- 2587.
117. Rudd A.D., Hofman A., Irwin P., Lowe D. Stroke unit care and outcome. Results from the 2001 National Sentinel Audit of Stroke (England, Wales and Northern Ireland) // Stroke. — 2005. — Vol. 36. — Р. 103-106.
118. Rutherford S. et al. Chromosoma 17 and the inducible nitric oxide synthase gene in human essential hypertension // Hum. Genet. — 2006. Vol. 4. — P. 408-415.
119. Sarti C., Rastenyte D., Cepaitis Z. et al. International trends in mortality from stroke, 1968–1994 // Sroke. — 2000. — Vol. 31. — Р. 1588-1601.
120. Solohiemo P., Juvela S. Use of aspirin, epistaxis, and untreated hypertension as risk factors for primary intracerebral haemorrhage in middle-aged and elderly people // Stroke. — 2004. — Vol. 2. — P. 399.
121. Stone S. Stroke units: Every patient with a stroke be treated in a stroke unit // Brit. Med. J. — 2002. — Vol. 325. — P. 291-292.
122. Thomas D.J. Migraine and ischaemic stroke // BMJ. — 2005. — Vol.
330(7482). — P. 54-55.
123. Warlou C., Sudlow C., Dennis M. et al. Stroke // Lancet. — 2003. —
Міні-дослідження розумового стану (тест MMSE)
Показники Оцінка в балах
Додаток -А
1. ОРІЄНТАЦІЯ
– назвати дату (рік, місяць, число, день тижня, час) -5
–назвати місцезнаходження (країна, місто, вулиця, відділення) -5
2. СПРИЙНЯТТЯ
–проводячи обстеження, називають три слова (наприклад яблуко, -1
стіл, олівець), після чого хворий повинен повторити їх, кожну -1
правильну відповідь оцінюють в один бал. Далі хворого просять запам’ятати ці три слова (повторювати, поки не будуть відтворені
правильно-3
3. УВАГА ТА ЛІЧИЛЬНІ ВЛАСТИВОСТІ
–відняти від 100 число 7, після чого з залишку знов віднімають 7,
і так п’ять разів (100–7; 93–7; 86–7; 79–7; 72–7)
Альтернативне завдання — вимовити слово із 5 літер, наприклад
слово «ПАСТА», за зворотними літерами — «АТСАП-5
4. ПАМ’ЯТЬ
– назвати 3 слова, які запам’ятали при виконанні
другого завдання-3
5. МОВА, ЧИТАННЯ, ПИСЬМО
– назвати два предмети (наприклад олівець та годинник) -2
– повторити «ніяких якщо, але або ні» 1
– 3-етапна команда (наприклад: «Підніміть вказівний палець
правої руки, доторкніться ним до носа, далі до Вашого лівого
вуха») -3
– прочитати та виконати надруковане на папері завдання:
«Закрийте очі» -1
–написати речення (один бал ставиться, коли речення має
підмет і присудок та логічне за змістом) -1
– перемалювати малюнок (два п’ятикутники, що перетинаються)- 1
Оцінювання результатів:
28-30 – Норма
24-27 – когнітивні порушення
20-23 – легка деменція
11-19 – помірна деменція
0-10 – тяжка деменція
Додаток В.
1.
0. Я не почуваю себе печальним.
1. Я почуваю себе печальним.
2. Я почуваю себе печальним весь час і не можу
вийти з цього стану.
3. Я почуваю себе настільки печальним і
нещасним, що більше не можу цього виносити.
2.
0. Я не дуже розчарований у своєму майбутньому.
1. Я відчуваю себе розчарованим у своєму майбутньому.
2. Я відчуваю, що у мене немає нічого доброго у майбутньому.
3. Я відчуваю, що моє майбутнє безнадійне і ніщо не зможе покращити стан справ.
3.
0. Я не відчуваю себе невдахою.
1. Я відчуваю себе більшим невдахою, ніж інші люди.
2. Коли я звертаюся до мого минулого життя, я
бачу лише чисельні помилки, які я зробив.
3. Я відчуваю себе абсолютною невдахою.
4.
0. Я отримую таке ж задоволення від життя, як
отримував і раніше.
1. Я не радуію життю так, як це було раніше.
2. Я більше не від чого не отримую у житті
задоволення.
3. Я у всьому розчарувався і мені все набридло.
5
0. Я не відчуваю себе винним.
1. Я не відчуваю себе винним більшу частину часу.
2. Я відуваю себе винним більшу частину часу.
3. Я відчуваю себе винним весь час.
6.
0. Я не відчуваю себе покараним.
1. Я відчуваю себе , що може я покараним.
2. Я відчуваю себе покараним більшу частину часу.
3. Я відчуваю себе покраним.
7.
0. Я не відчуваю себе розчарованим у самому собі.
1. Я розчарован у собі.
2. Я сам собі огидний.
3. Я себе ненавиджу.
8.
0. Я не відчуваю себе гірше за інших.
1. Я ставлюсь до себе критично за свою слабкість,
або помилки.
2. Я весь час звинувачую себе за свої помилки.
3. Я звинувачую себе за погане, що трапляється.
9.
0. У мене не буває думок покінчити життя
самогубством.
1. У мене з"являються думки про самогубство, але
я ніколи цього не зроблю.
2. Мені хотілося б себе вбити.
3. Я б вбив себе, якщо б мав таку нагоду.
10.
0. Я не плачу більше, ніж звичайно.
1. Я плачу більше, ніж звичайно.
2. Я плачу тепер весь час.
3. Я раніше міг плакати, але зараз не можу навіть,
якщо дуже хочеться.
11.
0. Я не відчуваю себе зараз більш роздратованим,
ніж раніше.
1. Я став більш запальним і роздратованим, ніж
раніще.
2. Я роздратований весь час.
3. Мене зараз зовсім не дратує те, що дратувало
раніше.
12.
0. Я не загубив інтересу до інших людей.
1. Я менше цікавлюся іншими людьми, ніж раніше.
2. Мене не цікавлять інші люди.
3. Я загубив будь-який інтерес до інших людей.
13.
0. Я приймаю рішення так само добре, як і раніше.
1. Я відмовляю у прийнятті рішень частіше, ніж
раніше.
2. Я відчуваю значно більшу виваженість у принятті
рішень, ніж раніше.
3. Я зовсім не можу приймати рішень.
14.
0. Мені не здається, що я виглядаю гірше, ніж
раніше.
1. Мене хвилює, що я виглядаю по-старому,
непривабливо.
2. Мені здається, що у моїй зовнішности сталися
незворотні зміни, з-за чого я виглядаю
непривабливо.
3. Я певен, що виглядаю жахливо
15.
0. Я можу працювати також добре, як працював
раніше.
1.Треба докласти деякі зусилля, щоб приступити до
справи.
2. Я повинен себе примусити щось зробити.
3. Я зовсім не можу виконувати будь-яку роботу.
16.
0. Я сплю добре, як і раніше.
1. Я не сплю так добре, як раніше.
2. Я прокидаюся на 1-2 години раніше, ніж
звичайно, і після цього погано засинаю.
3. Я прокидаюся на декілька годин раніше, ніж
звичайно, і після цього не можу заснути.
17.
0. Я не втомлююся більше, ніж звичайно.
1. Я втомлююся швидше, ніж звичайно.
2. Я втомлююся від будь-якої роботи.
3. Я відчуваю себе таким втомленим, що нічого не
можу робити.
18.
0. Мій апетит зараз набагато гірший, ніж звичайно.
1. Мій апетит на такий добрий, як був раніше.
2. Мій апетит став набагато гіршим.
3. У мене зовсім пропав апетит.
19.
0. У мене немає помітної втрати ваги.
1. Я втратив більше 5 фунтів.
2. Я втратив більше 10 фунтів.
3. Я втратив більше 15 фунтів.
Я спеціально намагався схуднути
Так Ні
20.
0. Я не турбуюсь про своє здоров"я більше, ніж
раніше
1. Я став турбуватися про проблеми свого здоров"я,
а саме, про болі, неспокійном шлунку, закрепах.
2. Я дуже турбуюся своїм здоров"ям і не можу
думати ні про що інше.
3. Я настільки турубуюся своїм здоров"ям, що не в
змозі взагалі ні про що думати.
21
0. Я не помічаю ніяких змін в моєму бажанні мати
секс.
1. Я менше цікавлюся сексом, ніж раніше.
2. Я значно менше цікавлюся сексом зараз.
3. Я взагалі загубив будь-який інтерес до сексу.
Оцінювання:
0-10 - м’які коливання настрою
11 -16- м’які порушення настрою
17-20 - клінічно суміжна депресія
21 - 30 - депресія середнього ступеня важкості
31- 40 - тяжка депресія
41 - 63 - депресія крайнього ступеню важкості

про публікацію авторської розробки
Додати розробку
