Сульфатна кислота. Будова молекули, фізичні і хімічні властивості розведеної і концентрованої кислоти: взаємодія з металами, основними і амфотерними оксидами.
У запропонованій розробці викладено матеріал про сульфатну кислоту, її будову молекули, фізичні і хімічні властивості розведеної і концентрованої кислоти. Водовідбирні властивості.
Тема: Сульфатна кислота. Будова молекули, фізичні і хімічні властивості розведеної і концентрованої кислоти: взаємодія з металами, основними і амфотерними оксидами, гідроксидами та солями. Водовідбирні властивості.
Мета:
- визначити особливості будови молекули, фізичні властивості сульфатної кислоти;
- повторити загальні хімічні властивості неорганічних кислот на прикладі хімічних реакцій розведеної сульфатної кислоти з індикаторами, металами, оксидами, основами;
- показати відмінність хімічних властивостей розведеної і концентрованої сульфатної кислоти;
- продовжити формування навичок роботи з хімічними речовинами, перевірити знання з техніки безпеки при роботі з кислотами, акцентувати увагу на особливій небезпечності сульфатної кислоти.
- розвивати в учнів креативні здібності, логічне мислення, пам’ять, уміння робити узагальнення і висновки;
- виховувати зацікавленість предметом, старанність та наполегливість.
Тип уроку: комбінований (урок – дослідження).
Форми роботи: розповідь учителя, демонстрація, лабораторний експеримент, керована практика.
Обладнання: пробірки, пробіркотримач, спиртівка, стакан, скляна паличка, сульфатна кислота (10% і 35% розчини), лакмус, метилоранж, фенолфталеїн, цинк (гранули), мідь (ошурки), магній оксид, купрум (ІІ) оксид, натрій гідроксид, цукор.
Хід уроку:
І. Організаційний момент.
Доброго дня, дорогі діти! У цей чудовий день та час я рада бачити вас у гарному настрої та доброму здоров’ї. Сподіваюся, сьогоднішній урок не стане цьому на заваді. На листках оцінювання, що є у вас на партах, підкресліть піктограму, що відповідає вашому настрою.
- Етап актуалізації опорних знань, перевірка домашнього завдання.
Метод «Вірю-не вірю»
Чи вірите ви, що…
1. Найвища валентність Сульфуру VI (+)
2. Формула сірчистого газу SO3 (-)
3. Формула сульфідної кислоти H2S (+)
4. При розчиненні Сульфур (ІV) оксиду у воді утворюється сульфатна кислота (-)
5. Оксиди Сульфуру погано розчиняються у воді (-)
( Взаємоперевірка із занесенням результатів у листок оцінювання)
ІІ. Етап мотивації навчальної діяльності.
Сьогодні мова піде про неорганічну кислоту, яка вам всім добре відома. (Учитель демонструє склянку з кислотою).
Відомо, що ще в 19ст. ця речовина використовувалася як симпатичне чорнило, для тайнопису.
На планеті, біля підніжжя вулканів, існують цілі озера з розчином цієї кислоти. Вона добре була відома алхімікам. А Дмитро Іванович Менделєєв назвав її «купоросною олією». Вона є досить агресивною речовиною, потребує обережного поводження! Реагує з металами, але перевозять її у металевих цистернах.
Подивіться на сторінки довідника з хімії (учитель демонструє книгу), її сторінки у дірках! Яка речовина це зробила? Пропоную знайти відповідь на це питання. Скажу лише те, що молярна маса цієї кислоти становить 98 г/моль, W(H) = 2,04%, W (S) = 32,65%, W (O) = 65,31%.
Провівши розрахунки, ви зрозуміли, що сьогодні піде мова про сульфатну кислоту! Перелічені властивості ви зможете пояснити в кінці уроку. Наше завдання на сьогодні – розглянути будову молекули сульфатної кислоти, встановити її фізичні і хімічні властивості (загальні і специфічні)., а також застосування. Отже - починаємо!
ІІІ. Етап засвоєння нових знань.
3.1. Розповідь учителя.
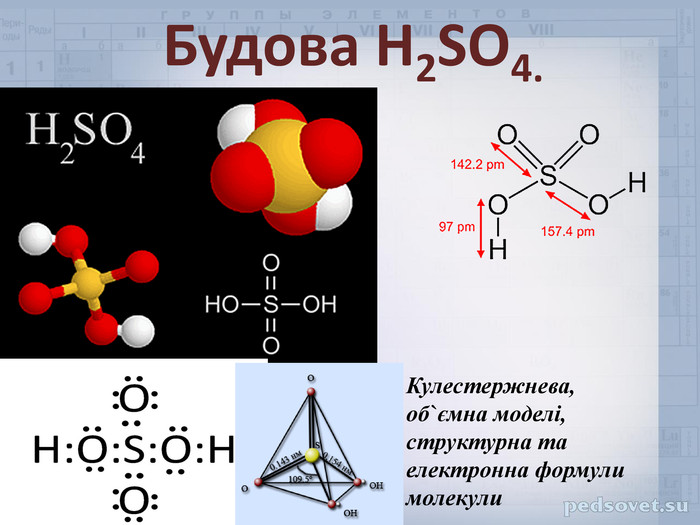
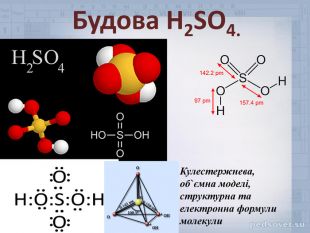
Властивості будь якої речовини не можливо вивчити, якщо невідома її будова. Саме будова молекул речовин визначає їх властивості. Розглянемо молекулу сульфатної кислоти, схематично ми можемо її зобразити наступним чином:
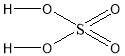
Ступінь окислення Сульфуру у молекулі сульфатної кислоти становить +6. Це найвищий ступінь окиснення атома Сульфуру. Атом Сульфуру може лише відновлюватись, тобто знижувати свій ступінь окиснення, і завдяки цьому окислювати інші атоми. Це означає що сульфатна кислота є сильним окисником. Однак, структурна формула кислоти, яку ми записали не є вірною. Насправді у просторі молекула H2SO4 не плоска, а має форму тетраедру.
Учитель.
Тепер, коли ми встановили будову молекули сульфатної кислоти, перейдемо до вивчення її властивостей.
Перш за все встановимо її фізичні властивості. Для цього розгляньте публікацію увас на партах і виберіть інформацію, що стосується фізичних властивостей.
Один учень описує властивості сульфатної кислоти. Орієнтовна відповідь: безбарвна важка рідина, схожа на олію. Добре розчиняється у воді, під час розчинення виділяється велика кількість теплоти. Не летка. Не має запаху.
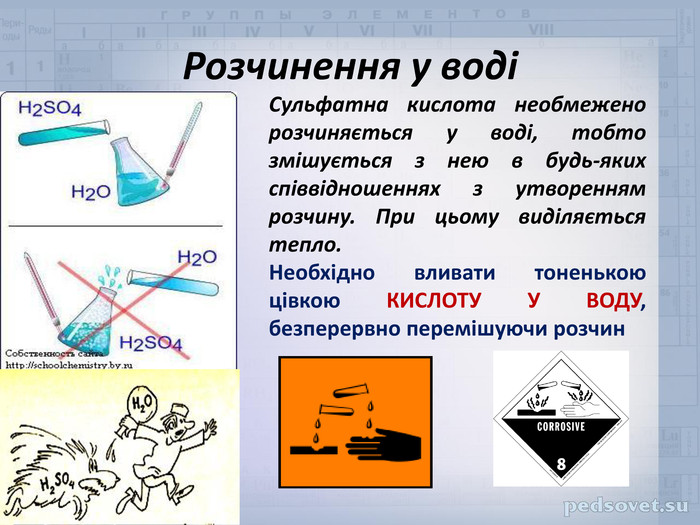
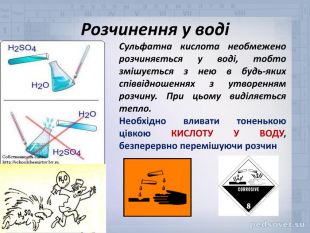
Учитель. Погляньте на малюнки, і виберіть той, на якому показано вірне змішування води і кислоти. Поясніть ваш вибір.
Орієнтовна відповідь: Вірним є малюнок 2, треба додавати кислоту у воду, а не навпаки. Кислота є важчою за воду, і осідає на дно стакану. Як що додавати воду до кислоти, то легка вода залишиться над кислотою, за рахунок розчинення виділяється велика кількість тепла, якого вистачає для закипання води. Краплі кислоти разом з водою, можуть потрапити на шкіру, одяг тощо.
Учитель. На склянці з сульфатною кислотою (показує склянку і знак у збільшеному форматі) є знак:
Поясніть, чому знак наклеєно на склянку.
Орієнтовна відповідь: Сульфатна кислота досить агресивна речовина, може викликати хімічні опіки шкіри, роз’їдати металеві, дерев’яні поверхні.
Проблемне питання: Чи можна в разі потрапляння на шкіру конц. сульфатної кислоти відразу змивати її водою?
Відповідь: Спочатку треба промокнути кислоту серветками із тканини і тільки тоді залишки змити великою кількістю води, а потім нейтралізувати розчином питної соди. Якщо змивати одразу, то можна отримати ще й тепловий опік.
Учитель.
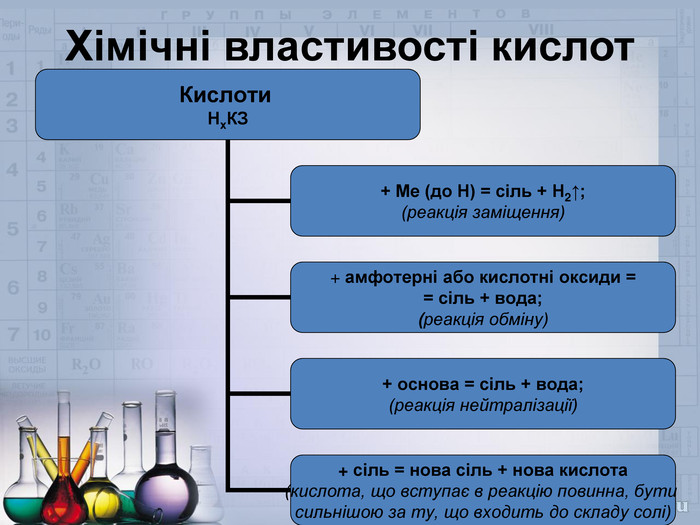
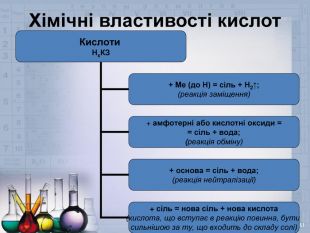
Далі перейдемо до хімічних властивостей. Сульфатна кислота має властивості схожі з іншими неорганічними кислотами, і властивості специфічні, які притаманні лише їй. Спочатку розглянемо загальні – не специфічні властивості. Проведемо певні досліди і зробимо висновки.
- Дія розчину сульфатної кислоти на індикатори – лакмус і метилоранж.
- Дія розчину сульфатної кислоти на метали – цинк і мідь
- Дія розчину сульфатної кислоти на основні оксиди – ферум (ІІІ) оксид і купрум (ІІ) оксид.
- Дія розчину сульфатної кислоти на розчин лугу – Натрій гідроксиду, і нерозчинну основу – Ферум (ІІІ) гідроксид.
- Дія розчину сульфатної кислоти на солі більш слабких кислот – магній карбонату, натрій сульфіту.
(Вдома до записаних молекулярних рівнянь напишете повні та скорочені йонні)
- Якісна реакція на сульфат-йон
Інструкція до лабораторного досліду
Якісна реакція на сульфат-йон
Обладнання: пробірки, піпетки, сульфатна кислота (10% розчин), розчини барій хлориду, натрій сульфату, нітратної кислоти
Дослід 1.
За допомогою піпетки налийте у планшетку 1-2 краплі розчину Натрій сульфату, в іншу – розбавленого розчину сульфатної кислоти. Додайте декілька крапель розчину барій хлориду. Що спостерігаєте? Напишіть рівняння реакцій в молекулярній та йонній формах.
Дослід 2.
Додайте до осадів кілька крапель нітратної кислоти. Чи розчиняються осади? Відповідь обґрунтуйте.
Після виконання серії дослідів ми впевнилися, що розчин сульфатної кислоти має хімічні властивості, які притаманні і іншим кислотам.
Проблемне питання: Чи залежать хімічні властивості речовини від концентрації? Чи зміняться властивості сульфатної кислоти, якщо для дослідів використовувати концентровану кислоту?
Орієнтовна відповідь: так, хімічні властивості кислот повинні залежати від концентрації, тому що чим більше концентрація кислоти, тим менше її ступінь дисоціації . Тобто, концентрована кислота не розпадається на йони – отже і властивості повинні бути інші.
Розповідь учителя.
Так, концентрована сульфатна кислота має зовсім інші хімічні властивості. Розглянемо деякі з них. Концентрована сульфатна кислота енергійно реагує з водою, в результаті реакції утворюється гідрат кислоти, і виділяється велика кількість тепла
Учитель.
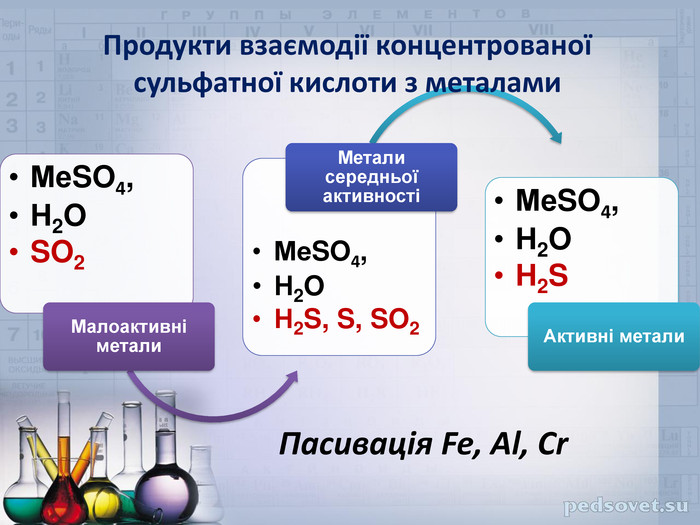
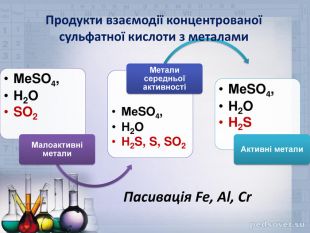
Концентрована сульфатна кислота – сильний окисник. При нагріванні вона реагує майже з усіма металами, навіть і тими, які у ряді напруг металів знаходяться за Гідрогеном. Виключення складають лише золото і платина. У таких реакціях не виділяється водень, замість нього утворюється один з продуктів відновлення сульфатної кислоти. У якості прикладу розглянемо, взаємодію міді з 35%-ною сульфатною кислотою. При нагріванні бачимо, що розчин забарвлюється у блакитний колір (Чому?).
Сu + 2H2SO4 = CuSO4 + SO2 + 2H2O
Видно, що у данному випадку атом Сульфуру, у молекулі сульфатної кислоти – S+6 відновився до S+4 у Сульфур (IV)оксиді. Можемо записати:
S+6 +2e = S+4.
Учитель.
Більш активні метали, можуть відновлювати атом Сульфуру до ступенів окиснення 0, -2. Розглянемо реакцію взаємодії магнію з концентрованою сульфатною кислотою: Mg + H2SO4 = MgSO4 + H2S + H2O
Учень біля дошки складає електронний баланс для цієї реакції, і розставляє коефіцієнти у рівнянні реакції:
![]()
![]()
![]()
![]() Mg0 – 2e = Mg+2 2 8 4 окиснення, відновник
Mg0 – 2e = Mg+2 2 8 4 окиснення, відновник
S+6 + 8e = S-2 8 2 1 відновлення, окисник
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
Проблемне питання. На початку уроку прозвучало твердження, що дана речовина реагує з металами, але перевозять її у сталевих цистернах. Як це можна пояснити?
Досить цікавим є те, що концентрована кислота (з концентрацією 75% і вище) за кімнатної температури не взаємодіє з деякими металами, наприклад, залізом, алюмінієм і хромом. Справа у тому, що безводна кислота пасивує поверхню металу. Поверхня металу вкривається оксидною плівкою, яка частково, або майже повністю припиняє процес корозії металу кислотою. Це дозволяє перевозити сульфатну кислоту у стальних цистернах.
Концентрована сульфатна кислота здатна обвуглювати органічні речовини. Згадаємо книгу, яку ми розглядали на початку уроку – краплі сульфатної кислоти, які потрапили на сторінки – пошкодили їх.
Учитель.
Досить цікавою є реакція взаємодії сульфатної кислоти з цукром. Для її проведення у стакан насиплемо близько 30 г цукру, вставимо скляну паличку і додамо невелику кількість 35% розчину сульфатної кислоти, щоб утворилася «каша». Через деякий час суміш стає чорною, і починає повзти уверх по скляній паличці. Сульфатна кислота – обвуглила цукор до елементарного вуглецю. Рівняння реакції:
C12H22O11 + 2H2SO4 = 11C + CO2 + 2SO2 + 13 H2O (відео)
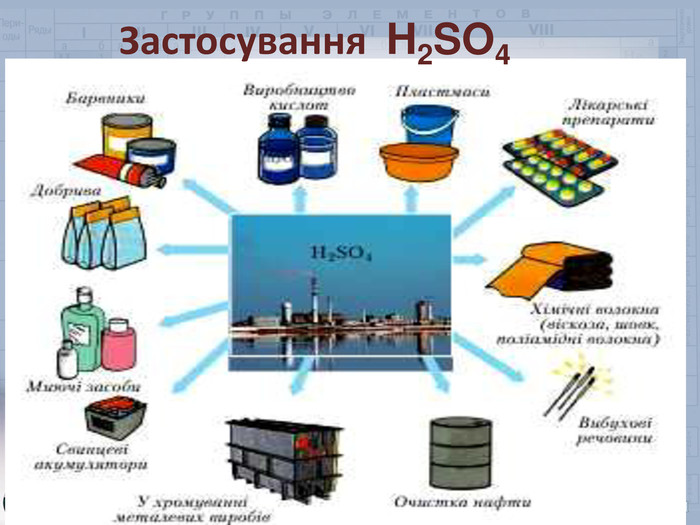
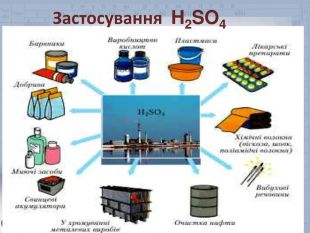
Робота зі схемою На столах є публікації «Її величність сульфатна кислота». Озвучимо галузі її застосування.
Учитель Ми склали сьогодні майже оду сульфатній кислоті. Чи дійсно все так добре? А який вплив її на навколишнє середовище?
- Кислотні дощі
- - Вони сприяють підвищенню кислотності ґрунтів і зниженню врожаїв, збільшенню кислотності водойм і загибелі його мешканців.
- Найдрібніші крапельки сульфатної кислоти можуть утворюватися в середніх і верхніх шарах атмосфери в результаті реакції водяної пари і вулканічного попелу, що містить великі кількості сірки. Суспензія, що утворилася, затрудняє доступ сонячних променів до поверхні планети.
- Кислотні дощі спричинюють корозію металів, руйнують лакофарбові покриття.
- Під їх згубною дією руйнуються будівельні матеріали, пам'ятники архітектури.
- Етап закріплення нових знань.
Завдання 1 (виконується усно.)
Раніше між дерев`яними рамами вікон інколи розміщували склянку з концентрованою сульфатною кислотою. Чому склянки не наповнювали до країв? Орієнтовна відповідь: концентрована сульфатна кислота дуже гігроскопічна речовина, поглинає воду навіть з повітря.
Завдання 2 («Так – ні»)
- Розчин сульфатної кислоти є слабким електролітом.
- При розчиненні концентрованої H2SO4 кислоту приливають до води.
- Концентрована H2SO4 є дуже леткою.
- Концентрована H2SO4 активно взаємодіє із залізом.
- Розведена H2SO4 не взаємодіє з міддю.
- Розведена H2SO4 змінює забарвлення лакмусу на червоний.
- Якісним реактивом на сульфат-йон є солі Барію.
- Внаслідок взаємодії конц. H2SO4 із сріблом одним із продуктів є SO3.
- Олеум – це розчин SO2 у концентрованій H2SO4 .
- При взаємодії розведеної H2SO4 з металами ніколи не виділяється водень.
- Розведена H2SO4 не взаємодіє із нерозчинними основами.
Ключ до розв`язку
1 2 3 4 5 6 7 8 9 10 11
- + - - + + + - - - -
Завдання 3 Метод «Гронування»
На дошці намальоване гроно винограду. У кожну ягідку записується властивість
- Нелетка;
- Важка;
- Оліїста;
- Їдка;
- Обвуглення;
- Розігрівання;
- Взаємодіє з Ме;
- Утворює олеум
- Вз. з МеО;
- Вз з МеОН
- Дисоціює
Завдання 4. Метод «Хімічна естафета»
На дошці записані два ланцюжки перетворень. Змагання по варіантах, учні по черзі виходять до дошки.
- S → SO2 → SO3 → К2SO4
- SO3 → H2SO4 → Na2SO4 → ВаSO4
Завдання 5. Самостійна робота
На листках оцінювання зі зворотної сторони є диференційовані завдання. Виберіть те, що вам під силу і виконайте його
Чи знаєте ви, що…
- Сульфатна кислота використовується у харчовій промисловості як харчова добавка Е513
- Хмари сульфатної кислоти становлять значну частину покриву планети Венера.
- Сірники з`явилися у 1806 році й запалювалися з допомогою сульфатної кислоти.
- Деякі голожаберні молюски, захищаючись, виділяють зі своїх залоз речовину, що впливає на шкірні покриви й органи кривдника.
- Озеро смерті, що знаходиться на острові Сицілія, — саме "мертве" на Землі. Береги озера позбавлені рослинності, а в його водах немає нічого живого. Будь – яка істота, що потрапила в його води, миттєво гине. Коли був зроблений аналіз води, то виявилось, що в ній у великій кількості міститься сірчана кислота.
- Вулканічне кратерове озеро Каваг Ієн на острові Ява, що в Індонезії, переповнене концентрованою сульфатною кислотою – найбільша природна кислотна водойма у світі.
- Домашнє завдання.
- Написати йонні рівняння до прикладів хімічних реакцій, записаних на уроці
- Рівняння окисно-відновних реакцій урівняти методом електронного балансу
- Дослідити, які харчові продукти містять харчову добавку Е 513.
- Випереджаюче завданння. Підготувати повідомлення на теми: «Мийні та відбілюючі сульфуровмісні речовини, їх дія», «Роль сульфуровмісних речовин у виготовленні транспортних засобів».
- Підсумки .
Мікрофон: На сьогоднішньому уроці мені найбільше сподобалось…
Вправа «Настрій» Чи побільшало усмішок? Обведіть піктограму


про публікацію авторської розробки
Додати розробку