Тема: Хімічні властивості амфотерних гідроксидів: взаємодія з кислотами, лугами (в розчині, при сплавлянні). Демонстрації 14. Доведення амфотерності цинк гідроксиду.
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ЦЕНТРАЛЬНОУКРАЇНСЬКИЙ ДЕРЖАВНИЙ ПЕДАГОГІЧНИЙ УНІВЕРСИТЕТ ІМЕНІ ВОЛОДИМИРА ВИННИЧЕНКА
“ЗАТВЕРДЖУЮ”
Груповий методист : Форостовська Т. О
Вчитель хімії: ________
«____»________________2022 р
КОНСПЕКТ УРОКУ
з хімії у 8 –Б класі
з теми : «Хімічні властивості амфотерних гідроксидів: взаємодія з кислотами, лугами (в розчині, при сплавлянні).»
студентки - практикантки IV курсу
факультету математики, природничих наук та технологій
спеціальність 014 Середня освіта (Біологія та здоров’я людини)
Осікової Марини Володимирівни
Дата проведення:
“______” _________________ 2022 року
Оцінка вчителя _______ ____________
(підпис вчителя)
Урок 6. Тема: Хімічні властивості амфотерних гідроксидів: взаємодія з кислотами, лугами (в розчині, при сплавлянні). Демонстрації 14. Доведення амфотерності цинк гідроксиду.
Мета уроку:
- освітня – розглянути поняття амфотерності як здатності сполук проявляти двоїсті властивості: і кислот, і основ;
- виховна – виховувати пізнавальний інтерес до предмета;
- розвиваюча – розвивати мислення учнів, вміння робити висновки; підвищувати творчу активність учнів; сприяти розвитку інтересу до вивчення предмета.
Базові поняття та терміни: амфотерні гідроксиди, амфотерність, кислотність, основи.
Тип уроку: Комбінований урок.
Методи навчання, методичні прийоми, педагогічні техніки, педагогічні технології.
словесні: бесіда, розповідь, пояснення
наочні: презентація
практичні: виконання вправ
Обладнання: періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності неорганічних речовин у воді, картки, розчини хлоридної кислоти, натрій гідроксиду, ферум (ІІ) хлориду, цинксульфату, купрум (ІІ ) хлориду; пробірки, штативи.
Структура уроку:
1). Організаційна частина (2хв)
2). Актуалізація опорних знань та їх корекція (5хв)
3). Мотивація та стимуляція навчальної діяльності (5хв)
4). Пояснення нового матеріалу (15хв)
5). Діагностика рівня засвоєних учнями знань і навичок та їх кореляція . (7хв)
6). Закріплення нового навчального матеріалу (5 хв)
7) Підведення підсумків уроку ( 3 хв )
8) Пояснювальне ознайомлення з домашнім завданням. (3 хв)
Хід уроку
- Організаційна частина
- Актуалізація опорних знань та їх корекція
(«Ланцюжок відповідей на запитання»)
Учні по черзі відповідають на запитання:
1. Це метал, про який піде мова сьогодні на уроці. Він стоїть у 3 періоді, ІІІ групі Періодичної системи хімічних елементів.(Алюміній)
2. Хімічні реакції, що відбуваються між простими і складними речовинами, в процесі яких атоми простої речовини заміщують атоми одного з елементів у складній речовині, утворюючи нову просту і нову складну речовини, називають…(Заміщення)
3. Індикатор, який змінює своє забарвлення на малинове у лужному середовищі, називають…(фенолфталеїн)
4. Складні речовини, які складаються з двох хімічних елементів, один з яких Оксиген, з валентністю ІІ, називають…( оксиди)
5. Складні речовини, які складаються з йонів Гідрогену, які можна замінити йонами металічних елементі, та кислотного залишку…(кислоти)
6. Назва кислоти, яка має формулу HPO3…(мета фосфатна )
7. У присутності кислот розчин метилоранжу забарвлений у …( червоний)
8. Складні речовини, які складаються з йонів металічного елемента й одного або кількох гідроксид-іонів ОН-…(основи)
9. Реакції, у яких дві речовини обмінюються своїми частинами, називають реакціями…(обміну)
10. Складні речовини, які складаються з йонів металічних елементів і кислотних залишків, називають…(солі)
11. Речовини, які змінюють своє забарвлення відповідно від середовища, називають… (індикатори)
12. Хімічний елемент, який утворює лише основний оксид. Він стоїть у ІІ групі, головній підгрупі, 4 періоді, називають…(кальцій)
3). Мотивація та стимуляція навчальної діяльності
В природі існує велика кількість явищ, які знаходяться як то кажуть «на межі». Наприклад, є ніч і є день, а між ними – сутінки; є літо, є зима, а між ними – осінь чи весна.
Перед учнями ставиться проблемне питання:
- Чи існують такі гідроксиди, які одночасно поєднують у собі і кислотне і основне?
Учні висловлюють свої думки. Вчитель вказує на те, що відповіді на питання ми отримаємо сьогодні на уроці.
Записуємо тему уроку: «Хімічні властивості амфотерних гідроксидів: взаємодія з кислотами, лугами (в розчині, при сплавлянні). Демонстрації 14. Доведення амфотерності цинк гідроксиду.»
4). Пояснення нового матеріалу
Луги і більшість нерозчинних основ взаємодіють з кислотами і не взаємодіють з представниками свого класу. Кислоти взаємодіють з основами і не взаємодіють з іншими кислотами. Перевіривши експериментально з якими речовинами взаємодіє дана речовина, а з якими – ні, можна з упевненістю сказати: до класу основ, чи до класу кислот вона належить. Це загальне правило. Проте воно має виняток, зрозуміти який нам допоможуть досліди з цинк гідроксидом.
До яких основ належить цинк гідроксид за здатністю розчинятися у воді? (основа нерозчинна у воді). Цинк гідроксид ще й амфотерний. Що це за властивість? Ми з вами зараз дізнаємось.
Деякі гідроксиди залежно від того, з якими речовинами вони реагують, виявляють основні або кислотні властивості. Такі сполуки називають амфотерними.
Здатність сполуки виявляти основні та кислотні властивості називають амфотерністю.
Демонстрація 14. Доведення амфотерності цинк гідроксиду
Реактиви та обладнання: розчин ZnCl2, розчин NaOH, розчин Н2SO4; дві хімічні склянки.
Дослід 1. У хімічні склянки наллємо розчин цинк хлориду й додаватимемо невеликими порціями розчин натрій гідроксиду до видимих змін. Що спостерігаємо? (утворення осаду)
Рівняння реакції: Zn Cl2 + 2NaOH = Zn(OH)2↓ + NaCl
Дослід 2. У першу хімічну склянку з цинк гідроксидом додамо розчину сульфатної кислоти. Що спостерігаємо? ( осад відразу зникає, що є ознакою перебігу хімічної реакції)
Рівняння реакції: Zn(OH)2 + Н2SO4 = ZnSO4 + 2H2O (реакція обміну)
Висновок: відбулася реакція нейтралізації, в якій цинк гідроксид виявляє властивості основи.
Дослід 3. У другу хімічну склянку з цинк гідроксидом додамо розчин натрій гідроксиду. Що спостерігаємо? (осад зник – ознака хімічної реакції)
Отже, два гідроксиди провзаємодіяли між собою. Який тип хімічної реакції? (реакція сполучення)
Рівняння реакції: Zn(OH)2 + 2 NaOH → Na2 [Zn(OH)4 ]
натрій тетрагідроксоцинкат
Утворилася сіль натрію, в якій замість звичного кислотного залишку є залишок, що містить один атом цинку та чотири (тетра) гідроксильні групи. Залишок такого виду записують у квадратних дужках.
Висновок:у цій реакції цинк гідроксид відіграв роль кислоти, бо металічний елемент Цинк після реакції увійшов до складу кислотного залишку.
Амфотерні гідроксиди реагують з лугами не лише в розчині, а й у розплаві:
t0
Zn(OH)2 + 2 NaOH → Na2ZnO2 + 2H2O
як кислота (H2ZnO2) натрій цинкат
Утворена сіль має двовалентний кислотний залишок ZnO2(ІІ). Наявність у ньому Цинку доводить, що при сплавлянні з лугом цинк гідроксид виявив властивості кислоти.
Висновок. Проведені досліди свідчать, що поділ складних неорганічних речовин на оксиди, кислоти, основи, солі не позбавлений винятків. Трапляються речовини зі змішаними властивостями – амфотерні оксиди, гідроксиди.
Амфотерні властивості можуть виявляти оксиди й гідроксиди деяких металічних елементів у ступенях окиснення +3 та +4: Алюміній(+3), Ферум(+3), Хром(+3), Титан(+4) та інші. Певним виключенням є амфотерні властивості у металічних елементів зі ступенем окиснення + 2 . Серед них Берилій, Цинк, Станум(+2), Плюмбум(+2).
Отже, до амфотерних оксидів належать: Al2O3, BeO, ZnO, PbO, Cr2O3, Fe2O3.
До амфотерних гідроксидів: Al(OH)3, Be(OH)2, Zn(OH)2, Pb(OH)2, Fe(OH)3.
Чим пояснити явище амфотерності? Розглянемо будову цинк гідроксиду.
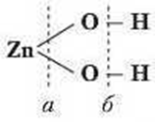
З графічної формули видно, що хімічні зв’язки утворюються між атомами Цинку й атомами Оксигену та між атомами Оксигену й Гідрогену. Ученими доведено, що сила цих зв’язків приблизно однакова. Тому під час взаємодії з кислотами розрив зв’язку відбувається по лінії а, з лугами — по лінії 6. Це підтвердження того, що властивості речовин залежать не тільки від їх складу, а й від будови.
Тобто амфотерні гідроксиди реагують залежно від другого реагенту: з лугами - як кислоти, а з кислотами – як основи з утворенням солі відповідного складу.
5). Діагностика рівня засвоєних учнями знань і навичок та їх кореляція
Завдання 1. Складіть формули амфотерних сполук.
|
Амфотерні елементи |
|
|
|
|
|
|
Амфотерний оксид цього елемента |
ZnO |
|
|
|
|
|
Амфотерний гідроксид цього елемента |
Zn(OH)2 H2ZnO2 |
|
|
|
|
Завдання.2 В кожному рядку вилучіть зайву формулу:
а) HNO3, H2S, Zn(OH)2, H2CO3;
б) BeO, Al2O3, Na2O, Cr2O3;
в) CuO, ZnO, MgO, CaO;
г) NaOH, Zn(OH)2, Al(OH)3, Be(OH)2.
Завдання.3 Допишіть рівняння реакцій:
а) BeO + …→ Be(NO3)2 +H2O
б) BeO + KOH → K2BeO2 + …
в) Be(OH)2 + …→ BeSO4 + H2O
t0
г) Be(OH)2 + NaOH → … + H2O
6). Закріплення нового навчального матеріалу
Завдання 1. Напишіть рівняння хімічних реакцій що характеризують хімічні властивості алюміній гідроксиду як основи.
Завдання 2. Напишіть рівняння хімічних реакцій що характеризують хімічні властивості алюміній гідроксиду як кислоти.
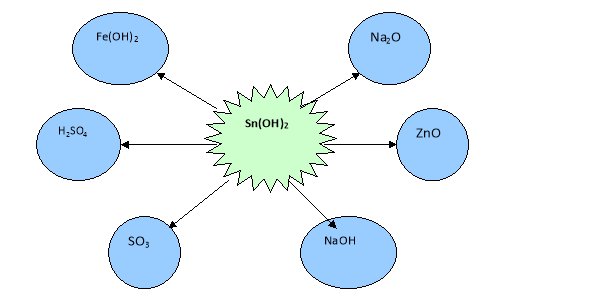
Завдання 3. Запишіть усі можливі рівняння реакцій між станум (ІІ)гідроксидом та запропонованими речовинами.
7) Підведення підсумків уроку
«На уроці я дізнався….»
«На уроці я змінив своє ставлення до….»
«На уроці найбільший мій успіх – це…»
8) Пояснювальне ознайомлення з домашнім завданням.
Вивчити параграф 30.
Завдання 230 (с. 178), 231.(ст. 179).


про публікацію авторської розробки
Додати розробку
