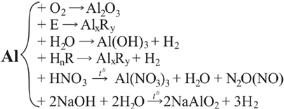Тема уроку: « Алюміній та його сполуки»
На уроці : « Алюміній та його сполуки» було реалізовано такі цілі:
Навчальна: формувати знання учнів про Алюміній, будову його атома, фізичні та хімічні властивості, ознайомити учнів з історією відкриття Алюмінію, поширенням у природі й галузями його застосування. Формувати навички складати рівняння хімічних реакцій, поглибити знання учнів про амфотерність елементів на прикладі алюмінію та його сполук. Вдосконалювати навички експериментальної роботи під час проведення лабораторних дослідів, дотримуючись правил техніки безпеки.
Розвивальна: розвивати навички групової роботи, розвивати стійкий пізнавальний інтерес до вивчення предмета, розвивати логічне мислення, уявлення, розвивати навички складання рівнянь. Здійснювати професійну направленість.
Виховна: виховувати життєву та соціальну компетентність учнів, культуру спілкування.
Тип уроку: комбінований.
Використано такі технології: технологія інтерактивного навчання; проектна технологія; технологія розвивального навчання; технологія проблемного навчання; технологія особистісно-орієнтованого навчання; технологія традиційного навчання(елементи).
Застосовано форми роботи: фронтальна, кооперативно-групова, індивідуальна, творчі пізнавальні завдання, робота з підручником, додатковою літературою, міні-проект, хімічний експеримент, слайди, тести.
Обладнання: періодична таблиця хімічних елементів Д.І. Менделєєва, ряд активності металів, комп'ютер, мультимедійний проектор, мультимедійна презентація, педагогічний програмний засіб «Віртуальна хімічна лабораторія», 10 клас, підручники, тестова програма «My Test»
Міжпредметні зв'язки:
географія: поширеність алюмінію в природі;
фізика: фізичні властивості алюмінію;
біологія: біологічна роль алюмінію;
література: опис алюмінію та коштовних каменів;
історія: добування алюмінію;
електротехніка , матеріалознавство, спецтехнологія, виробниче навчання(спец. предмети).
Викладач починає урок з емоційного налаштування.
Учні отримали творчі різнорівневі завдання, які виконували групами (завдання обрали відповідно інтересів, компетентності).
1 завдання. Охарактеризувати Алюміній як хімічний елемент: за положення у періодичній системі, за будовою атома.
( Учні працюють біля дошки)
2 завдання. Розкрити історичні відомості добування Алюмінію(міні проект, слайдова презентація)
Учні використали уривок з роману М. Г. Чернишевського «Що робити»
«… яка легка архітектура цього внутрішнього будинку ... які ці підлоги і стелі? З чого ці двері і рами вікон? Що це таке? Срібло? Платина? .. Ах, знаю тепер ... рано чи пізно алюміній замінить собою дерево, може бути і камінь».
В процесі вивчення теми учні розглянули такі питання:
1. Характеристика Алюмінію , будова його атомів.
2. Алюміній у природі .
3. Фізичні та хімічні властивості Алюмінію.
4. Сполуки Алюмінію, їх амфотерний характер.
5. Застосування Алюмінію та його сполук(слайдова презентація)
Учні біля дошки дали характеристику Алюмінію: положенню в періодичній системі; розкрили будову атома, працювали з підручником, розглянули фізичні та хімічні властивості, користуючись схемою.
Далі використано міні- проект: «Застосування Алюмінію в електротехніці»
Сполуки алюмінію та їх застосування учні представили у формі презентації.
Лабораторний дослід провели з використанням програмного засобу «Віртуальна хімічна лабораторія»,.
Учні виконали самостійну роботу (тести), використовуючи тестову програму «My Test»
Домашнє завдання творчого характеру.
Тема уроку: « Алюміній та його сполуки»
- Цілі:
- Навчальна: формувати знання учнів про Алюміній, будову його атома, фізичні та хімічні властивості, ознайомити учнів з історією відкриття Алюмінію, поширенням у природі й галузями його застосування, формувати навички складати рівняння хімічних реакцій. Поглибити знання учнів про амфотерність елементів на прикладі алюмінію та його сполук. Вдосконалювати навички експериментальної роботи під час проведення лабораторних дослідів, дотримуючись правил техніки безпеки.
- Розвивальна: розвивати навички групової роботи, розвивати стійкий пізнавальний інтерес до вивчення предмета, розвивати логічне мислення, уявлення. Здійснювати професійну направленість.
- Виховна: виховувати життєву та соціальну компетентність учнів, культуру спілкування.
- Тип уроку: комбінований.
- Використання технологій: технологія інтерактивного навчання; проектна технологія; технологія розвивального навчання; технологія проблемного навчання; технологія особистісно-орієнтованого навчання; технологія традиційного навчання(елементи).
- Форми роботи: фронтальна, кооперативно-групова, індивідуальна, творчі пізнавальні завдання, робота з підручником, міні-проект, хімічний експеримент, слайди, тести.
Обладнання: періодична таблиця хімічних елементів Д.І. Менделєєва, ряд активності металів, комп’ютер, мультимедійний проектор,мультимедійна презентація, педагогічний програмний засіб «Віртуальна хімічна лабораторія», 10 клас, підручники, тестова програма «My Test»
Міжпредметні зв’язки:
- географія:поширеність алюмінію в природі;
- фізика: фізичні властивості алюмінію;
- біологія: біологічна роль алюмінію;
- література: опис алюмінію та коштовних каменів;
- історія: добування алюмінію;
- електротехніка , матеріалознавство, спецтехнологія, виробниче навчання: використання Алюмінію та його сплавів алюмінію та його сплавів( професія електромонтерів).
Хід уроку
І. ОРГАНІЗАЦІЙНИЙ ЕТАП.
ІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ.
Викладач. Ми вивчаємо метали. На цьому уроці дізнаємося про метал № 13.
Ви отримали творчі різнорівневі завдання, які виконували групами (завдання обрали самі відповідно інтересів, компетентності).
1 завдання. Охарактеризувати Алюміній як хімічний елемент: за положення у періодичній системі, за будовою атома.
( Учні працюють біля дошки)
2 завдання. Розкрити історичні відомості добування Алюмінію. Міні проект. Слайдова презентація.
ІІІ. МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ.
Емоційне налаштування.
Викладач:
…Блискучий, білий і твердий.
У сплавах він завжди легкий.
Він у 13 клітині,
У Менделєєва в таблиці.
Усюди він навколо нас,
Та і кується—просто клас.
У складі глин він і рубінів,
Метал корисний—
(Алюміній)
ІV. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ.
- Характеристика Алюмінію , будова його атомів.
2. Алюміній у природі .
3. Фізичні та хімічні властивості Алюмінію.
4. Сполуки Алюмінію, їх амфотерний характер.
5. Лабораторна робота №14. Добування
гідроксиду Алюмінію, доведення його
амфотерних властивостей.
6. Застосування Алюмінію та його сполук
Учні біля дошки дають характеристику Алюмінію: положення в періодичній системі; будова атома.
Поширення у природі. Робота з підручником.
Алюміній найпоширеніший у природі металічний елемент. Вміст його у земній корі становить 8,05% (за масою). Серед металічний елементів за поширенням у земній корі він посідає перше місце, серед інших елементів – третє.
Алюміній трапляється у природі лише в складі хімічних сполук. Відомо біля 250 мінералів, які містять цей елемент. Найважливіші природні сполуки – алюмосилікати, боксит, корунд та кріоліт. Алюмосилікати, до складу яких входять Алюміній, Силіцій і Оксиген, становлять основну масу земної кори. До них належить польовий шпат K2O•3Al2O3•6SiO2•2H2O; нефелін – Na2O•Al2O3•2SiO2, продукт їх вивітрювання – глина (каолініт) – Al2O3•2SiO2•2H2O. Боксити – Al2O3•хH2O – гірська порода, що складається переважно з оксиду алюмінію та оксидів феруму, які надають їм червоного кольору. Кріоліт – мінерал складу AlF3•3NaF. Корунд – Al2O3.
Фізичні властивості.
Учні.
Алюміній – сріблясто-білий легкий метал, дуже пластичний, міцний, добрий провідник теплоти і електричного струму. Легко піддається обробці: прокатується у листи і фольгу, витягується в тонкий дріт. Плавиться при 660ºC, тонка фольга плавиться в полум’ї сірника.
Алюмі́нієві спла́ви — легкі сплави на алюмінієвій основі, до складу яких входить один або декілька легуючих елементів.
(Al-Mn) — пластичні, технологічні, добре зварюються і є корозієстійкими.
(Al-Mg) — поєднання достатньої міцності, високої пластичності, корозійної стійкості та зварюваності, є стійкими до вібрацій.
Авіалі (сплави системи Al-Mg-Si) мають високу пластичність, корозійну стійкість.
Ковкі сплави алюмінію (сплави системи Al-Mg-Si-Cu) для використання в авіабудуванні, зварюванні.
Високоміцні алюмінієві сплави (сплави системи Al-Zn-Mg, Al-Zn-Mg-Cu)
Силуміни (система Al-Si). До переваг цих матеріалів належать високі ливарні властивості.
Дуралюміни (сплави типу Al—Cu—Mg, Al—Cu—Mn). Дуралюміни знайшли широке застосування в авіабудуванні через високу міцність (поршні авіадвигунів, обшивка та силовий каркас надзвукових літаків).
Викладач, учні.
Хімічні властивості
Алюміній належить до активних металів. Однак на повітрі він досить стійкий, оскільки за звичайної температури швидко окиснюється, його поверхня вкривається дуже щільною плівкою оксиду, яка захищає метал від подальшого руйнування.
1. Взаємодія з киснем. Якщо з алюмінієвого дроту зняти захисну оксидну плівку, то алюміній починає енергійно взаємодіяти з киснем. Порошок алюмінію згоряє, утворюючи оксид:
4Al + 3O2 = 2Al2O3 + Q.
2. Взаємодія з водою. При звичайних умовах на алюмінієві вироби вода не діє навіть при температурі її кипіння, тому що алюміній оксид не взаємодіє з водою. Якщо видалити захисну оксидну плівку з поверхні алюмінію, він починає енергійно взаємодіяти з водяною парою повітря, перетворюючись на рихлу масу алюміній гідроксиду з виділенням водню і тепла:
2Al + 6H2O = 2Al(OH)3 + 3H2.
3. Взаємодія з неметалами. Алюміній реагує з сіркою, галогенами, вуглецем, азотом та всіма неметалами. Для початку реакції необхідне нагрівання. Далі реакція відбувається з виділенням великої кількості тепла. З воднем алюміній не взаємодіє.
4. Взаємодія з кислотами. Алюміній активно взаємодіє з багатьма кислотами, особливо з хлоридною з виділенням водню:
2Al + 6HCl = 2AlCl3 + 3H2.
Концентрована нітратна кислота при звичайних умовах не вступає в реакцію з алюмінієм. Пояснюється це тим, що нітратна кислота як сильний окисник робить оксидну плівку ще міцнішою. Тому цю кислоту можна зберігати і перевозити в алюмінієвому посуді. При звичайній температурі алюміній пасивується концентрованою сульфатною і розбавленою нітратною кислотами. У гарячій сульфатній кислоті алюміній розчиняється:
2Al + 4H2SO4(k) = Al2(SO4)3 + S + 4H2O.
5. Взаємодія з оксидами. Алюміній взаємодіє з оксидами більшості металів. Реакція проходить з виділенням великої кількості теплоти:
Cr2O3 + 2Al = 2Cr + Al2O3 + Q;
3Fe3O4 + 8Al = 4Al2O3 + 9Fe + Q.
Процес відновлення металів з їх оксидів називається алюмінотермією. Цей метод використовується у металургії для добування тугоплавких металів (титану, вольфраму, молібдену, ванадію, цирконію).
6. Взаємодія з солями. Металічний алюміній легко вступає в реакції з розчинами солей: 2Al + 3CuCl2 = 3Cu + 2AlCl3.
7. Взаємодія з лугами. На відміну від багатьох металів на алюміній дуже сильно діють розчини лугів, тому в алюмінієвому посуді не можна зберігати луги та лужні розчини.
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
Учні користуються схемою:
Застосування алюмінію.
Міні- проект: «Застосування Алюмінію в електротехніці»
Алюміній знаходить найширше застосування. У вигляді чистого металу використовується для виготовлення електричних проводів, фольги для хімічної апаратури. Алюмінієм вкривають стальні та чавунні вироби, щоб захистити їх від корозії. Його сплави з різними металами дуже міцні й легкі. Вироби із них по міцності рівні стальним, але в три рази легші від них. Сплави використовують у авіа-, авто-, корабле- і приладобудуванні, в ракетній техніці і в будівництві, для оздоблення фасадів будинків, станцій метрополітену, гофрованими листами алюмінієвих сплавів покривають дахи, будують різні складські приміщення. Широко використовується в транспорті. З нього будують цистерни для транспортування нафтопродуктів, виготовляють вагони. кондитерської і харчової промисловості (як обгортковий матеріал), різної
Широко застосовується «срібна» фарба на основі алюмінієвого порошку. Щоб захистити від сонячних променів цистерни для перевезення, їх покривають алюмінієвою фарбою.
У побуті використовують алюмінієвий посуд, столові набори. Сполуки алюмінію, які в невеликій кількості можуть утворюватися від дії на алюміній слабких органічних кислот не отруйні.
Сполуки Алюмінію. Алюміній оксид Al2O3 (глинозем).
Викладач:
Це речовина білого кольору, тугоплавка (температура плавлення 2000ºС), з дуже високою твердістю. Тонка, прозора й міцна плівка цього оксиду завжди покриває метал алюміній. У природі алюміній оксид зустрічається у вигляді корунду та глинозему. Природний корунд – дуже тверда речовина, який поступається твердістю тільки перед алмазом – застосовують його для виготовлення наждачних кругів, брусків для обробки (полірування) металевих та інших виробів та шліфувальних порошків. У природі зустрічаються прозорий різновид корунду, який може мати різне забарвлення: корунд забарвлений домішками сполук титану у синій колір, називають сапфіром; у фіолетовий – аметист; у червоний (від сполук хрому) – рубін. Це дорогоцінні камені. Рубін використовують для виготовлення втулок годинникових та інших точних механізмів. Глинозем використовують як сировину для добування алюмінію. Зневоднений алюміній оксид застосовують як адсорбент при очищенні та розділенні органічних речовин методом хроматографії.
За хімічними властивостями – це амфотерний оксид.
Реагуючи з кислотами, проявляє основні властивості, утворюючи солі, наприклад: Al2O3 + 6HCl ![]() 2AlCl3 + 3H2O
2AlCl3 + 3H2O
Стосовно лугів він поводиться як кислотний оксид. При сплавленні з лугами утворюються солі метаалюмінати: Al2O3 + 2NaOH = 2NaAlO2 + H2O.
У присутності води реакція з лугами відбувається інакше: Al2O3 + 2NaOH + 3H2O = 2NaAl(OH)4 – гідрат метаалюмінату натрію.
Це пояснюється тим, що у водному розчині натрій алюмінат приєднує одну або дві молекули води, що можна зобразити так:
а) NaAlO2 • H2O або NaH2AlO3;
б) NaAlO2 • 2H2O або NaAl(OH)4.
Алюміній оксид не розчиняється у воді і з нею не реагує. Свіжо одержаний оксид взаємодіє з кислотами і лугами, а сухий – не розчиняється ні в кислотах, ані в лугах.
Добувають алюміній оксид безпосереднім спалюванням порошку металічного алюмінію:
4Al + 3O2 = 2Al2O3, або розкладом алюміній гідроксиду при нагріванні:
Алюміній гідроксид Al(OH)3
Біла тверда речовина, що не розчиняється у воді, свіжо добутий алюміній гідроксид – це біла желеподібна маса, при висушуванні якої утворюється кристалічна речовина.
Алюміній гідроксид має амфотерні властивості.
Свіжоосаджений алюміній гідроксид легко розчиняється в кислотах та лугах (крім амоній гідроксиду):
Al(OH)3 + 3HCl = AlCl3 + 3H2O.
При сплавленні з лугами утворюються метаалюмінати, а у водних розчинах – гідрати метаалюмінатів:
Al(OH)3 + NaOH ![]() NaAlO2 + 2H2O
NaAlO2 + 2H2O
Al(OH)3 + NaOH → NaH2AlO3 + H2O
При взаємодії з концентрованими розчинами лугів утворюються ортоалюмінати:
Al(OH)3 + 3NaOH → Na3AlO3 + 3H2O
Алюміній гідроксид розкладається при нагріванні. Алюміній гідроксид має властивість поглинати різні речовини, тому його застосовують для очистки води.
Добувають його дією лугів на солі алюмінію. Розчин лугу береться у малій кількості, тому що утворений алюміній гідроксид розчиниться у надлишку лугу.
Солі алюмінію
AlCl3 – каталізатор в оргсинтезі.
Al2(SO4)3•18H2O – очистка води, протрава при фарбуванні тканин.
Al2O3 – виготовлення шліфувальних брусків, кругів, для різання та полірування металевих виробів, виготовлення вогнетривких матеріалів.
KАI(SO4)2•12H2O – алюмінієві галуни – кровозупинний засіб при порізах, примочки при запальних процесах слизових оболонок і шкіри. Галуни широко використовують для дублення шкіри, і протрава при фарбування бавовняних тканин.
V. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ.
Виконання лабораторного досліду з використанням програмного засобу «Віртуальна хімічна лабораторія»,
|
Лабораторний дослід . Добування алюміній гідроксиду і дослідження його кислотно-основних властивостей |
||||
|
1а |
У пробірку помістіть по 2-3 краплі розчину алюміній хлориду (AlCl3). Осад розділіть на дві пробірки і збережіть.
|
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl; Al3+ + 3Cl– + 3Na+ +3 OH– = Al(OH)3↓ + 3Na+ + 3Cl–; Al3++ 3OH– = Al (OH) 3↓.
|
Випадає білий драглистий осад.
|
Al(OH)3 можна здобути взаємодією солі алюмінію з основою |
|
2а |
До утвореного осаду алюміній гідроксиду (досл 1а) в першій пробірці долийте декілька крапель хлоридною кислоти.
|
Al(OH)3 + 3HCl = AlCl3 + 3H2O; Al(OH)3 + 3H+ + 3Cl– = AL3+ + 3Cl– + 3H2O; Al (OH) 3 + 3H+ = Al3+ + 3H2O.
|
Осад зникає |
Алюміній гідроксид Al(OH)3 у реакціях з кислотами виявляє основні властивості, а в реакціях з основами – кислотні. Отже, алюміній гідроксид – амфотерна сполука.
|
|
3а |
У другу комірку з алюміній гідроксидом доллємо надлишок розчину лугу – натрій гідроксиду.
|
Al(OH)3+NaOH= Na[Al(OH)4] – комплексна сіль натрій тетрагідроксоалюмінат; Al(OH)3 + Na+ + OH– = Na+ + [Al(OH)3]–; Al (OH) 3 + OH– = [Al(OH)4]–.
|
Реакція відбувається, осад зникає.
|
|
VI. Узагальнення та систематизація знань.
Виконання самостійної роботи( Тести).
- Алюміній має атомну масу: 1—23; 2—24; 3—25; 4—27.
- Елемент Алюміній стоїть у: 1—І групі; 2—ІІ групі; 3—ІІІ групі; IV—групі.
- Алюміній добувають з: 1—каолініту; 2—піриту; 3—магнетиту; 4—гематиту.
- Атом Алюмінію має ступінь окиснення: 1)+3; 2)+4; 3)+1; 4)+2.
- Елемент Алюміній стоїть у періоді: 1—І; 2—ІІ; 3—ІІІ; 4—IV.
- Алюміній не добувають з: 1—каолініту;2—бокситів; 3—нефеліну; 4—гепатиту.
- При взаємодії Алюмінію з водою утворюється: 1)кислота; 2)гідроксид; 3)оксид; 4)сіль.
- Алюміній горить у повітрі з утворенням: 1)гідроксидів; 2)оксидів;3)кислоти; 4)солі.
Підбиття підсумків уроку. Оголошення результатів роботи учнів.
VII. Домашнє завдання.
Опрацювати параграф 22(підручник з хімії під редакцією П.П.Попель.)
Виконати вправу 214(Дописати схеми реакцій, урівняти рівняння).
Освітній простір. http://eduspanpal.ucoz.ua/index/khimija/0-111


про публікацію авторської розробки
Додати розробку