Тема уроку: «Хімічні властивості алкенів і алкінів»
Тема уроку: «Хімічні властивості алкенів і алкінів»
Мета:
освітня –сприяти формуванню в учнів знання про хімічні властивості алкенів і алкінів; розкрити хімічні властивості ненасичених вуглеводнів на прикладі етену, ацетилену та іх гомологів, його взаємодію з розчинами кислот, лугів, калій перманганату;
розвиваюча -створити умови для розвитку навичок й умінь складати рівняння хімічних реакцій на прикладі хімічних властивостей алкенів.
виховна –сприяти формуванню інтересу до хімічної науки.
Формування ключових компетентностей: спілкування державною мовою, основні компетентності у природничих науках і технологіях, ініціативність і підприємливість, уміння вчитися впродовж життя, соціальна та громадянська компетентності, обізнаність та самовираження у сфері культури, екологічна грамотність і здорове життя.
Наскрізні лінії: «Здоров’я і безпека».
Обладнання: відео сюжети, ПК, проектор, м/м дошка, зошит, підручник.
Основні поняття та терміни: алкени, етилен, пропен,алкіни, ацетилен, окиснення, галогенування, гідрування, гідрогенування, полімеризація, правило Марковникова.
Методи та прийоми: самостійна робота, демонстрація, бесіда, пояснення, розповідь.
Тип уроку: засвоєння нових знань.
Дата проведення: ___________
Клас: 10
Структура уроку
І.Етап орієнтації, мотивації діяльності.
ІІ. Етап контролю домашнього завдання.
ІІІ. Етап цілевизначення та планування.
ІV.Етап цілереалізації.
V. Рефлексивно-оцінювальний етап.
V. Етап повідомлення домашнього завдання.
Хід уроку.
І.Етап орієнтації, мотивації діяльності.
 Привітання з класом, налаштування на робочий настрій.
Привітання з класом, налаштування на робочий настрій.
ІІ. Етап контролю домашнього завдання. Самостійна робота
Варіант І
1. Напишіть рівняння реакцій, з допомогою яких можна здійснити схему перетворень:
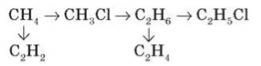
2. Обчисліть об’єм кисню (н. у), що потрібен для спалювання 8,8 г пропану.
Варіант ІІ
1. Напишіть рівняння реакцій, з допомогою яких можна здійснити схему перетворень:
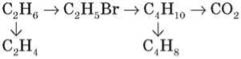
 2. Обчисліть об’єм кисню (н. у), що потрібен для спалювання 4,5 г бутану.
2. Обчисліть об’єм кисню (н. у), що потрібен для спалювання 4,5 г бутану.
Актуалізація опорних знань учнів. Давайте пригадаємо як метан взаємодіє з бромною водою і з калієм перманганатом. (Відеосюжет https://www.youtube.com/watch?v=3PwPY86eKGQ )
ІІІ. Етап цілевизначення та планування. Описуючи речовину, ми характеризуємо її фізичні і хімічні властивості. Що означає «описати хімічні властивості речовини»?
- з чим вона реагує;
- за яких умов;
- що при цьому утворюється.
Отже, розглянемо хімічні властивості алкенів, алкінів.
Мета уроку: познайомитися з хімічними властивостями алкенів, алкінів. Навчитися писати відповідні рівняння реакцій.
ІV.Етап цілереалізації.
А) Хімічні властивості алкенів.
1) Галогенування
Алкени за звичайних умов приєднують галогени, утворюючи дигалогенопохідні алкани, що містять атоми галогену біля сусідніх атомів Карбону.
![]()
Демонстрація 5. Взаємодія ненасичених вуглеводнів з розчинами кислот, лугів, калій перманганату Взаємодія етилену з бромною водою й калій перманганатом:
CH2 = CH2 + Br2 ![]() CH2Br - CH2Br
CH2Br - CH2Br
(Рівняння реакції записуємо в зошит.)
Висновок: ненасичені вуглеводні знебарвлюють розчин калій перманганату і бромну воду.
! Реакція з бромною водою (Br2) — якісна реакція на наявність кратного зв’язку!
Наведена реакція — знебарвлення алкеном бромної води — є якісною реакцією на подвійний зв’язок.
2) Гідрування
Алкени легко приєднують водень у присутності каталізаторів (Pt, Pd, Ni), утворюючи насичені вуглеводні.
![]()
3) Гідрогалогенування
Етилен та його гомологи приєднують галогеноводні, утворюючи галогенопохідні вуглеводнів.
![]()
Приєднання галогеноводнів до пропілену та інших алкенів відбувається відповідно до правила В. В. Марковнікова (водень приєднується до найбільш гідрогенізованого атома Карбону в місці подвійного зв’язку).
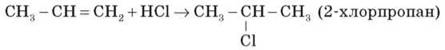
4) Гідратація
Реакція несиметричних алкенів із водою також відбуваються за правидом Марковникова. Прродуктами реакцій є спирти.
У присутності мінеральних кислот олефіни приєднують воду, утворюючи спирти.

5) Окиснення
Алкени легко окислюються. Залежно від умов проведення реакції утворюються різні продукти.
а) У результаті спалювання (повне окиснення) на повітрі олефіни дають вуглекислий газ і воду:
H2C = CH2 + 3O2 ![]() 2CO2 + 2H2O
2CO2 + 2H2O
б) У разі окиснення алкенів розведеним розчином калій перманганату утворюються двохатомні спирти — гліколі (реакція Є. Є. Вагнера). Реакція відбувається на холоді:

У результаті реакції спостерігається знебарвлення розчину калій перманганату. Реакція Вагнера є якісною пробою на подвійний зв’язок.
7) Реакція полімеризації
Однією з найбільш важливих у практичному плані реакцій ненасичених сполук (або олефінів) є полімеризація. Реакцією полімеризації називається процес утворення високомолекулярної сполуки (полімеру) шляхом з’єднання одна з одною молекул вихідної низькомолекулярної сполуки (мономера). Під час полімеризації подвійні зв’язки в молекулах вихідної ненасиченої сполуки «розкриваються», і за рахунок вільних валентностей, що утворюються, ці молекули з’єднуються одна з одною.
Полімеризація олефінів спричиняється нагріванням, тиском, опроміненням, дією вільних радикалів або каталізаторів. У спрощеній формі що реакцію на прикладі етилену можна представити так:
А) Хімічні властивості алкінів.
1. Галогенування. Галогени приєднуються до алкінів у дві стадії. Наприклад, приєднанняброму до ацетилену призводить до утворення диброметену, який, у свою чергу, реагує з надлишком Вr2 з утворенням тетраброметану:
![]()
Алкіни, так само як і алкени, знебарвлюють бромну воду.
2. Гідрогалогенування. Галогеноводні приєднуються до потрійного зв’язку важче, ніж до подвійного. Для активації галогеноводню використовують АlСl3. З ацетилену при цьому можна добувати вінілхлорид (хлоретен), який використовують для добування важливого полімеру — полівінілхлориду:
![]()
У разі надлишку галогеноводню відбувається повне гідрогалогенування, причому для несиметричних алкінів на кожній стадії приєднання йде за правилом Марковникова, наприклад:
![]()
3. Гіоратація.
HgSO4
НCCH + H2O [HC=CH] CH3CH
H OH O
Реакцію гідратації алкінів відкрив М.Г. Кучеров (1881 р.), саме тому її й називають реакцією Кучерова.
4. Кислотні властивості. Особливістю алкінів, що мають кінцевий кратний зв’язок, є їхня здатність відщеплювати протон під дією сильних основ, тобто проявляти слабкі кислотні властивості. Таким чином, алкіни, на відміну від алкенів та алканів, здатні утворювати солі, які називають ацетиленідами:
![]()
Ацетиленіди Аргентуму и Купруму(I) легко утворюються й випадають в осад при пропусканніацетилену через аміачний розчин аргентум оксиду або купрум(І) хлориду. Ці реакції слугують для виявлення алкінів з потрійним зв’язком у кінці ланцюга:
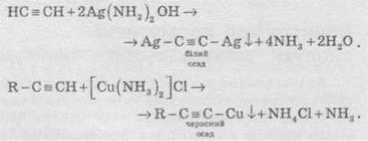
Ацетиленіди Арґентуму й Купруму як солі дуже слабких кислот легко розкладаються при дії хлороводневої кислоти з виділенням вихідного алкіну:
![]()
Таким чином, використовуючи реакції утворення й розкладу ацетиленідів, можна виділяти алкіни із сумішей з іншими вуглеводнями.
5. Полімеризація. У присутності каталізаторів алкіни можуть реагувати один з одним, причому залежно від умов утворюються різні продукти. Так, під дією водного розчину СuСl та NH4Clацетилен димеризується, утворюючи вінілацетилен:
![]()
Вінілацетилен має велику реакційну здатність, приєднуючи хлороводень, він утворює хлоропрен, який використовують для добування штучного каучуку:
![]()
При пропусканні ацетилену над активованим вугіллям при температурі +600 °С відбувається тримеризація ацетилену з утворенням бензену:
![]()
В аналогічні реакції тримеризації можуть також вступати й найближчі гомологи ацетилену, наприклад:
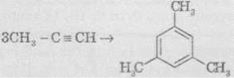
6. Реакції окиснення й відновлення. Алкіни легко окиснюються різними окисниками, зокрема калій перманганатом. При реакції розчин калій перманганату знебарвлюється, що свідчить про наявність потрійного зв’язку. При окисненні зазвичай відбувається розщеплення потрійного зв’язку, утворюються карбонові кислоти:
![]()
У присутності металевих каталізаторів алкіни відновлюються шляхом послідовного приєднання молекул водню, перетворюючись спочатку в алкени, а потім в алкани:
![]()
![]()
V. Рефлексивно-оцінювальний етап.
Складання таблиці.
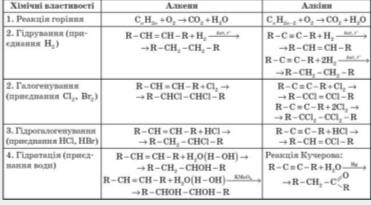
Підбиття підсумків уроку. Що ми вивчили на сьогоднішньому уроці?
- Про що вам було цікаво дізнатись?
- Що ви не зрозуміли з теми уроку?
VІ. Етап повідомлення домашнього завдання.
Опрацювати §10, для допитливих – алкадієни,
Творче завдання: придумати ланцюг перетворень (10 рівнянь) обов’язковою речовиною в якому є метан.


про публікацію авторської розробки
Додати розробку
