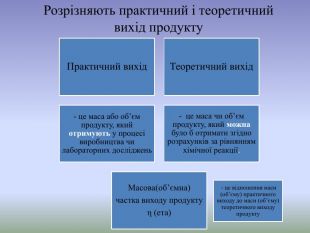
«Розв’язування задач з використанням понять «масова та об’ємна частки виходу продукту реакції»
Про матеріал
Матеріал допоможе як в очному, так і в дистанційному режимі навчання , ознайомити з алгоритмом розв’язування задач з використанням понять «масова та об’ємна частки виходу продукту реакції» Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку