Урок на тему : "МОЛЯРНА МАСА" 8 клас
Цілі:
- Формування ключових компетентностей:
- саморозвитку й самоосвіти — створення проблемних ситуацій, уміння розв’язувати задачі;
- інформаційної — вміння робити короткий раціональний запис, робити висновки та узагальнення;
- комунікативної — вміння працювати в парі.
- Формування предметних компетентностей: формувати поняття «молярна маса», розкрити різницю між поняттями «молярна маса» та «відносна молекулярна маса»; формувати вміння робити розрахунки із застосуванням понять «кількість речовини», «молярна маса»; розвивати хімічну мову; виховувати інтерес до хімії як науки.
Обладнання: роздавальний матеріал, мультимедійний проектор, ком п’ютер.
Тип уроку: ВНМ (О).
Форми роботи: прийом «Мікрофон», робота в парах, бесіда, фронтальна робота.
ХІД УРОКУ
І. ОРГАНІЗАЦІЯ КЛАСУ
ІІ. ОГОЛОШЕННЯ ТЕМИ Й МЕТИ УРОКУ
ІІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
1 Прийом «Мікрофон» за основними поняттями попередніх уроків
(Запитання проектують на екран.)
- Відносна атомна маса.
- Відносна молекулярна маса.
- Кількість речовини.
- Стала Авогадро.
- Обчислення відносної молекулярної маси речовини.
- Обчислення кількості речовини за відомою кількістю молекул.
- Обчислення кількості молекул за відомою кількістю речовини.
Обчислити відносні молекулярні маси алюміній оксиду, кальцій ортофосфату (Ca3(PO4)2).
IV. МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ
Ми вже знаємо, що всі речовини взаємодіють між собою в певних кількостях. Коли для реакції потрібно взяти речовину, ми її зважуємо.
- Як пов’язати кількість речовини й масу?
V. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
(Необхідні схеми проектують на екран.)
1. Ми вже знаємо, що 1 моль будь-якої речовини містить стале число структурних частинок, але кожна з них має певну масу. А тому 1 моль речовини буде мати стале значення маси.
Молярна маса — маса 1 моль речовини.
2. Значення молярної маси речовини чисельно співпадає зі значенням відносної молекулярної маси.
М (речовини) = Мr (речовини).
3. Одиниці вимірювання молярної маси речовини:
М (речовини) = г/моль.
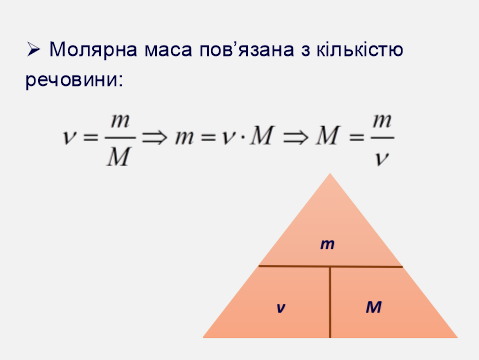
4. Молярна маса пов’язана з кількістю речовини:
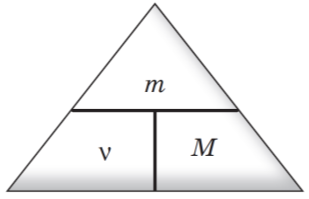
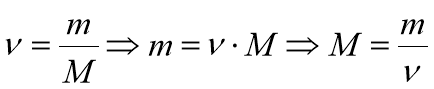
Наведемо приклад розв’язування задачі із застосуванням цих формул.
Обчислити кількість речовини води масою 3,6 г.
Аналіз задачі: Що відомо? Що знайти? Як це зробити?
|
Дано: m (H2O) = 3,6 г |
Розв’язання 1. Яка молярна маса води? M (H2O) = Mr (H2O) Mr (H2O) = 2⋅ Ar (H) + Ar (O) = 2⋅1+16 = 18. M (H2O) =18 г/моль. |
|
ν (H2O) = ? |
2. Яка кількість речовини води?
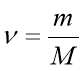 .
. 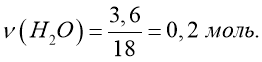
Відповідь: ν (H2O) = 0,2 моль.
VІ. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Учням пропонують роздавальний матеріал із переліком задач. Одну задачу учень розв’язує біля дошки.
Робота в парах
1. Обчислити масу ферум(ІІ) оксиду кількістю речовини 0,2 моль.
2. Обчислити кількість речовини вуглекислого газу масою 1,1 г.
3. Обчислити кількість речовини ферум(ІІІ) сульфату масою 8 г.
4. *Обчислити кількість атомів Гідрогену, що містяться у водні масою 6 г.
VІІІ. ДОМАШНЄ ЗАВДАННЯ










про публікацію авторської розробки
Додати розробку
