Теплові явища, що супроводжують розчинення речовин. Розчинення як фізико-хімічний процес.
Клас 9 дата урок
Тема: Фізико-хімічна сутність процесу розчинення. Теплові явища, що супроводжують розчинення речовин.
Мета уроку: формування предметної компетентності: ознайомити учнів з розчиненням як фізико-хімічним процесом і розчинами як фізико-хімічними системами; дати поняття про кристалогідрати та теплові явища, що супроводжують розчинення речовин; здоров’язберігаюча компетентність , розвивати вміння аналізувати матеріал, робити спостереження та формулювати обґрунтовані висновки, формувати вміння працювати з таблицею розчинності, виховувати прагнення до пізнання навколишнього світу.
Тип уроку: комбінований.
Методи та методичні прийоми: словесні (бесіда, пояснення, розповідь вчителя), проблемно–пошукові (проблемне запитання), практичні (демонстрації).
Засоби навчання: підручник
Базові поняття та терміни: розчинність, фізико-хімічна сутність процесу розчинення, кристалогідрат.
Хід уроку:
1. Організаційний момент.
Перевірка учнів готовності до уроку;налаштування на робочий лад;повідомлення теми уроку. Перевірка наявності учнів.
2. Перевірка домашнього завдання.
- Експрес - контроль. (Тестові завдання із взаємоперевіркою)
1.Скільки електронів може міститися на зовнішньому енергетичному рівні?
а) 1-2 в) 1-8
б) 8-10 г) 1-18
2.У що перетворюються атоми, віддаючи електрони?
а) в катіони в) в ізотопи
б) в аніони г) в радіонукліди
3.Який хімічний зв’язок називається ковалентним?
а) який виникає між атомами елементів, що не дуже відрізняються своєю електронегативністю б) який виникає між атомами хімічних елементів, які різко відрізняються своєю електронегативністю
в) утворений за допомогою спільних електронних пар
г) зв’язок, утворений за допомогою спільних електронних пар, які рівновіддалені від ядер обох атомів
4. молекула CuCl2 має звязок а) кп б) йонний в) кнп
5. З чого складається ядро?
а) з протонів і електронів
б) з протонів і нейтронів
в) з протонів, нейтронів і електронів
г) з нейтронів і електронів
6. Яка з частинок має негативний заряд?
а) протон в) електрон
б) катіон г) нейтрон
7. вказати звязок O3 SiO2
а) кп і йонний б) йонний і кнп в) кнп і кп
8. Виберіть з – поміж рідин істинний розчин:
А) молоко Б) дистильована вода В) томатний сік Г) хлоридна кислота.
9. Виберіть розчини
А) дощова вода Б) столовий оцет В) молоко Г) хлоридна кислота
10.Доповніть речення. Істинний розчин є системою..
А) гомогенною Б) гетерогенною В) багатокомпонентною г) однорідною
д) грубо дисперсною ж) колоїдною
В: 1 а 2а 3в 4б 5б 6в 7в 8б,г 9 а,в 10 а,г
3. Мотивація навчально-пізнавальної діяльності.
- Розповідь вчителя.
Ми з вами продовжуємо вивчати розчини і сьогодні на уроці ми познайомимось з процесом розчинення та розглянемо його з фізико-хімічної сторони та тепловими явищами, що супроводжують розчинення речовин. Дізнаємося про такі речовини як кристалогідрати.
4. Актуалізація теоретичних знань.
- Постановка проблемного питання.
Як ви вважаєте, процес розчинення це фізичне чи хімічне явище? Поясніть свою точку зору.
- Розповідь вчителя, бесіда.
Фізико-хімічна суть процесу розчинення.
- У чому вона полягає?
Спробуймо відповісти на це запитання, звернувшись до простих дослідів із розчинення речовин, добре відомих вам з повсякденного життя. До склянки з водою помістимо грудочку цукру. Поступово вона зменшуватиметься аж до повного «зникнення». Такі зміни ми спостерігатимемо на макрорівні фізичного світу.
Спираючись на власний досвід приготування чаю, назвіть дві умови, за яких розчинення цукру пришвидшується.
Молекули цукру містять полярні гідроксильні групи Саме тому на поверхні кристала цукру між молекулами сахарози і води утворюються водневі зв'язки: з однією молекулою цукру зв'язуються кілька молекул води. Такі молекули називають гідратованими. Тепловий рух молекул води змушує зв'язані з ними молекули цукру відокремлюватися від кристала й переходити у середовище розчинника. Молекули цукру, які перейшли із кристала в розчин, хаотично пересуваються у ньому разом із молекулами води завдяки тепловому руху. Це явище, добре відоме вам з курсу природознавства, називають дифузією.
Процес дифузії відбувається досить повільно, тому поблизу поверхні кристалів накопичується надлишок молекул цукру. Під час перемішування розчину дифузія відбувається інтенсивніше, тож розчинення цукру пришвидшується. Згодом гідратовані молекули цукру рівномірно розподіляються між молекулами води. Молекули цукру не тільки відокремлюються від кристала, а й знов приєднуються до нього з розчину. Якщо цукру взято порівняно небагато, у розчин переходить більше його молекул, ніж приєднується до кристала, - відбувається розчинення. Якщо вода контактує з більшою кількістю кристалів, то кількість молекул, які відокремлюються від кристала й приєднуються до нього, стає однаковою, розчин насичується. Тому на макрорівні спостерігаємо припинення розчинення, хоча на мікрорівні взаємозворотні процеси розчинення й кристалізації тривають
Під час розчинення йонних кристалів диполі води взаємодіють із йонами кристалічних ґраток завдяки електростатичним силам
Розглянемо сутність процесу утворення розчину на прикладі розчинення твердої речовини у рідині (NaCl у Н2О).
NaCl – кристалічна іонна сполука, у водному розчині існують іони Na+ та Cl–. Між молекулами води діють водневі зв’язки і сили Ван-дер-Ваальса. Процес розчинення починається з орієнтації диполів води відносно кристалічної гратки NaCl. Між розміщеними на поверхні кристалу NaCl іонами Na+ та Cl– та диполями води виникає іон-дипольна взаємодія. Диполі води орієнтуються так, що до іонів Na+ вони обертаються негативним, а до іонів Cl– – позитивним полюсом. Внаслідок взаємодії з диполями води іони Na+ та Cl– вириваються з поверхні кристала, гідратуються і дифундують в розчинник. Кристал NaCl розпадається на гідратовані іони, які утворюють з водою гомогенну систему – іонний розчин (рис. 11.1).
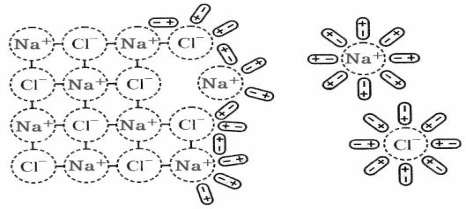
Рис. 11.1. Схема розчинення NaCl у воді.
Отже, розчинення речовин супроводжується взаємодією розчинника і розчиненої речовини. Якщо розчинник - вода, процес називають гідратацією, а його продукти - гідратами.
Тобто компонентами розчину є розчинник, розчинена речовина і продукти їхньої взаємодії,.
Під час випарювання водних розчинів деяких твердих речовин утворюються так звані кристалогідрати - кристали, до складу яких входять молекули води. Наприклад, одна формульна одиниця мідного купоросу - чи не найвідомішого кристалогідрату - містить п'ять молекул води. Хімічна формула мідного купоросу СuS04 • 5Н20.
Склад кристалогідратів виражають, вказуючи у формулі кількість молекул кристалізаційної води, що припадає на одну молекулу речовини. Так, запис CuSO4∙5H2O означає, що в кристалогідраті на одну молекулу CuSO4 припадає 5 молекул H2O, а запис 2CаSO4∙H2O або CаSO4∙0,5H2O – на одну молекулу Н2О припадає 2 молекули CаSO4.
Деякі речовини утворюють кристалогідрати з різною кількістю молекул води. Так, CoCl2 утворює кристалогідрати складу CoCl2∙хН2О, де х = 1, 2, 4 або 6. Залежно від кількості молекул кристалізаційної води змінюється забарвлення кристалогідрату.
Кристалогідрати порівняно нестійкі й згодом розкладаються, втрачаючи кристалізаційну воду. Цьому процесу так званого вивітрювання сприяють підвищення температури та низька вологість повітря.
Безводні кристали деяких речовин гігроскопічні й поглинають воду з навколишнього середовища, утворюючи кристалогідрати. Наприклад, безводний купрум(ІІ) хлорид треба зберігати у щільно закоркованій посудині аби запобігти доступу повітря.-Якщо посудина відкрита, безводна сіль вбирає з повітря вологу й поступово перетворюється на кристалогідрат.
Розгляньмо найважливіші кристалогідрати, які широко використовують у повсякденному житті. Мідний купорос запобігає розвитку пліснявих грибів, тому входить до складу численних сумішей, які використовують у будівництві та ремонті квартир. Також він ефективний у боротьбі зі шкідниками рослин і як мікродобриво. З цією ж метою застосовують інший кристалогідрат – ферум (ІІ) сульфат, гептагідрат - залізний купорос FeS04 • 7Н20. Натрій сульфат, декагідрат - глауберова сіль Nа2S04 • 10Н20 - перевірене часом послаблююче у медицині та ветеринарії. Натрій карбонат, декагідрат - кристалічна сода К2С03 • 10 Н20. Цю сполуку застосовують, зокрема, у виробництві засобів для миття і чищення. Вже згадуваний мінерал трону використовують як компонент пральних порошків нового покоління.
Отже, окрім розчинника та розчинюваної речовини, у водному розчині містяться й продукти їхньої взаємодії - гідрати. У процесі розчинення беруть участь сили як фізичної, так і хімічної природи. Процес розчинення внаслідок взаємодії компонентів розчину супроводжується різними явищами, наприклад зміною кольору під час гідратації деяких йонів або зменшенням об'єму розчину етилового спирту у воді, порівняно із сумою об'ємів цих рідин до змішування.
Теплові явища, що супроводжують розчинення речовин, також є наслідком взаємодії компонентів розчину. Молекули води руйнують зв'язки між структурними частинками розчинюваної речовини - молекулами або йонами. Під час цього процесу утворюються продукти приєднання молекул води до частинок розчинюваної речовини - гідрати. На руйнування зв'язків між частинками розчинюваної речовини енергія (Ех) витрачається. Утворення зв'язків між частинками розчиненої речовини і молекулами розчинника супроводжується виділенням енергії (Е2). Якщо > Е2, розчин охолоджується, якщо Е1 < Е2, розчин нагрівається. Приміром, якщо до шматочків льоду обережно добавити концентровану сульфатну кислоту, лід розтопиться. Адже розчинення у воді концентрованої сульфатної кислоти супроводжується виділенням теплоти.
Теплові явища під час розчинення використовують для виготовлення охолоджувальних сумішей і так званих хімічних грілок. Органічна речовина карбамід (сечовина), наприклад, відома вам як складова деяких жувальних гумок. Її розчинення у воді супроводжується поглинанням теплоти, тому цю сполуку у складі пакетів швидкого охолодження застосовують для надання першої медичної допомоги. Також у таких пакетах використовують амоній нітрат.
Розчинення - складний фізико-хімічний процес, його не можна зводити до простого механічного розподілення частинок розчинюваної речовини поміж частинками розчинника. Під час розчинення змінюються деякі властивості компонентів розчину, розриваються одні й утворюються інші хімічні зв'язки. Однак розчин не має сталого складу. Тож його не можна вважати ані сумішшю, ані індивідуальною сполукою
6. Узагальнення та закріплення матеріалу.
- “Вирішення проблемного запитання”
- А як ви пояснити наступні явища, що відбуваються при розчиненні деяких речовин?
Демонстрація.
Дослід 1. Розчинення речовин з виділенням енергії у вигляді тепла (сульфатної кислоти (концентрованої), натрій гідроксиду або цинк сульфату).
Дослід 2. Розчинення речовин з поглинанням енергії (натрій нітрату або калій сульфату).
Дослід 3. Розчинення речовин, що супроводжується зміною кольору (безводного купрум сульфату — білого кольору, який при розчиненні перетворюється на купрум сульфат пентагідрат — блакитного кольору).
Висновок формулюють учні за результатами фронтального обговорення.
Висновок. Відповідно до сучасних поглядів, розчинення - це фізико-хімічний процес, а розчини - це гомогенна система, що складається з частинок розчиненої речовини, розчинника та продуктів їх взаємодії.
7. Підсумок уроку.
8. Виставлення оцінок та їх мотивація.
9. Інструктаж з домашнього завдання
-
Дякую


про публікацію авторської розробки
Додати розробку
