Тестові завдання по матеріалах 7 класу
Посібник містить тестові завдання з хімії різного формату для учнів 7 класу. Кожен тест супроводжується великою теоретичною частиною. Тест містить одне питання з однією правильною відповіддю, що відповідає тексту тестового завдання. Також є два питання відкритого формату. Серед відкритих питань, є як творчі питання, так і завдання на розв'язування задач, запису хімічних реакцій, складання формул сполук.
Такого формату завдання сьогодні використовують в Програмі міжнародного оцінювання знань учнів PISA.
Посібник може бути використаний в роботі вчителів хімії та учнями 7 класів.
Зміст
1. Тест 1. (Хімія – як наука)……………………………………………………..3
2. Тест 2. (Історія розвитку хімії)……………………………………………….4
3. Тест 3. (Історія розвитку хімії)……………………………………………….5
4. Тест 4. (Історія розвитку хімії)……………………………………………….6
5. Тест 5. (Історія розвитку хімії)……………………………………………….7
6. Тест 6. (Правила безпеки)…………………………………………………….8
7. Тест 7. (Правила безпеки)…………………………………………………….9
8. Тест 8. (Речовина, матеріал, тіло)…………………………………………...10
9. Тест 9. (Атом)………………………………………………………………....11
10. Тест 10. (Молекула)…………………………………………………………12
11. Тест 11. (Йон)………………………………………………………………..13
12. Тест 12. (Властивості речовин)……………………………………………..14
13. Тест 13. (Спостереження, експеримент)…………………………………...15
14. Тест 14. (Чисті речовини, суміші)………………………………………….16
15. Тест 15. (Способи розділення сумішей)……………………………………17
16. Тест 16. (Хімічні елементи)…………………………………………………18
17. Тест 17. (Періодична система)……………………………………………...19
18. Тест 18. (Поширеність хімічних елементів)……………………………….20
19. Тест 19. (Відносна атомна маса)……………………………………………21
20. Тест 20. (Прості речовини – метали і неметали) ………………………….22
21. Тест 21. (Назви простих речовин)…………………………………………..23
22. Тест 22. (Складні речовини)………………………………………………...24
23. Тест 23. (Хімічна формула)…………………………………………………25
24. Тест 24. (Валентність)……………………………………………………….26
25. Тест 25. (Валентність)……………………………………………………….27
26. Тест 26. (Валентність)……………………………………………………….28
27. Тест 27. (Відносна молекулярна маса)……………………………………..29
28. Тест 28. (Масова частка елемента в складній речовині)………………….30
29. Тест 29. (Фізичні та хімічні явища)………………………………………...31
30. Тест 30. (Закон збереження маси речовини)……………………………….32
31. Тест 31. (Хімічні рівняння)………………………………………………….33
32. Тест 32. (Оксиген. Кисень)………………………………………………….34
33. Тест 33. (Відкриття кисню)………………………………………………….35
34. Тест 34. (Добування кисню)………………………………………………...36
35. Тест 35. (Хімічні властивості кисню)………………………………………37
36. Тест 36. (Вода)………………………………………………………….……38
37. Тест 37. (Вода – розчинник)………………………………………………...39
38. Тест 38. (Виготовлення розчину)…………………………………………...40
39. Тест 39. (Реакції води з оксидами)………………………………………….41
40. Тест 40. (Значення води. Кислотні дощі.)………………………………….42
41. Використані джерела………………………………………………………..43
Тест 1. (Хімія – як наука)
В сучасній українській мові існує 33 літери, вони створюють всі відомі слова нашої мови, ними утворюють вірші та казки, повісті та романи, поеми та байки. Сім нот музики подарували людству величезну кількість мелодій, серед них є шедеври Моцарта, Баха, Чайковського.
Хімічні елементи. Якщо подивитися таблицю Д.І.Менделєєва то можна побачити велику кількість хімічних елементів, не всі із них існують в природі, деякі добуті штучні. Але і присутніх в природі вистачить щоб добути величезну кількість сполук.
Елементи виявили та дослідили не одразу. Як тільки первісна людина навчилася обтесувати камені, вона зробила перше знаряддя праці. Але навіть витесана каменюка залишиласая каменем. Інша справа, коли блискавка запалила ліс, або виноградний сік скис, утворивши рідину, що бадьорить. Люди помітили, що речовини змінюються.
Питання 1
Як можна найточніше дати визначення хімії?
А) Хімія – це наука про речовини.
Б) Хімія – це наука оточуючий світ.
В) Хімія – це наука про речовини та їх перетворення.
Питання 2
Як ви вважаєте чому в природі існує речовин значно більше ніж елементів ?
Питання 3
Які процеси, на вашу думку, відбуваються при запалюванні блискавкою дерева та при скисанні виноградного соку?
Відповіді:
1) в
2) здатність утворювати одним елементом різних сполук
в) горіння, бродіння.
Тест 2. (Історія розвитку хімії)
Першими металами, які людина помітила та навчилася використовувати були мідь та золото. Вони відрізнялися від інших каменів гарно виблисували, тому спочатку використовувались лише як прикраси. Але потім люди помітили, що з міді набагато легше зробити знаряддя ніж з каменів. Так розпочалося панування міді, та її сплаву з оловом – бронзи.
Кінець панування міді прийшов з винайденням плавильної печі з нижнім піддувом, що дала змогу плавити залізо. До нижнього піддувала підносили отвір мішку пошитого з шкури бика і заповненого повітрям, та натискали на нього, примушуючи струмінь повітря проходити через полум'я та підвищуючи температуру майже до 1500°С, що дало змогу розплавити залізо та виробляти з нього велику кількість виробів.
Питання 1.
Який метал людина навчилася використовувати першим?
А) залізо
б) мідь
в) срібло
Питання 2
Які переваги мала бронза над каменем?
Питання 3.
Чому із початком виплавлення заліза закічилося панування міді?
Відповіді:
1) б
2) легше опрацьовувати, тупляться знаряддя повільніше, а заточувати легше
3) міцність, твердість заліза, більше його в природі.
Тест 3 (Історія розвитку хімії)
Вважається, що перші хімічні знання виникли задовго до нашої ери в Давньому Єгипті. Майстри цієї країни добували та переробляли метали, навчилися фарбувати тканини, виготовляти скло, мило. Вперше з'являється парфумерія, створення ліків. Величезне значення в розвитку хімічних знань посідали жерці храмів єгипетських богів. Саме вони вперше застосовували бальзамування, використовували хімічні реакції для підтвердження божої сили.
Походження слова «хімія» точно не відоме. Його пов'язують їз назвою Данього Єгипту – Хем (чорний, як колір грунту в долині річки Ніл). Ще є версія, що слово «хімія» походить від слова «сік рослини» (від грецького) – мистецтво виділяти соки. Під «соком» розуміють розплавлений метал.
Питання 1.
Яку реакцію, на вашу думку, використовували жерці Єгипту?
А) бродіння виноградного соку
б) гасіння соди оцтом
в) фараонові змії
Питання 2
Розвиток яких ремесел, пов'язаних з хімічними речовинами дав поштовх стародавній Єгипет?
Питання 3.
З чим пов'язана назва Хем. Поясніть причину чорного кольору грунтів в долині річки Ніл?
Відповіді:
- в
- металургія, медицина, парфумерія, виробництво скла
- Хем – чорна земля. В сезон дощів води річки Ніл розливалися виносячи на береги велику кількість мулу чорного кольору, коли річка поверталася в своє русло, чорний родючий мул давав змогу вирощувати великі врожаї зернових.
Тест 4 (Історія розвитку хімії)
Діти полюбляють твори Джоанн Роулінг «Гаррі Поттер». Ті, що читали першу книгу серії про хлопчика - чарівника пам'ятають, що книга називається «Гаррі Поттер та філософський камінь». Що ж таке філософський камінь. Протягом багатьох століть хіміки намагалися здобути золото. Розділ хімії яка цим займалася назвали «алхімією». Вперше цей термін застосовують араби , і тривав цей період близько 1300 років з 300р. по 1600р. н.е. Щоб отримати золото , на думку алхіміків, необхідно було знайти речовину, яка б прискорювала цей процес, сполуку назвали – «філософський камінь».
Протягом великої кількості років, одні алхіміки працювали в пошуках філософського каменю, а інші - шукали еліксир життя, що давав людям безсмертя.
Питання 1.
Як називалася речовина, що давала б змогу отримувати золото?
А) золотий камінь
б) філософський камінь
в) камінь життя
Питання 2.
Чи був, на вашу думку, знайдений філософський камінь?
Питання 3
Чи приніс алхімічний період користь в розвиток хімії – як науки? Якщо так, то яку?
Відповіді:
- б
- ні, не був
- так, в пошуках філософського каменю було проведено велику кількість дослідів, досліджено властивості багатьох речовин, відкрито нові хімічні сполуки, створено лабораторне обладнання.
Тест 5 (Історія розвитку хімії)
Одне з найважливіших відкритів 17 століття, це відкриття Георгом Шталем флогістону. «Флогістон» - це горючість. Вчений вважав, що будь яка горюча речовина містить флогістон, який при горінні виділяється, а повітря переміщує флогістон.
Далі було відкриття «закону збереження маси» Лавуазьє та Ломоносовим, що стало фундаментом для розвитку сучасної хімії. Відкриття кисню Шеєле та Прістлі, впровадження сучасних назв елементів Берцеліусом та інші відкриття, які зрештою привели до становлення хімії - як науки, яку ми сьогодні вивчаємо та знаємо.
Питання 1.
Як називалася речовина яка за думкою Шталя виділялася при горінні?
А) флогістон
б) філософський камінь
в) кисень
Питання 2.
Чому поняття «флогістон» було помилковим?
Питання 3.
Що, на вашу думку, відбуватиметься в процесі горіння, і чим це явище відрізнятиметься від поняття «флогістону»?
Відповіді:
- а
- флогістону не існує
- Під час горіння речовини сполучаються з киснем, а «флогістон», за думкою Георга Шталя, речовина, яка виділяється під час горіння.
Тест 6 (Правила безпеки)
У Сергійка сьогодні перша практична робота з хімії. З хвилюванням, хлопчик розглядав хімічний посуд та реактиви, які стояли на лабораторному столі. Не слухаючи вчителя, перше що зробив Сергій схопив пробірку та почав розглядати речовину, що там була налита, високо піднімаючи пробірку, учень пильно приглядався до неї. Потім носом торкнувшись отвору посудини понухав речовину. Махаючи рукою, він запросив сусіда по парті подивитися на його сполуку. Хотів ще посмакувати, але зупинився, вирішив не ризикувати.
Питання 1
Як називається найпоширеніший хімічний посуд, яким учні використовують в лаборатрії?
А) конічна колба
б) пробірка
в) хімічний стакан
Питання 2
Що Сергійко зробив правильно в лабораторії?
Питання 3.
Де Сегійко допустив помилки при роботі в хімічній лабораторії?
Відповіді
- б
- не скуштував речовину
- не слухав учителя, без дозволу взяв хімічний посуд, високо піднімав пробірку, не вірно нюхав речовину, розмахував руками, заважав сусіду по парті.
Тест 7 (Правила безпеки)
На другій практичній роботі, необхідно було нагрівати речовину в пробірці. Сергійко був впернений у своїх силах. Він швидко налив речовину у пробірку, тримаючи банку з реактивом етикеткою до долоні, потім закріпив пробірку в тримачі, дуже міцно її затискаючи, відстань, де закріплена була пробірка склала половину розміру посудини. Потім Сергій запалив пальник та став нагрівати речовину не прогріваючи всю пробірку, одразу з дна. Тримаючи пробірку вертикально вгору, учень ,час від часу, заглядав в отвір, перевіряючи не забурлило там у ній. Після закінчення нагрівання Сергійко закрив кришку пальника звергу, потім ще раз відкрив пальник, перевіряючи чи згас вогонь. Він був задоволений своєю роботою.
Питання 1.
Яким чином неохідно закривати пальник кришечкою?
А) зверху
б) збоку
в) не закривати взагалі
Питання 2
Які дії Сергійка були вірними?
Питання 3.
Опишіть помилки Сергійка при роботі з нагрівними приладами?
Відповіді:
- б
- наливав речовину тримаючи етикеткою до долоні.
- дуже міцно закріплена пробірка мое тріснути при нагріванні; відстань для закріплення тримача - близько 2 см від отвору пробірки; нагрівати потрібно під кутом 45°; обов'язково потрібно прогріти всю пробірку, лише потім гріти речовину в ній; не можна заглядати в пробірку під час нагрівання; пальник необхідно закривати кришкою збоку, та не відкривати її повторно.
Тест 8. (Речовина, матеріал, тіло)
Щодня ми продимо досить багато часу на кухні. Тут міститься велика кількість хімічних речовин, таких як: вода, кухонна сіль, питна сода, оцтова кислота, лимонна кислота. Взагалі в нашому світі величезна кількість речовин. На сьогодні їх відомо більше 20 мільйонів. З речовин складаються і океани, і скелі, і земля і повітря. Одні речовини перетворюються на інші. З речовин складаються тіла, що нас оточуюють.
Пригадайте, що тіла мають об'єм, форму, масу. Тілом є, наприклад, краплина води, зошит, шматок цукру. Тіла бувають природними та виготовленими людиною. Речовини або комплекс речовин з яких виготовляють тіла називають матеріалом. Іноді речовина і матеріал збігаються, а іноді ні. Наприклад, тіло – залізний цвях складається з матеріалу заліза, що є одночасно і речовиною; іншим прикладом буде тіло – зошит, що складається з матеріалу – паперу, та речовини – целюлози.
Питання 1.
Виберіть серед переліку тіло.
А) парта
б) деревина
в) целюлоза
Питання 2
Установіть відповідність між визначенням та поняттям.
- Те, що має масу і об'єм а) Матеріали
- Речовина, яка використовується б) Тіло
для виготовлення фізичних тіл
- Те, з чого складається фізичне тіло в) Речовина
Питання 3.
Розділіть окремо речовини, матеріали, тіла: кухонна сіль, вода, стілець, скло, дріт, пробірка, мідь, пластмаса, крига, зошит.
Відповіді: 1). а
- 1б, 2а, 3в
- кухонна сіль(1), вода(1), стілець(3), скло(2), дріт(3), пробірка(3), мідь(1), пластмаса(2), крига(2), зошит(3).
Тест 9. (Атом)
Вперше поняття атом застосував давньогрецький філософ Демокрит.
Він вважав, що існують в порожнечі дрібні неподільні частинки, які самі порожнечі не містять. Він припускав, що одні атоми містять гачки, а інші – ні. Цими гачками атоми чіплялися один до одного, тримаючись кучі та утворюючи щось тверде, наприклад каміння.
Далі, після великої перерви, поняттям атом зацікавився англійський вчений Джон Дальтон. Він стверджував: «Будь-яка хімічна реакція просто змінює порядок атомів». Вчений вперше пов'язав атом з хімічним елементом.
Сучасне формулювання атома – це найменша частинка речовини, яка не має електричного заряду і складається з ядра та електронів, що рухаються навколо нього. Заряд ядра атома збігається з порядковим номером елемента в Періодичній системі хімічних елементів. Ядро позитивно заряджене, а електрони – негативно. З атомів утворюються молекули.
Питання 1
В чому полягала особливість будови атома за Демокритом?
А) наявність гачків,
б) наявність ядра
в) наявність електронів
Питання 2
Яка частинка, на вашу думку, найдрібніша – електрон, атом чи молекула?
Питання 3.
Хімічні елементи мають в Періодичній системі хімічних елементів порядкові номери 11, 24, 36 та 80. Знайдіть заряди ядер цих атомів.
Відповіді:
1). А
2) електрон
3) +11, +24, +36, +80
Тест 10 (Молекула)
Багато речовин складаються з молекул. Видатний вчений середньовіччя Роберт Бойль, найдрібніші частинки речовини називав корпускулами, ці частинки з часом стали називати молекулами.
Молекула – частинка речовини, яка складається з двох або більшої кількості сполучених атомів. Атоми з'єднані між собою в певному порядку, в одній молекулі може об'єднуватися різне число атомів. Газ кисень складається з двох атомів, молекула води – з трьох, а молекула сахарози – з сорока п'яти.
Молекули мають свої властивості, і ці властивості визначають, якою буде речовина. Молекулярних речовин більшість. Серед них – майже всі гази, кислоти, органічні речоини.
Питання 1.
Хто вперше застосував термін молекула?
А) Демокрит
б) Ломоносов
в) Дальтон
Питання 2
Речовин з якою будовою переважна більшість: з атомною чи молекулярною?
Питання 3.
Формула глюкози С6Н12О6. Обчисліть число атомів в молекулі.
Відповіді:
- в
- молекулярною
- 24
Тест 11 (Йон)
Атом не має заряду, він – електронейтральний. Однак в природі електронейтральні атоми зустрічаються досить рідко. Часто під час хімічних реакцій, атоми віддають або приєднують електрони. Таким чином утворюється або надлишок електронів, або недостача їх. Атом перетворюється на заряджену частинку - йон.
Йони – це одноатомні або багатоатомні частинки, які мають електричний заряд. Вони утворюються з атомів в результаті втрати або приєднання електронів.
Якщо атом приймає електрон, то у нього з'являється надлишковий негативний заряд, він перетворюється на негативно заряджений йон.
0 + (-1) = -1
Якщо атом віддає електрон, то він набуває позитивного заряду, перетворюючись на позитивно заряджений йон.
0 – (-1) = +1
Питання 1.
Як називається частинка, яка віддається або приєднується під час хімічних реакцій?
А) ядро атома
б) електрон
в) атом
Питання 2.
Якого заряду набуде йон, якщо віддасть електрон: позитивного чи негативного?
Питання 3.
Атом Сульфуру приєднав два електрони. Якого заряду набув утворений йон Сульфуру ? Відповідь підтвердьте розрахунками.
Відповіді:
- б
- позитивного
- S0 +(-2) →S-2
Тест 12. (Властивості речовин)
Властивості речовини – це ознаки, за якими речовина відрізняється від іншої або подібна до неї. Властивості речовин бувають фізичними та хімічними. Густина, колір, ковкість – це фізичні властивості, вони проявляються при спостереженнях.
Найважливішими фізичними властивостями є: агрегатний стан, запах, блиск, колір, температури кипіння та плавлення, теплопровідність, електропровідність, густина, ковкість, пластичність.
Колір, запах та смак визначають органами чуттів. Інші властивості – вимірюванням, результати яких поміщають в спеціальній довідниковій літературі.
Питання 1.
Яка з перелічених властивостей НЕ належить до фізичних?
А) колір
б) пластичність
в) виділення газу
Питання 2
Вибрати з переліку фізичних властивосей ті, що відповідають залізу.
Перелік: електропровідний, червоного кольору, твердий, рідкий, газоподібний, притягується магнітом, ковкий, крихкий.
Питання 3.
Описати властивості кухонної солі.
Відповіді:
- в
- електропровідний, твердий,притягується магнітом, ковкий.
- Білого кольору, розчинна у воді, солона на смак, тверда, крихка, тугоплавка, не проводить тепло та електрику ( в сухому стані)
Тест 13 (Спостереження, експеримент)
На уроках хімії учні працюють з великою кількістю речовин, тому необхідно вміти їх описувати, виявляти властивості, порівнювати з іншими речовинами. Дослідження будь-якої речовини розпочинається з спостереження. Спостереження – це активне, цілеспрямоване і навмисне сприйняття об'єкта для отримання знань про його властивості. Щоб описати властивості речовини, ми повинні уважно її спостерігати. Але іноді лише спостереження недостатньо. Щоб дослідити подальші властивості необхідно проводити експеримент.
Експеримент – метод пізнання, за допомогою якого в певних умовах отримують відомості про зв’язки між явищамит й об’єктами. Хімія – експериментальна наука. Вона не може існувати без здійснення різних дослідів з речовинами.
Питання 1
Який етап дослідження речовин стоїть на першому місці?
А) експеримент
б) обчислення даних
в) спостереження
Питання 2
Які методи необхідно застосовувати для повного вивчення речовини?
Питання 3
Опишіть процес кипіння води, окремо з точки зору спостереження та з точки зору експерименту.
Відповіді:
- в
- спостереження, екперимент, обчислення, висновки.
- дивитися, як кипить вода – спостереження, вимірювання температури кипіння води та часу закіпання – експеримент.
Тест 14 (Чисті речовини, суміші)
Чи трапляються в природі чисті речовини? Так, але значно частіше трапляються суміші речовин. Чиста речовина має постійний склад і властивості. Коли говорять про якусь речовину, мається на увазі, що вона є чистою й складається з частинок одного виду. Але на практиці ідеально чисту речовину отримати майже неможливо. Серед частинок однієї речовини обов'язково зустрінеться декілька частинок іншої. Тому, найчастіше, ми маємо справу із сумішами. Суміші мають змінний склад. Властивості окремих речовин у суміші зберігаються.
Суміші бувають однорідними та неоднорідними. Однорідна - це така суміш частини якої не можна побачити неозброїним оком, на відміну від неоднорідної, частини якої ми можемо розрізнити.
Питання 1.
Речовина, яка складається з одного виду атомів називається:
а) суміш
б) чиста речовина
в) аерозоль
Питання 2
Розділіть окремо чисті речовини та суміші: мінеральна вода, дистильована вода, мідь, нафта, кефір, цукор.
Питання 3
З чим пов'язане, на вашу думку, додавання до золота інших металів (міді або срібла). Ци необхідно це робити. Як у стародавні часи перевіряли золоті моенти на підробку?
Відповіді:
- б
- Чисті – дистильована вода, мідь, цукор; суміші – мінеральна вода, нафта, кефір.
- Чисте золото дуже м'який метал, предмети з якого можуть зіпсуватися навіть від слабкого удару,тому до ювелірних виробів додають більш міцні срібло та мідь. В стародавні часи монети із золота перевіряли «на зуб». Якщо зуби залишали на монеті сліди, то вона - із чистого золота.
Тест 15 (Способи розділення сумішей)
Чи можна розділити суміш на окремі компоненти? Можна, якщо знати фізичні властивості речовин, із яких вона складається. Суміш, компоненти якої дуже відрізняються за властивостями розділити легко. Але якщо властивості речовин подібні – це досить важко.
У курсі природознавства ви онайомилися зі способами розділення сумішей. Пригадайте їх. Фільтрування, відстоювання, випарювання – для розділення твердих частинок з суміші. Декантація та дистиляція – розділення рідких частин суміші. Дією магніту можна відділити залізо.
Питання 1
Яким методом можна відділити річкову воду від мулу?
А) дистиляція
б) фільтрування
в) випарювання
Питання 2
На чому базується розділення сумішей?
Питання 3
Складіть план розділення суміші: сіль + залізні ошурки+ крейда.
Відповіді:
- б
- Розділення сумішей базується на тому, що властивості речовин, які входять до складу суміші, зберігаються.
- а) зібрати залізні ошурки магнітом
б) розчинити суміш, що залишилася у воді
в) профільтрувати суміш (на фільтрі - пісок, у фільтраті – розчинена у воді сіль)
г) випарити воду (залишиться сіль)
Тест 16 (Хімічні елементи)
Ми знаємо, що всі речовини складаються з молекул, атомів чи йонів. Молекули і йони утворюються з атомів. Отже, все в природі утворюється з атомів. Нині на Землі відомо 89 атомів, 30 - добуто штучно. Атоми певного виду – хімічні елементи.
Хімічні елементи – це абетка хімії, як літери утворюють слова, хімічні елементи утворюють велику кількість хімічних сполук. Шведський хімік Берцеліус запронував для позначення хімічного елемента використовувати першу літеру його латинської назви, а в разі збігу перших літер – використовувати другу.
Питання 1
Назвіть прізвище вченого, який вперше ввів позначення хімічних елементів.
А) Меделєєв
б) Дальтон
в) Берцеліус
Питання 2.
Що називається хімічним елементом ?
Питання 3.
Назвіть хімічні елементи, сиволи яких: H, O, C, Mg, Na, Ar, N, Fe, K, Al.
Відповіді:
- в
- Хімічний елемент – це різновид атомів з однаковим зарядом ядра
- Гідроген, Оксиген, Карбон, Магній, Натрій, Аргон, Нітроген, Ферум, Калій, Алюміній.
Тест 17 (Періодична система)
Всі відомі на сьогодні хімічні елементи розміщені в Періодичній системі хімічних елементів Дмитра Івановича Менделєєва. Вона була створена в 1869 році. На час створення таблиці було відомо 63 хімічних елементи. Система складається з періодів – горизонтальних рядів, груп – вертикальних стовпчиків елементів.
Групи об'єднують елементи з подібними властивостями. Перетинаючись періоди і групи утворюють клітинки, де міститься найважливіша інформація про хімічні елементи: номер елементу, назва, символ, атомна маса. Як кожна людина, хімічний елемент має власну «адресу». Що описати положення елемента в Періодичній системі, треба назвати його порядковий номер, а також номер групи і періоду.
У періодичній системі всі елементи розміщені за зростанням заряду ядер атомів.
Питання 1
Як називається горизонтальний рядок хімічних елементів?
А) період
б) група
в) підгрупа
Питання 2
Скільки існує періодів і груп в короткому варіанті Періодичної системи?
Питання 3
Охарактеризуйте хімічний елемент Барій за таким планом:а) символ, б) номер, в) номер групи, г) номер періоду.
Відповіді:
- а
- груп – 8, періодів – 7.
- а) Ва, б) 56, в) 2. Г) 6
Тест 18 (Поширеність хімічних елементів)
Атоми елементів, які зустрічаються в природі, розподілені в ній дуже нерівномірно. Деякі елементи зустрічаються постійно, а інші дуже рідкісні.У космосі поширені легкі елементи: Гідроген – перший і найлегший елемент Періодичної системи (93%), Гелій (Гелій – 6,9 %), на іші елементи припадає лише 0,1%.
Атмосфера містить найбільше Нітрогену(78%), Оксиген (близько 21%), що буде входити до складу кисню, посідає лише друге місце.
У земній корі (Літосфері) найбільше атомів Оксигену (58%), Силіцію (19,6%) та Алюмінію(6,4%). Ферум і Нікель формують земне ядро.
Гідросфера має найбільше Гідрогену, який входить до складу води.
Живі організми також складаються з атомів різних хімічних елементів. Організм людини має найбільше Карбону, Гідроену, Оксигену та Нітрогену.
Питання 1.
Якого елементу найбільше у Всесвіті?
А) Карбону
б) Гідрогену
в) Гелію
Питання 2
Який елемент, на вашу думку, буде третім за поширеністю в космосі?
Питання 3.
Нестача деяких елементів викликає хвороби організму людини. Яких з хвороб можна уникнути, якщо отримувати достатню кількість Феруму, Флуору та Йоду?
Відповіді:
а) б
б) Літій
в) Ферум - недокрів'я, Флуор – карієс, Йод – уповільнення розумового розвитку.
Тест 19 (Відносна атомна маса)
Важливою характеристикою атома є його маса. Атоми – надзвичайно маленькі частинки. Маса в них є, але і вона буде дуже маленькою.Майже вся маса атома зосереджена в ядрі, бо електрони мають таку малу масу, що нею зазвичай нехтують. Зважити атом, як, наприклад, цукор, неможливо, тому його вагу встановлюють розрахунками.
Маса найлегшого атома в природі – Гідрогену приблизно дорівнює 0,000000000000000000000001673 г або 1,673·10-24г, а маса найважчого серед існуючих елементів – Урану становить 0,0000000000000000000004 г або 4·10-22 г.
Звичайно незручно користуватися такими громіздкими числами, можна легко помилитися. Тому Джон Дальтон запропонував використовувати не реальну, а відносну атомну масу. Як одиницю виміру довго використовувався Гідроген – найлегший атом. Лише з 1961 року почали використовувати Карбон для порівняння. Нині відносна атомна маса показує, у скільки разів маса атома більша 1/12 маси атома Карбону.
Питання 1
Маса якого елемента використовується для порівняння з іншими масами атомів?
А) Гідрогену
б) Оксигену
в) Карбону
Питання 2
Чому незручно використовувати для розрахунків реальні маси атомів?
Питання 3
У скільки разів маси атомів Карбону, Оксигену, Магнію та Неону більші за масу атома Гелію?
Відповіді:
- в
- тому що реальні маси атомів дуже малі, з великою кількістю нулів, дуже легко допустити помилку при розрахунку.
- С – 12/4=3; О – 16/4=8; Mg – 24/4=6; Ne – 20/4=5
Тест 20 (Прості речовини – метали і неметали)
Всі речовини можна поділити на дві групи, залежно від того, які елементи входять до їх складу. Речовини утворені одним хімічним елементом, називають простими, а речовини, утворені кількома елементами – складними. Вперше поділ простих речовин на метали і неметали запропонував французький вчений Антуан-Лоран Лавуазьє. Метали утворені металічними елементами, а неметали – неметалічними. Існують також елементи названі «перехідними», що в сполуках виявляють властивості як металів, так і неметалів.(Ве,Gе)
Метали зазвичай тверді, ковкі, пластичні, теплопровідні, електропровідні , мають специфічний «металічний» блиск, кольори металів зазвичай різних відтінків сірого. Усі метали є речовинами немолекулярної будови.
Неметали – крихкі, мають матову поверхню, забарвлені в різні кольори, погано проводять електричний струм ( виняток – графіт) і теплоту, мають різний агрегатний стан. Неметали можуть мати як немолекулярну, так і молекулярну будову.
Питання 1
Хто вперше поділив прості речовини на метали і неметали ?
а) Дальтон
б) Лавуазьє
в) Менделєєв
Питання 2
Назвіть рідкий метал. Де він використовується?
Питання 3
Що відрізняє золото від інших металів? Вкажіть його особливості.
Відповіді:
- б
- ртуть, в термометрах
- Золото має жовтий колір, воно дуже пластичне, його можна витягнути в дріт, що тонше десткт тисяч разів за людську волосину., часто застосовують так зване «сусальне» золото, для покриття куполів церковних храмів.
Тест 21 (Назви простих речовин)
Назва простої речовини часто відрізняється від назви відповідного хімічного елемента: наприклад, Оксиген утворює просту речовину кисень, молекула якого складається з двох атомів Оксигену, Гідроген утворює просту речовину водень.
Більшість простих речовин називаються так, як і відповідні хімічні елементи: наприклад , магній - проста речовина, Магній – хімічний елемент. Назви простих речовин записують з малої літери, на відміну від назв хімічних елементів. Наприклад, речовина натрій складається з атомів Натрію, а речовина хлор складається з молекул, утворених двома атомами Хлору.
Питання 1
Яка назва простої речовини утвореної атомом Оксигену?
А) вуглець
б) водень
в) кисень
Питання 2
Встановіть відповідність між назвами хімічних елементів і простими речовинами.
- Золото а) Сульфур
- Мідь б) Аурум
- Сірка в) Карбон
- Вуглець г) Купрум
Питання 3.
Заповніть пропуски, вставивши у відповідних відмінках, слова «Оксиген» або «кисень»
а) ….входить складу атмосфери
б) Молекула … складається з двох атомів…
в) Риби дихають розчиненим у воді …
г) Вода містить два атоми Гідрогену та один атом…
Відповіді:
- в
- 1б , 2г, 3а, 4в
3) а) Кисень входить складу атмосфери.
Б) Молекула кисню складається з двох атомів Оксиген.
В) Риби дихають розчиненим у воді киснем.
Г) Вода містить два атоми Гідрогену та один атом Оксигену.
Тест 22 (Складні речовини)
До складних речовин належать речовини, які складаються з атомів різних елементів. Складні речовини також називають хімічними сполуками. В природі існує значно більше складних речовин, ніж простих. Складні речовини можуть бути утворені різною кількістю елементів. Наприклад, хлоридна кислота – HCl (2 хімічні елементи), мармур – СаСО3 (3 хімічні елементи), питна сода – NaHCO3 (4 хімічні елементи).
Складні речовини слід відрізняти від сумішей простих речовин. Наприклад, Fe – залізо + S – сірка не дорівнює FeS (ферум(ІІ) сульфід).
Більшість складних речовин мають молекулярну будову (вода, глюкоза), деякі сполуки мають атомну будову (кварц ), йонну будову (кухонна сіль). Назви складних речовин бувають як традиційні, так і наукові (вода, або гідроген оксид).
Питання 1
Скільки хімічних елементів входять до складу складних речовин?
А) один
б) два і більше
в) хімічні елементи не входять до складних сполук
Питання 2
Якими елементами утворені складні речовини з такими хімічними назвами: магній оксид, гідроген сульфід, натрій хлорид.
Питання 3
Розпізнайте речовину, складіть формулу, визначте проста вона чи складна. Прекрасні перли, мармурові статуї, вапняк і крейда, якою ми пишемо, утворені із сполуки, молекула якої складається з 1 атома Кальцію, 1 атома Карбону, 3 атомів Оксигену.
Відповіді:
- б
- MgO, H2S, NaCl.
- СаСО3 – кальцій карбонат, складна речовина.
Тест 23 (Хімічна формула)
Склад речовин записують за допомогою хімічних формул. Як у першому класі ви вчилися із літер складати слова, так у сьомому класі на уроках хімії , ви учитеся із символів хімічних елементів записувати формули сполук.
Хімічна формула – це умовне позначення складу речовини за допомогою символів хімічних елементів та індексів. Тобто – це запис символів елементів, що входять до складу речовини, з вказівкою кількості їх атомів у молекулі за допомогою індексу – маленької цифри праворуч від символу елемента, до якого він належить (Н2О). Коефіцієнт – це велика цифра, яка ставиться попереду всієї формули, і відноситься до кожного атома в сполуці перед якої стоїть.
Якісний склад формули – це які елементи входять до її складу. Кількісний склад формули – це скільки атомів кожного виду входять до складу хімічної формули.
Питання 1
У записі 4СаСО3 індекс матиме значення ?
а) 1
б) 3
в) 4
Питання 2
Прочитай і запиши письмово вимову формул: CO2, CH4, NaHCO3, (NH4)2SO4.
Питання 3
Визначіть якісний та кількісний склад глюкози С6Н12О6.
Відповіді:
- б
- це-о-два, це-аш-чотири,натрій-аш-це-о-три, ен-аш-чотири-двічі-ес-о-чотири.
- Якісний склад: Карбон, Гідроген, Оксиген.
Кількісний склад: шість атомів Карбону, дванадцять атомів Гідрогену, шість атомів Оксигену.
Тест 24 (Валентність)
Ще багато років тому вчені встановили, що атоми з'єднуються не хаотично, а сполучаються в певній послідовності. Сьогодні цю здатність називають валентністю.
Валентність – це здатність атома сполучатися з певною кількістю таких самих або інших атомів.
За одиницю валентності приймають валентність атома Гідрогену. Вона дорівнює одиниці. За кількістю атомів Гідрогену, які може приєднати атом, можна визначити його валентність.
Сума одиниць валентностей атомів одного елемента у сполуці дорівнює сумі одиниць валентностей атомів іншого елемента.
Дечкі елементи виявляють сталу валентність. Інші – змінну. Часто для визначення валентності використовують Періодичну систему.
Питання 1
Валентність якого атома прийнято за одиницю вимірювання валентності?
А) Гідрогену
б) Оксигену
в) Карбону
Питання 2
Наведіть приклади хімічних елементів з постійною валентністю.
Питання 3
Які валентності можливі у Сульфуру, Хлору, Карбону.
Відповіді:
- а
- Оксиген – ІІ, Гідроген – І, Алюміній – ІІІ.
- Сульфур – ІІ, IV, VI
Хлор – I , III, V, VII
Карбон - II, IV
Тест 25 (Валентність)
Для визначення валентності в бінарній сполуці (сполуці, що складається з двох хімічних елементів) необхідно дотримуватися таких правил (алгоритму):
- Записати формулу речовини
- Позначити відому валентність
- Знайти загальну кількість валентностей відомого елемента (для цього значення валентності множиться на число атомів того елементу, в якого відома валентність).
- Знайти валентність іншого елемента (для цього знайдену загальну кількість валентностей відомого елемента ділять на кількість атомів елемента з невідомою валентністю)
- Позначають знайдену валентність.
Питання 1
Яка валентність в атома Оксигену ?
а) один
б) два
в) три
Питання 2
Визначте валентність елементів у сполуках з Гідрогеном: HBr, H2S, PH3, CaH2, GeH4, KH.
Питання 3
Визначте в якій сполуці валентність Мангану буде максимальною:MnO, MnO2, Mn2O3, Mn2O7.
Відповіді:
- б
- HBr(І), H2S(ІІ), PH3(ІІІ), CaH2(ІІ), GeH4(ІV), KH(І)
- MnO(ІІ), MnO2(IV), Mn2O3(III), Mn2O7(VII). Максимальна валентність – VII в Mn2O7.
Тест 26 (Валентність)
Щоб скласти формулу сполуки за відомою валентністю потрібно дотримуватися таких правил:
- Записуємо символи елементів у необхідному порядку та надписуємо їхню валентність.
- Знаходимо найменше спільне кратне (НСК) для значень валентностей обох елементів.
- Знаходимо індекси у формулі, для цього НСК почергово ділимо на значення валентності кожного з атомів.
- Записуємо індекси після символів елементів у сполуці.
Складаючи формули бінарних сполук, враховуйте, що елемент, який стоїть на другому місці у формулі, завжди виявляє свою найнижчу валентність.
Питання 1
Яка валентність у Алюмінію?
А) один
б) два
в) три
Питання 2
Складіть формули сполук утворених елементами зі сталою валентністю: K…H…, Mg…Cl…, Al…O…, H…O… .
Питання 3
Складіть форму ли оксидів таких елементів: Na, Cu(II), Cu(I), Fe(II), Fe(III), Ca.
Відповіді:
- в
- KH, MgCl2, Al2O3, H2O .
- Na2О, CuО, Cu2О, FeО, Fe2О3, CaО.
Тест 27 (Відносна молекулярна маса)
Маси молекул, як і маси атомів, дуже малі. Тому для їх обчислення, як ідля обчислення мас атомів, використовують порівняння з атомною одиницею маси.
Відносна молекулярна маса – це відношення маси молекули до 1/12 маси атома Карбону.
Відносна молекулярна маса позначається – Mr (читається –емрелятіве). Вона показує, в скільки разів маса молекули більша за 1/12 маси атома Карбону, і ,як і відносна атомна маса, не має розмірності.
Відносна молекулярна маса дорівнює сумі відносних атомних мас атомів хімічних елементів, що входять до складумолекули, з урахуванням числа атомів кожного елемента.
Існує багато речовин, які не мають молекулярної будови. Для них розраховують відносну формульну масу, яка має таке саме позначення і таке саме обчислення, як і відносна молекулярна маса.
Питання 1
Яке значення відносної атомної маси для Хлору?
а) 35
б) 35,5
в) 36
Питання 2
Обчисліть відносну молеуклярну масу крейди (СаСО3).
Питання 3
Яка з молекул важча: С12Н22О11 чи С6Н12Cl6 ?
Відповіді:
- б
- Mr(СаСО3) = Ar(Ca) + Ar(C) + 3· Ar(O) = 40+12+3·16 = 100
- Mr (С12Н22О11) = 12·12+22·1+11·16=342
Mr (С6Н12Cl6) = 6·12+12·1+6·35,5 = 297
Маса С12Н22О11 більша.
Тест 28 (Масова частка елемента в складній речовині)
У хімічній формулі речовини міститься певна інформація. Особливо важливо знати кількісний склад сполуки. Люди не будуть розробляти родовища з рудою, яка містить малий вміст корисної сполуки, це економічно не вигідно. Тому вводять поняття кількісний вміст хімічного елемента у сполуці – це масова частка елемента.
Масова частка елемента в сполуці – це відношення маси елемента до віповідної маси сполуки. Позначення ω (дубль-ве). Масова частка елемента звичайно вимірюється у відсотках, але іноді її виражають у частках від одиниці.
Якщо маса сполуки невідома, використовують для розрахунків відносну молекулярну, або відносну формульну масу.
Питання 1
Скільки дорівнює відносна молекулярна маса вуглекислого газу (СО2) ?
а) 12
б) 44
в) 28
Питання 2
У сполуці масою 32 г міститься 16 г Сульфуру. Обчисліть масову частку Сульфуру в сполуці.
Питання 3.
Обчисліть масові частки всіх хімічних елементів у вуглекислому газі (СО2).
Відповіді:
- б
-
ω(S)=
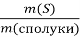 =
= 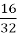 =0,5 або 50%
=0,5 або 50%
3)
|
Дано: СО2 |
Розв'язання
Mr(CO2)= 12+2·16=44
ω (С) =
ω(О)= 100% - 27,3% = 72,7% Відповідь: ω(С) -27,3% ω (О)- 72,7% |
|
Знайти: ω(С) -? ω (О)-? |
Тест 29 (Фізичні та хімічні явища)
У навколишньому світі постійно відбуваються зміни. Змінюються пори року, день і ніч, вода в річці рухається, тане лід, кипить вода в чайнику. Всі ці процеси називають явищами.
Фізичні явища – це явища, під час яких речовина не перетворюється на іншу.
Хімічні явища – це явища, під час яких одні речовини перетворюються на інші. Хімічні явище називають хімічними реакціями.
Речовини, що вступили у хімічну реакцію, називають вихідними речовинами, або реагентами, а ті, що утворилися – кінцевими речовинами, або продуктами реакцій.
Хімічні реакції супроводжуються зовнішніми ефектами: появою забарвлення, або його зміною, виділенням газу, утворенням осаду, виділенням теплоти.
Питання 1
Під час хімічної реакції речовини…
а) не змінюються
б) перетворюються на інші речовини
в) утворюють нові атоми
Питання 2
Визначіть фізичні та хімічні явища: кування заліза, горіння вугілля, прокисання молока, танення льоду, обвуглення цукру,утворення туману.
Питання 3.
Якими зовнішніми ефектами супроводжуються такі хімічні реакції: горіння свічки, бродіння яблучного соку,
Відповіді:
- б
- Фізичні - кування заліза, танення льоду, утворення туману.
Хімічні - горіння вугілля, прокисання молока, обвуглення цукру.
- Горіння свічки – виділення тепла і світла.
Бродіння яблучного соку – поява неприємного запаху, виділення вуглекислого газу
Тест 30 (Закон збереження маси речовини)
Вивчення законів хімії розпочнемо із закону збереження маси речовини, відкритого Михайлом Васильовичем Ломоносовим у 1748 році.
Спалюючи шматок деревини, хіміки добували попіл, що мав меншу масу, ніж вихідна речовина. І, навпаки, прожарювання металів давало продукт більшої маси. Ломоносов провів дослід із прожарювання металів у запаяних ретортах. У скляні посудини він помістив свинцеві, мідні та залізні ошурки.
Зважуючи реторти до і після реакції, він побачив, що їх маси залишилися незмінними, а зовнішній вигляд металів змінився: свинцеві ошурки покрилися сірувато-жовтим нальотом, мідні – перетворилися на чорно-коричневий порошок, а залізні – почорніли, що свідчило про перебіг хімічних реакцій.
У 1789 році французький вчений Лавуазьє виявив кисень у складі повітря і підтвердив тим самим геніальність відкриття Ломоносова, що при прожарюванні речовин на повітрі вони взаємодіють з киснем. Тому тепер цей закон збереження маси часто називають законом Ломоносова – Лавуазьє. Сучасне формулювання закону Ломоносова –Лавуазьє таке: маса речовин, що вступили в реакцію, дорівнює масі речовин, які утворилися в результаті реакції.
Питання 1.
Хто вперше відкрив закон збереження маси речовин?
а) Лавуазьє
б) Дальтон
в) Ломоносов
Питання 2.
Після догоряння багаття залишається купка попелу набагато меншої маси, ніж маса дров. Чи суперечить це закону збереження маси речовин?
Питання 3.
Унаслідок взаємодії 8 г метану з 32 г кисню утворилося 22 г вуглекислого газу й вода. Обчисліть, яка маса води виділилася в результаті цієї реакції.
Відповіді:
- в
- Ні, під час горіння утворюється вуглекислий газ, який також має масу, він випаровується в повітря.
3)
|
Дано: m (метану) = 8 г m (кисню) = 32 г m (вуглекислого газу) = 22 г |
Розв'язання
Метан + кисень = вуглекислий газ + вода m (води) = (m (метану) + m (кисню)) - m (вуглекислого газу) m (води) =(8+32) – 22 = 18 г Відповідь: m (води) = 18 г |
|
Знайти: m (води) -? |
Тест 31 (Хімічні рівняння)
Відповідно до закону збереження маси речовин, число атомів різних елементів під час хімічної реакції не змінюється. Число атомів одного елемента до і після реакції мають дорівнювати. Це має бути відображено в схемі хімічної реакції, тоді вона стає хімічним рівнянням.
Хімічне рівняння – це умовний запис хімічної реакції за допомогою хімічних формічних формул і коефіцієнтів.
Умовно записувати хімічні реакції намагалися ще в середні віки. Однак тоді алхіміки приховували свої знання та зашифровували записи. Зараз рівняння хімічних реакцій записують на основі загально-прийнятих положень. Якщо говорити про те, що символи хімічних елементів – це літери хімічної мови, тоді формули сполук – це слова, а рівняння реакцій – цілі вислови.
Питання 1.
Що перетворює хімічну схему на хімічне рівняння ?
а) дописування необхідної кількісті хімічних символів елементів;
б) врівнювання за допомогою коефіцієнтів;
в) врівнювання за допомогою індексів.
Питання 2
Перетворіть схеми хімічних реакцій на рівняння: Na + Br2 → NaBr; H2O2 → H2O +O2; KClO3 → KCl + O2.
Питання 3
Допишіть прості речовини, що утворюють наведені сполуки, та складіть рівняння:
а) … + … → MgO ;
б)… + … → P2O5 ;
в) … + … → NaCl ;
г)… + … → Al2O3 .
Відповіді:
- б
- 2Na + Br2 → 2NaBr; 2H2O2 → 2H2O +O2; 2KClO3 → 2KCl + 3O2.
- а) 2Mg + O2 → 2MgO ;
б) 4P + 5O2 → 2P2O5 ;
в) 2Na + Cl2 → 2NaCl ;
г) 4Al + 3O2 →2Al2O3 .
Тест 32 (Оксиген. Кисень.)
Оксиген – це дивовижний елемент. Він знаходиться навколо нас і в нас. Ми дійсно ходимо по Оксигену. Дихаємо його сполукою, п'ємо оксигеновмісну сполуку – воду.Відомо, що людина кілька тижнів може прожити без їжі, кілька днів без води, а без дихання – кілька хвилин. Тому кисень – найважливіша сполука.
Оксиген отримав свою назву від А, Лавуазьє. Із латини Оксиген означає «той, що народжує кислоту»
Оксиген тісно пов'язаний майже з усіма елементами періодичної системи, оскільки з кожним із них Оксиген утворює певні сполуки. Виняток складають лише легкі інертні гази- гелій, неон, аргон.
Оксиген входить до складу величезної кількості складних речовин: оксидів, кислот, лугів, солей. Живі організми також містять велику кількість Оксигену. У складі різних сполук Оксиген становить близько 65% маси тіла людини.
Питання 1
Як називається хімічний елемент, який утворює просту речовину кисень?
а) Гідроген
б) Карбон
в) Оксиген
Питання 2.
Живу троянду занурили у посудину з рідким киснем. Поясніть, чому квітка стала крихкою?
Питання 3.
Чи можна виділити чистий кисень із повітря дією магніту ?
Відповіді:
- в
- Рідкий кисень має температуру -183°С, втроянді міститься вода, яка замерзає при температурі 0°С, тому квітка стає крихкою.
- Ні – газоподібний кисень не притягується магнітом, на відміну від рідкого кисню, на який магніт діє.
Тест 33 (Відкриття кисню)
Вперше кисень відкривають в Китаї ще у восьмому столітті нашої ери, але у Європі це відкриття сталося лише через 1000 років. Шведський учений Карл Шеєле, спалював у закритій колбі фосфор, потім занурював колбу з утвореною речовиною у воду, і вона наповнювалася на 1/5 об'єму водою. Вчений припустив, що в колбі повітря вже інше, тим паче воно не підтримувало горіння, палаюча скіпка гасла. Після великої кількості дослідів із розкладу селітри, Шеєле нарешті отримав «вогненне повітря», в якому горіла, ледь жевріюча скіпка.
Одночасно «вогенне повітря» було відкрите ще двома вченими.
Джозеф Прістлі сонячним промінням нагрівав у пробірці меркурій (ІІ) оксид і отримав значну кількість газу, в якому свічка яскраво спалахувала. Але лише Лавуазьє правильно оцінив значення відкритя кисню. Він довів, що повітря – це суміш здебільшого двох газів – азоту і кисню.
Питання 1.
В якій країні, в давні часи, вперше було відкрито кисень ?
а) Китай
б) Швеція
в) Англія
Питання 2
Чому , на вашу думку, сьогодні не використовують дослід Прістлі по добуванню кисню в шкільній лабораторії?
Питання 3
Нітратна кислота, що має формулу HNO3, під дією світла або при нагріванні розкладається з утворенням бурого газу NO2, води та кисню.Запишіть рівняння цієї реакції.
Відповіді:
- а
- Ртуть, яка утворюється під час досліду, отруйна.
- 4HNO3 → 4NO2 + 2Н2О + О2
Тест 34 (Добування кисню)
Цікавим фактом є те, вперше кисень винайшли не хіміки. Це зробив винахідник підводного човна датчанин Корнеліус ван Дреббель на початку сімнадцятого століття. Він використав для дихання на підводному човні газ, який добув нагріванням селітри. Але роботи винахідника були засекречені, тому не відіграли важливої ролі для розвитку хімії.
В промисловості кисень добувають використовуючи найдешевшу сировину, повітря яке нас оточує. Повітря сильно охолоджують до перетворення його на рідину. Потім температуру зрідженого повітря поступово підвищують. Першим із нього виділяється азот (-196°С), потім - кисень (-183°С).
У лабораторії кисень добувають, розкладаючи складні сполуки, що містять Оксиген: воду, гідроген пероксид, меркурій(ІІ) оксид, калій перманганат, калій нітрат, калій хлорат.
Питання 1
Яку речовину використав Дреббель для добування кисню, на підводному човні?
а) бертолетову сіль
б) перекис водню
в) селітру
Питання 2
На яких принципах базуються способи збирання кисню?
Питання 3
Як у природі утворюється кисень?
Відповіді:
- в
- витіснення води – кисень погано розчиняється у воді; витіснення повітря – кисень важчий за повітря.
- З вуглекислого газу та води, за допомогою зелених рослин та сонячного світла (фотосинтез).
Тест 35 (Хмічні властивості кисню)
Кисень є однією з найактивніших речовин. Із багатьма речовинами кисень реагує при нагріванні. Кисень підтримує дихання і горіння. У чистому кисні може спалахувати жевріюча скіпка, можуть спалахувати деякі речовини: бензин, спирт, машинне масло. У більшості випадків унаслідок взаємодії речовин із киснем утворюються бінарні сполуки, до складу яких входять атоми Оксигену. Такі сполуки – оксиди.. Оксиген утворює оксиди як з металами, так і з неметалами.
Горіння складних речовин принципово не відрізняється від горіння простих речовин. Різниця полягає в тому, що при горінні складних речовин утворюються кілька оксидів (залежно від того, скільки елементів входять до складу речовини). Таким чином, при горінні складних речовин, у більшості випадків, утворюються оксиди всіх елементів, які входять до складу цієї речовини.
Питання 1
Бінарні сполуки які містять в своєму складі Оксиген, це:
а) кислоти
б) основи
в) оксиди
Питання 2
Підкресліть формули оксидів, дайте їм назви: NO2, HNO3, Fe2O3, KClO3, SiO2, Mn2O7, CO, CO2, H2SO4, NaOH, PbS.
Питання 3
Допишіть рівняння горіння простих і складних речовин:
Mg + O2 →
Na + O2→
Cu(I) + O2 →
Cr(III) + O2→
CH4+ O2 →
Відповіді:
- в
- NO2 (нітроген (ІV) оксид), Fe2O3 (ферум(ІІІ) оксид), SiO2 (силіцій(ІV) оксид), Mn2O7 (манган(VII) оксид), CO (карбон(ІІ) оксид), CO2 (карбон(ІV) оксид).
- 2Mg + O2 → 2MgO
4Na + O2→ 2Na2O
4Cu(I) + O2 → 2Cu2O
4Cr(III) + 3O2→ 2Cr2O3
CH4+ 2O2 →CO2 +2H2O
Тест 36 (Вода)
На нашій планеті є речовина, якій зобов'язане своїм існуванням усе живе. Звичайно, ця речовина – вода. Вона втамовує спрагу, знімає втому, дає енергію. Океан займає 71% поверхні Землі. Значні запаси води на Землі створюють враження про її невичерпність. Однак для споживання доступна лише маленька частина всієї води (річки, озера містять лише 0,03% води). Вода є прекрасним розчинником. Вона входить до складу клітин і тканин будь-якої тварини і рослини. Вода бере участь у численних хімічних перетвореннях, які вдбуваються у природі. Наприклад, процес травлення у людини потребує не менше 9-10 л водиди на добу. Втрата 10-20% води організмом призводить до смерті.
Як і кожна хімічна сполука вода має певні властивості. Вона безбарвна, прозора, без запаху, без смаку, текуча, не має форми.
Питання 1
Визначіть формулу води.
а) Н2О
б) Н2О2
в) НО2
Питання 2
В чому полягає причина універсальності води, як розчинника?
Питання 3
Чому в замерзлих водоймах риба виживає? Як це пов'язано з властивостями води?
Відповіді:
- а
- Молекула води полярна, тому, особливо добре, в ній будуть розчинятися сполуки з полярними молекулами.
- Лід трохи легший за воду, між молекулами води у льоді існують порожнини, вони і тримають лід на поверхні води, водойми не промерзають до дна. Це рятує рибу.
Тест 37 (Вода – розчинник)
Найчастіше ми маємо справу не з чистими речовинами, а з розчинами. Вода океанів, джерел, питна вода – це розчини. Лаки, фарби, ліки, парфуми – це розчини. Наш організм – це розчин.
Розчин – це однорідна суміш речовин. Він складається з розчиненої речовини та розчинника.
Розчини бувають твердими (сплави), рідкими (чай, столовий оцет), газоподібні (повітря). Речовини за розчинністю у воді поділяють на: добре розчинні, малорозчинні, майже нерозчинні. Абсолютно нерозчинних речовин не існує. Кількісною характеристикою розчину є масова частка розчиненої речовини (ω(речовини)).
Масова частка розчиненої речовини – це відношення маси розчиненої речовини до маси розчину. Вона виражається у відсотках або в частках від одиниці.
Питання 1.
Компонент розчину, що перебуває в тому самому агрегатному стані, що і розчин, це:
а) розчинена речовина
б) розчинник
в) розчинність
Питання 2
Оберіть з переліку розчинні речовини: крейда, цукор, олія, пісок, кухонна сіль, мило, оцтова кислота, глина, лимонна кислота, сода, гіпс.
Питання 3
В 200 г води розчинили 40 г цукру.Обчисліть масову частку цукру в розчині.
Відповіді:
- б
- цукор, кухонна сіль, мило, оцтова кислота, лимонна кислота, сода.
3)
|
Дано: m(води) =200 г m(цукру) = 40 г |
Розв'язання
m(розчину) = m(води)+ m(цукру) m(розчину) = 200 + 40 = 240 г
ω(цукру) =
ω(цукру) = Відповідь: 16,7% |
|
Знайти: ω(цукру) -? |
Тест 38 (Виготовлення розчину)
У повсякденному житті нерідко виникає потреба приготувати водний розчин із певною масовою часткою розчиненої речовини. Для цього використовують речовину і воду. Іноді розбавляють водою інший розчин.
Наприкінці літа засолюють огірки, помідори, деякі гриби. Для цього застосовують розчин кухонної солі з масовою часткою від 6 до 8%. Саме такий розчин достаньою мірою подавляє життєдіяльність хвороботворних мікроорганізмів та пліснявого гриба, і в той же час не перешкоджає процесам молочно-кислого бродіння.
Для приготування такого розчину спочатку обчислюють масу солі, визначають кількість столових ложок солі, яку необхідно відміряти. Об'єм води вимірюють літровою банкою.
Питання 1.
Яка масова частка кухонної солі оптимальна для засолювання огірків?
а) 5%
б) 7%
в) 10%
Питання 2.
Чому масу води для приготування розчину варто виміряти літровою банкою?
Питання 3.
Для приготування цукатів фрукти заливають 20%-м сиропом. Як виговити 250 г такого розчину?
Відповіді:
- б
- Вода – це єдина речовина, маса якої збігається з об'ємом. 1 кг = 1л
- а) Обчислюємо масу цукру.
|
Дано: m(розчину)=250г ω (цукру) = 20% |
Розв'язання:
m(цукру) =
m(цукру) = Відповідь: m(цукру)-50 г. |
|
Знайти: m(цукру)-? |
б) Зважуємо 50 г цукру, та пересипємо в суху посудину.
в) Знаходимо масу води: m (води) = m(розчину) - m (цукру)= 250-50=200г
г) Вимірюємо об'єм води (200 мл), та переливаємо до посудини зі зваженим цукром. Перемішуємо. Розчин готовий
Тест 39 (Реакції води з оксидами)
Вода досить активна речовина, вона взаємодіє з багатьма речовинами – і простими (активними металами), і складними (оксидами).
Оксиди металів взаємодіють з водою з утворенням гідроксидів або основ.
Гідроксиди (основи) – це сполуки металічних елементів з гідроксогрупою – ОН. Кількість ОН-груп в основі дорівнює валентності металу у сполуці. Реакції води з оксидами відносяться до реакцій сполучення.
Вода також взаємодіє з великою кількістю оксидів неметалів утворюючи кислоти. Винятком буде силіцій (IV) оксид (пісок), що з водою не реагує.
Кислоти – це складні речовини, що складаються з атомів Гідрогену та кислотних залишків.
Кислоту чи основу можна виявити за допомогою індикаторів. Індикатори – це речовини які змінюють свій колір в кислому, або основному середовищі.
Питання 1
Позначення сполуки силіцій (IV) оксиду:
а) SO2
б) CO2
в) SiO2
Питання 2
Які кольори мають індикатори в кислому середовищі?
Питання 3
Допишіть рівняння хімічних реакцій:
а) Na2O + H2O →
б) CaO + H2O →
в) SO3 + H2O →
г) N2O5 + H2O →
Відповіді:
- в
- Фенолфталеїн – безбарвний, метилоранж – рожевий, лакмус фіолетовий – червоний, універсальний індикатор – червоний.
- а) Na2O + H2O → 2NaOH
б) CaO + H2O → Ca(OH)2
в) SO3 + H2O → H2SO4
г) N2O5 + H2O → 2HNO3
Тест 40 (Значення води. Кислотні дощі.)
Без води не можна уявити життя на нашій планеті. Вода утворює одну із «сфер» Землі – гідросферу. Вода - учасник фотосинтезу. Організм людини існує завдяки воді. Біологічні рідини нашого організму – це водні розчини (кров, жовч, лімфа, шлунковий сік, піт). Потреби людини у воді – 1,5 – 2 л щодня. Але найбільше води людина використовує у побуті.
Вперше термін «кислотний дощ» був уведений англійцем Ангусом Смітом в 1872 р.
Терміном «кислотний дощ» називають усі види метеорологічних опадів: дощ, сніг, град, туман, кислотність яких вища нормальної. Дощова вода має кислотність рН=5,6. Кислотні опади негативно впливають на рослини, спричиняють хвороби у тварин, людей, руйнують будівельні матеріали, посилюють корозію металів.
Питання 1
Сполуки яких елементів викликають «кислотний дощ»?
а) Нітрогену та Сульфуру
б) Карбону та Оксигену
в) Гідрогену та Фосфору
Питання 2
Чому деякі цінні скульптури у Римі були перенесені в закриті приміщення і замінені копіями?
Питання 3
Які заходи направлені на зменшення утворення «кислотних дощів», ви можете запропонувати?
Відповіді:
- а
- Скульптури містять в своєму складі мармур, який дуже піддається впливу сполук Нітрогену і Сульфуру, які містяться в «кислотних дощах».
- Використання палива, що містить мало домішок сполук Сульфуру. Вловлювати сірчистий газ і знову повертати у виробництво. Знижувати температуру згоряння палива (так запобігають утворенню оксидів Нітрогену). Зміна конструкцій двигунів, введення спеціальних добавок до пального.
Використані джерела
- Григорович О.В., Віценцик А.В. Хімія. Збірник задач та вправ .7-11 класи – Х., Видавництво «Ранок», 2008
- Дячук Л.С., Загнибіда Н.М. Ігрові технологіії навчання на уроках хімії – Тернопіль-Харків: Видавництво «Ранок», 2010
- Науменко Г.С., Загубинога О.О. Дидактичні ігри на уроках хімії в курсі 12-річної школи.- Х., Вид.група «Основа», 2008
- Попель П.П., Крикля Л.С.Підручник для 7 класу загальноосвітніх навчальних закладів. – К., Видавничий центр «Академія», 2015
- Хімія. Уроки. І семестр, 7 клас / упрядн. І.Філоненко. – К.: Вид.дім «Перше вересня», 2015.
- Хімія. Уроки. ІІ семестр, 7 клас / упрядн. І.Філоненко. – К.: Вид.дім «Перше вересня», 2015.
1
-
Цікавий посібник


про публікацію авторської розробки
Додати розробку
