Типи кристалічних решіток
Типи кристалічних решіток (ґраток)
В твердих речовинах молекули і атоми розташовані у просторі певним чином. Кристалічна гратка – це розташування в просторі іонів, атомів або молекул у певному систематичному порядку. Залежно від природи частинок, що утворюють кристалічні гратки, розрізняють такі їх типи: іонні, атомні, молекулярні та металічні.
Типи кристалічних решіток (ґраток)
В твердих речовинах молекули і атоми розташовані у просторі певним чином. Кристалічна гратка – це розташування в просторі іонів, атомів або молекул у певному систематичному порядку. Залежно від природи частинок, що утворюють кристалічні гратки, розрізняють такі їх типи: іонні, атомні, молекулярні та металічні.
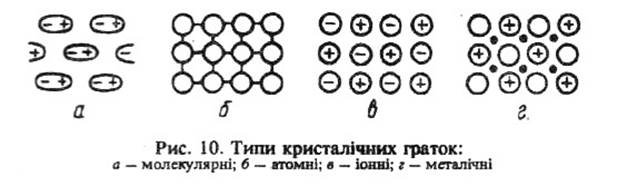
Типи граток визначаються типами зв’язків між частинками. В молекулярній: ковалентний між атомами в молекулах і водневий між молекулами. В атомній: ковалентний. Іонній: іонний. Металічній: металічний.
Ковалентний (атомний, гомеополярний) зв’язок зумовлений виникненням електронних пар, спільних для обох атомів. В них сили взаємодії між атомами кристалічної решітки виникають внаслідок обміну електронів між сусідніми атомами, тобто електрони кожного атома ніби належать обом. Кристали твердого тіла з ковалентним зв’язком характеризуються великою енергією зв’язку, високою твердістю, малою електропровідністю при низьких температурах. Кристал з ковалентним зв’язком – алмаз, він має кубічну решітку. Водневий зв’язок виникає між атомами водню та атомами різко електронегативного елемента другої або тієї самої молекули даної речовини.
Іонний зв’язок зумовлений утворенням в молекулі електронних пар за рахунок переходу валентних електронів від одного атома до іншого. Між позитивними і негативними іонами виникають сили електростатичного притягання. Іони розташовуються в решітці на віддалях, що відповідають мінімуму енергії. Приклад іонного кристалу – кристал кухонної солі. Іонні кристали мають просту решітку, кристалізуються в кубічній системі.
Металічний зв’язок утворюється між іонами (атомами) металів у кристалах за участю вільних електронів. Усі валентні електрони даної системи беруть участь в утворенні металічного зв’язку. Металічні кристали мають ряд характерних властивостей, і найістотнішою з них є їх висока електропровідність при низьких і високих температурах, що зумовлено наявністю вільних електронів, не зв’язаних з кожним атомом решітки. Такий зв’язок реалізований наприклад в натрію.
Характерною особливістю кристалічної решітки є те, що для неї (незалежно від її типу) можна знайти таку найменшу просторову групу атомів, повторенням якої у просторі можна дістати уявлення про всю решітку. Така
1
група атомів називається елементарною коміркою. Для всіх кристалічних тіл існує лише обмежене число можливих елементарних комірок. За типом елементарної комірки всі кристалічні тіла можна згрупувати у системи (їх називають сингонії). Сингонії відрізняються взаємним розташуванням атомів в елементарній комірці, величиною кутів між сторонами елементарної комірки. У природі є лише сім різних сингоній: триклинна, тригональна, моноклінна, гексагональна, ромбічна, тетрагональна і кубічна
.
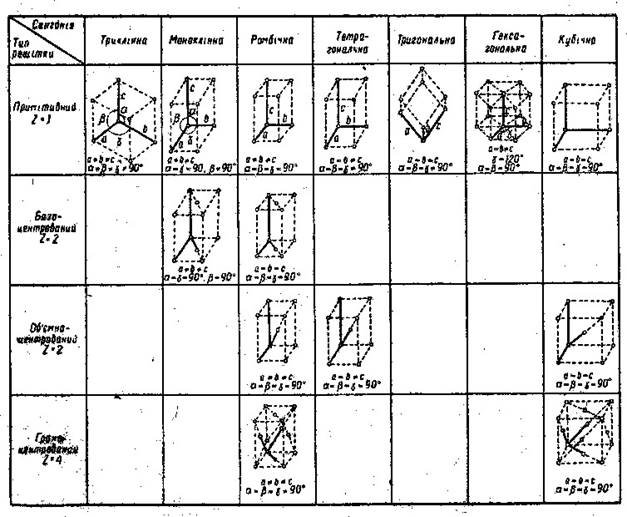
Кожна комірка кристалічної решітки являє собою паралелепіпед. Якщо атоми розташовані лише в кутах комірки, вона називається простою. Якщо крім того, в центрі комірки перебуває атом, комірка називається об’ємоцентрованою, а якщо, крім атомів, на кутах є атоми в центрі кожної грані, то комірка називається гранецентрованою.
Література
1. Г.А.Зісман і О.М.Тодес, том ІІІ, 1968 р.
2. А.А.Астахов. Довідник з хімії для вчителів, 1975 р. 3. М.Є.Фонкич. Нові розділи шкільного курсу фізики, 1971 р.
2


про публікацію авторської розробки
Додати розробку
