Тиск газу. Рівняння стану ідеального газу
ОДЕСЬКИЙ ПРОФЕСІЙНИЙ ЛІЦЕЙ МОРСЬКОГО ТРАНСПОРТА
Тема уроку: ІЗОПРОЦЕСИ. ГАЗОВІ ЗАКОНИ.
Мета уроку: ввести поняття «ізопроцес, ізотермічний, ізобарний, ізохорний процес»;ввести газові закони, які відповідають різним ізопроцесам; пояснити графіки ізопроцесів; формувати вміння розв’язувати розрахункові та графічні задачі.
Тип уроку: комбінований урок.
Обладнання та наочність: портрети Менделєєва, Клапейрона, Бойля, Маріотта, Геё-Люссака, Шарля.
ХІД УРОКУ
- Організаційний етап
- Актуалізація опорних знань та вмінь
- Що ви розумієте під параметрами стану?
- Які параметри характеризують стан газу? Чи пов’язані вони між собою? Наведіть приклади.
- Яка форма рівняння стану містить більше інформації: рівняння Клапейрона чи Менделєєва-Клапейрона?
- Вивчення нового матеріалу
План вивчення нової теми:
- Визначення ізопроцесу.
- Визначення ізотермічного, ізобарного, ізохорного процесів.
- Газові закони.
- Графіки ізопроцесів.
1) Ізопроцеси
Стан певної маси газу визначається трьома макроскопічними параметрами - тиском p, об’ємом V і температурою T.
Однак багато процесів у газах, що відбуваються в природі або здійснюються в техніці, припустимо розглядати (приблизно) як процеси, у яких змінюються лише два з них. Особливу роль у фізиці й техніці відіграють так звані ізопроцеси.
Ізопроцесами називаються процеси, що протікають із певною масою газу за постійного значення одного з трьох параметрів — тиску, об’єму або температури.
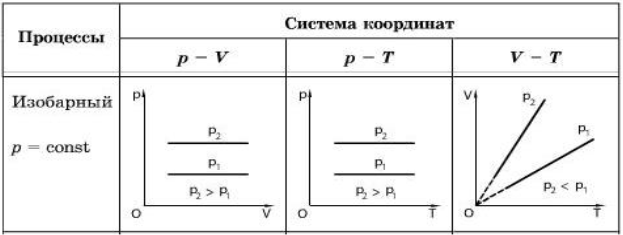
2) Ізобарний процес
Зміна об’єму й температури газу за постійного тиску називається ізобарним процесом.
Під час ізобарного процесу об’єм газу прямо пропорційний його абсолютній температурі: V/T =const за p =const. Це співвідношення називають законом Гей-Люссака - на честь французького вченого, який відкрив його на початку ХІХ ст.
Закон Гей-Люссака дозволяє пов’язати значення об’єму і температури певної маси газу у двох різних станах, якщо тиск газу в обох станах однаковий.
Позначимо V1 і T1 значення об’єму й температури газу в стані 1, а V2 і T2 — у стані 2.
Тоді зі співвідношення: V/Т = const маємо: V1/Т1=V2/ Т2, або інакше: V1/V2 = T1/ Т2 .
- Під час ізобарного процесу об’єм певної маси газу прямо пропорційний його абсолютній температурі.
Співвідношення між об’ємом певної маси газу й абсолютною температурою за постійного тиску зображено графічно на рисунку.
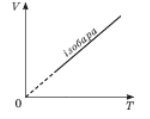 Цей графік називають ізобарою.
Цей графік називають ізобарою.
Він показує, що за постійного тиску об’єм газу прямо
пропорційний його абсолютній температурі.
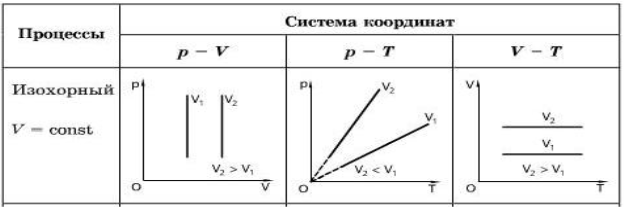
3) Ізохорний процес
Зміну тиску й температури газу за постійного об’єму називають ізохорним процесом.
Якщо нагрівати газ постійного об’єму, - тиск газу збільшуватиметься прямо пропорційно абсолютній температурі. Це означає, що під час ізохорного процесу тиск газу прямо пропорційно його абсолютній температурі: p/T = const за V =const.
Залежність тиску газу від температури було досліджено наприкінці XVIII ст. французьким ученим Шарлем, тому наведене співвідношення називають законом Шарля.
 У разі ізохорного процесу тиск певної маси газу прямо пропорційний
У разі ізохорного процесу тиск певної маси газу прямо пропорційний
його абсолютній температурі: р1/р2 = Т1/Т2.
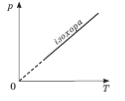
Графік залежності p(T) за V =const називають ізохорою.
Цей графік показує, що за постійного об’єму тиск газу прямо пропорційний його абсолютній температурі.
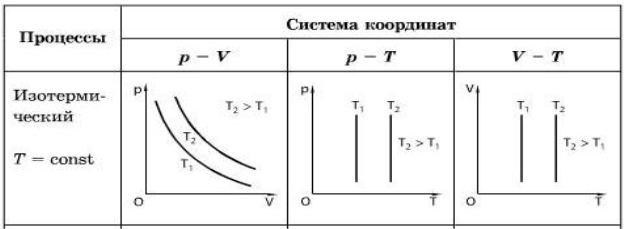
4) Ізотермічний процес
Зміну тиску й об’єму газу за постійної температури називають ізотермічним процесом.
Якщо стискати газ за постійної температури, тиск зростає обернено пропорційно об’єму. Це означає, що під час ізотермічного процесу тиск газу обернено пропорційний його
об’єму: pV =const за T =const.
 Це співвідношення було виявлено на досліді в другій половині XVII ст. англійським ученим Бойлем і французьким ученим Маріоттом, тому його називають законом Бойля-Маріотта.
Це співвідношення було виявлено на досліді в другій половині XVII ст. англійським ученим Бойлем і французьким ученим Маріоттом, тому його називають законом Бойля-Маріотта.
У разі ізотермічного процесу тиск певної маси газу обернено
пропорційний його об’єму: p1*V1 = p2*V2
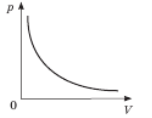
Графік залежності p(V) за T =const називають ізотермою.
Цей графік показує, що за постійної температури тиск газу
обернено пропорційний його об’єму.
- Закріплення вивченого матеріалу
- Учимося розв’язувати якісні задачі:
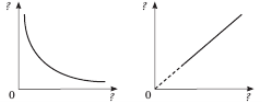 а) Дано два графіки того самого ізопроцесу.
а) Дано два графіки того самого ізопроцесу.
Що це за процес? У яких осях він зображений?
б) З газом деякої маси виконали замкнений процес,
зображений на діаграмі в координатах p( V). Накресліть цю діаграму
в координатах p(T), V(T).
2. Учимося розв’язувати розрахункові задачі:
А) За температури –23 °С газ займає об’єм 60 л. Яким буде об’єм газу за температури 127 °С? Тиск газу не змінився.
Б) Газ ізотермічно стисли від об’єму 8 л до об’єму 6 л. Тиск при цьому зріс на 4 кПа. Яким був початковий тиск?
Про що ми дізналися на уроці:
- Ізопроцесами називаються процеси, що протікають з певною масою газу за постійного значення одного з трьох параметрів — тиску, об’єму або температури.
-
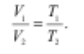 Закон Гей-Люссака: у разі ізобарного процесу об’єм певної маси газу
Закон Гей-Люссака: у разі ізобарного процесу об’єм певної маси газу
прямо пропорційний його абсолютній температурі:
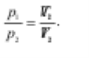 Закон Шарля: у разі ізохорного процесу тиск певної маси газу прямо пропорційний його абсолютній температурі:
Закон Шарля: у разі ізохорного процесу тиск певної маси газу прямо пропорційний його абсолютній температурі:

- Закон Бойля-Маріотта: у разі ізотермічного процесу тиск певної маси газу обернено пропорційний його об’єму:
- Підбиття підсумків уроку.
- Домашнє завдання
- Завдання за підручником. Вивчити __________
- Підготуватися до лабораторної роботи на тему: «Дослідна перевірка закону Бойля-Маріотта».
- Розвязати якісні задачі:
1) Накресліть графік ізотермічного процесу в координатах (V, T) і ( p, T). (див. додаток 1)
2) Накресліть графік ізобарного процесу в координатах ( p, T) і ( p, V). (див. додаток 1)
3) Накресліть графік ізохорного процесу в координатах (V, T) і ( p, V). (див. додаток 1)
Додаток 1
Газові закони:
ЗАКОН БОЙЛЯ–МАРІОТТА
ЗАКОН ГЕЙ-ЛЮССАКА
ЗАКОН ШАРЛЯ
Викладач фізики: О.Р.Білоцерковець

про публікацію авторської розробки
Додати розробку
