Урок - дослідження «Хімічні властивості глюкози: повне і часткове окиснення, відновлення, взаємодія з гідроксидами металічних елементів, бродіння (спиртове і молочнокисле)"
Дата: Урок-дослідження
Конспект уроку в 11 класі на тему: «Хімічні властивості глюкози: повне і часткове окиснення, відновлення, взаємодія з гідроксидами металічних елементів, бродіння (спиртове і молочнокисле), естерифікація»
Мета: навчальна - закріпити знання учнів про класифікацію вуглеводів, будову молекули глюкози (лінійної та циклічної форми), розглянути хімічні властивості глюкози: повне і часткове окиснення, відновлення, взаємодію з гідроксидами металів, види бродіння, реакцію етерифікації; закріпити практичні вміння та навички щодо виконання хімічного експерименту, повторити правила БЖД під час роботи з хімічними реактивами;
розвиваюча - продовжити формувати вміння учнів порівнювати та узагальнювати на прикладі матеріалу про будову й властивості альдегідів та спиртів; формувати вміння складати рівняння хімічних реакцій, що характеризують властивості глюкози, уміння виконувати лабораторні досліди, робити висновки зі спостережень;
виховна - виховувати пізнавальну активність та самостійність учнів.
Поняття і терміни: моносахариди, дисахариди, полісахариди, альдегідоспирт, якісна реакція, функціональна група, енергія, бродіння, фотосинтез.
Матеріали та обладнання: таблиці, схеми, «Чорний ящик», друкований дидактичний матеріал, реактиви: розчин глюкози, купрум ( ІІ) сульфат, натрій гідроксид, кальцію глюконат, сорбіт, штативи з пробірками, пробіркотримачі, спиртівки, мультимедійний проектор, КЗ.
Тип уроку: урок формування навичок і вмінь; урок - дослідження.
Місце уроку в навчальній темі: поточний.
Методи і методичні прийоми: словесні – бесіда з використанням демонстрації та лабораторного експерименту, пояснювально-ілюстративні — демонстрація, репродуктивні, проблемно-пошукові, практичні (виконання вправ, лабораторний дослід), наочні, метод самостійної роботи, інтерактивні.
Міжпредметні зв ́язки: біологія, основи здоров’я.
Хід уроку
1. Організаційний етап
Привітання, побажання здоров’я та успіху на уроці.
Доброго дня! Сідайте будь ласка. Черговий, скажіть, хто відсутній на уроці? (Слайд 1)
2. Перевірка домашнього завдання.
На попередньому уроці ми вивчали тему «Вуглеводи».
Давайте перевіримо ваші знання, написавши «Графічний диктант».
(Слайд 2,3)
Графічний диктант «Глюкоза»
- В природі вуглеводи утворюються в процесі фотосинтезу?
- Сахароза належить до полісахаридів?
- Тривіальна назва глюкози – виноградний цукор?
- Формула целюлози – C6H12O6?
- Моносахариди здатні до гідролізу?
- Формула глюкози та фруктози – C6H12O6?
- Загальна формула вуглеводів – Cn(H2O)m?
- Cахароза належить до класу полісахаридів?
- Глюкоза містить в своєму складі 5 гідроксильних груп та 1 альдегідну групу?
- Формула целюлози та крохмалю – (C6H10O5)n?
- Глюкоза – альдегідоспирт?
- Глюкоза та фруктоза – природні полімери?
3. Актуалізація опорних знань
Слово вчителя.
Вуглеводи… Це ті самі солодощі, які ви так любите: фрукти, торти, цукерки, варення, шоколад тощо. Особливо багато вуглеводів містить виноград. Вуглеводи — життєво важливі речовини, які необхідні кожному організму. Ці речовини витрачаються у процесі функціонування організму, тому людина має постійно поповнювати їхні запаси.
Задача. (Слайд 4,5)
Масові частки Карбону, Гідрогену та Оксигену, що входять до складу сполуки, дорівнюють відповідно 0,4; 0,06; 0,54. Визначити формулу сполуки, якщо її молекулярна маса становить 180.
![]()
 Дано:
Дано:
W(C) = 0,4
W(H) = 0,06
W(O) = 0,54
![]() Mr(CxHyOz) = 180
Mr(CxHyOz) = 180
CxHyOz - ?
Відповідь. C6H12O6
Завдання. (Слайд 6)
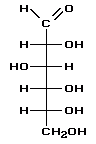 Запишіть структурну формулу глюкози, знаючи будову її молекули.
Запишіть структурну формулу глюкози, знаючи будову її молекули.
![]() або O
або O
![]() CH2OH – ( CHOH )4 – C
CH2OH – ( CHOH )4 – C
глюкоза H
4. Мотивація навчальної діяльності
Учень вносить «чорний ящик». У ящику знаходяться: скляна блискуча іграшка на ялинку, дзеркало, шоколад в обгортці з фольги. (Слайд 7)
Проблемне запитання:
- Що спільного між цими предметами?
В кінці уроку ми дамо відповідь на це запитання.
Розглянувши хімічні властивості глюкози, ми ознайомимось з деякими лікарськими засобами: глюконатом кальцію, сорбітом. Також зрозуміємо, які відбуваються такі незамінні в природі процеси як бродіння, повне окиснення глюкози та розглянемо її значення для живих організмів.
5. Повідомлення теми та мети уроку
Тема уроку: «Хімічні властивості глюкози: повне і часткове окиснення, відновлення, взаємодія з гідроксидами металічних елементів, бродіння (спиртове і молочнокисле), естерифікація»
Мета уроку:
- розглянути хімічні властивості глюкози: повне і часткове окиснення, відновлення, взаємодію з гідроксидами металів, види бродіння, реакцію етерифікації;
- продовжити розвивати вміння учнів складати рівняння хімічних реакцій, що характеризують властивості глюкози;
- виховувати пізнавальну активність та самостійність учнів.
(Слайд 8)
6. Вивчення нового матеріалу
Хімічні властивості глюкози обумовлені наявністю гідроксильних та альдегідної груп. Тому глюкоза вступає в реакції, характерні для спиртів і альдегідів.
Протягом вивчення нового матеріалу учні заповнюють опорний конспект.
- Реакції окиснення (реакції, характерні для альдегідної групи).
Перегляд відеодосліду «Взаємодія глюкози з аргентум (І) оксидом»:
![]()
![]() O tº O
O tº O
![]()
![]()
![]()
![]() CH2OH – ( CHOH )4 – C + Ag2O CH2OH – ( CHOH )4 – C + 2Ag
CH2OH – ( CHOH )4 – C + Ag2O CH2OH – ( CHOH )4 – C + 2Ag
глюкоза H глюконова кислота OH
- Якого кольору стали стінки пробірки?
 Це якісна реакція на альдегідну групу. Вона називається реакція «срібного дзеркала».
Це якісна реакція на альдегідну групу. Вона називається реакція «срібного дзеркала».
(Слайд 9)
Виконання лабораторного досліду № 14.
Інструктаж з техніки безпеки (Слайд 10)
- Уважно читайте етикетку на посудині з тією речовиною, яку берете для досліду.
- Наливайте та насипайте реактиви над столом.
- Нюхайте всі речовини з обережністю, не нахиляйтесь над посудиною і не вдихайте повними грудьми, а спрямовуйте до себе пару чи газ рухами руки.
- Щоб уникнути перегрівання та розстріскування пробірки, ніколи не нагрівайте її лише знизу, а рівномірно прогрівайте всю пробірку, весь її зміст.
-
 Лабораторний дослід № 14.
Лабораторний дослід № 14.
Взаємодія глюкози з купрум (ІІ) гідроксидом:
а ) зміна кольору речовини при додаванні купрум (ІІ) гідроксиду
(утворюється розчин блакитного кольору) – реакція на гідроксильні групи;
б ) зміна кольору речовини при додаванні купрум (ІІ) гідроксиду при нагріванні (утворюється осад червоно-цегляного кольору) – реакція на альдегідну групу: (Слайд 11)
![]()
![]() O tº O
O tº O
![]()
![]()
![]() CH2OH–( CHOH )4–C + 2Cu(OH)2 CH2OH – (CHOH)4 – C + 2CuOH +H2O
CH2OH–( CHOH )4–C + 2Cu(OH)2 CH2OH – (CHOH)4 – C + 2CuOH +H2O
глюкоза H глюконова кислота OH
tº
![]()
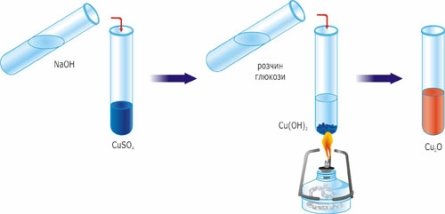 2СuOH Cu2O + H2O
2СuOH Cu2O + H2O
- Наявність яких функціональних груп підтверджує даний дослід?
- Реакція відновлення:
![]() O Ni
O Ni
![]()
![]() CH2OH–( CHOH )4–C + H2 CH2OH – (CHOH)4 – CH2OH
CH2OH–( CHOH )4–C + H2 CH2OH – (CHOH)4 – CH2OH
глюкоза H сорбіт (шестиатомний спирт)
 Сорбіт міститься в ягодах, фруктах, водоростях, має солодкий смак. Вперше був виділений з плодів горобини. Сорбіт не підвищує вмісту глюкози в крові, тому його використовують замість цукру в харчуванні людей, хворих на цукровий діабет. (Слайд 12)
Сорбіт міститься в ягодах, фруктах, водоростях, має солодкий смак. Вперше був виділений з плодів горобини. Сорбіт не підвищує вмісту глюкози в крові, тому його використовують замість цукру в харчуванні людей, хворих на цукровий діабет. (Слайд 12)
4. Утворення сахаратів: (Слайд 13)
![]()
![]()
![]()
![]()
![]()
![]()
![]() O О CH2OH – ( CHOH )4 – C + Ca (OH)2 CH2OH – CH – CH – (CHOH)2 – C + H2O
O О CH2OH – ( CHOH )4 – C + Ca (OH)2 CH2OH – CH – CH – (CHOH)2 – C + H2O
![]()
![]() H O О H
H O О H
![]()
![]()
- Реакції бродіння: (Слайд 14)
а) спиртове бродіння (ферментативне, під дією дріжджів)
дріжджі
![]() С6H12O6 2C2H5OH + 2CO2
С6H12O6 2C2H5OH + 2CO2
етанол
б) молочнокисле бродіння
![]()
![]() C6H12O6 2CH2 – CH – COOH
C6H12O6 2CH2 – CH – COOH
OH
молочна кислота

- Реакція естерифікації: (Слайд 15)
![]()
![]() O
O
![]()
![]() C6H7O (OH)5 + 5HOOC–CH3 C6H7O( C )5 + 5H2O
C6H7O (OH)5 + 5HOOC–CH3 C6H7O( C )5 + 5H2O
O – CH3
Одна молекула глюкози взаємодіє з п’ятьма молекулами оцтової кислоти, що підтверджує наявність у молекулі глюкози п’яти спиртових гідроксогруп.
- Повне окиснення глюкози: (Слайд 16)
![]() C6H12O6 + 6O2 6CO2 + 6H2O
C6H12O6 + 6O2 6CO2 + 6H2O
6. Закріплення та узагальнення знань
- Відтворення інформації: (Слайд 17)
- Які типи хімічних реакцій характерні для глюкози?
- Які функціональні групи входять до складу глюкози:
спиртові, карбонільна, карбоксильна, фенольна?
- Дати відповідь на проблемне запитання: (Слайд 18)
- Що спільного між предметами, котрі знаходяться в «чорному ящику»?
(«Срібний» ефект досягається завдяки реакції «срібного дзеркала»)
2. Оперування поняттями (тестові завдання): (Слайд 19)
1. Які з вивчених органічних сполук забезпечують реакцію «срібного дзеркала»:
- вуглеводні;
- спирти;
- вуглеводи;
- карбонові кислоти;
- альдегіди.
2. Які з наведених хімічних реакцій характеризують хімічні властивості глюкози?
- С6Н12О6+6О2→6СО2↑+6Н2О
- С12Н22О11 + Н2О →С6Н12О6 + С6Н12О6
- С6Н12О6 → 2 С2Н5 ОН + 2СО2↑
- nС6Н1206 → (С6Н10О5)n+nН20
3.Установіть відповідність між типом вуглеводу й кількістю моносахаридів, які утворюються під час гідролізу.
-
 Більше 10 моносахаридів
Більше 10 моносахаридів
- Від 2 до 10 моносахаридів
- 2 моносахариди
- Не піддається гідролізу
7.Рефлексія (Слайд 20)
Демонстрація досліду «Фараонові змії»
(Розклад кальцій глюконату при температурі)

Це цікаво
В організмах деяких жаб глюкоза знайшла незвичайне застосування. У зимовий час інколи можна знайти жаб, які повмерзали в льодяні глиби, але після розмерзання земноводні оживають. Який же тут секрет? З настанням холодів у крові жаб у 60 разів збільшується кількість глюкози. Це й заважає утворення всередині організму кристалів льоду, що було б для них смертельним. (Слайд 21)
8. Підсумок
Вчитель аналізує і проводить оцінювання. (Слайд 22)
9. Д/З.
Вивчити відповідний параграф у підручнику.
1


про публікацію авторської розробки
Додати розробку
